坏消息:只需高脂高糖饮食4个月,肥胖、胰岛素抵抗、认知障碍齐齐来!不过,正常饮食8周即可逆转!
2022-03-09 LILYMED MedSci原创
Aging Dis.:暴露于高质高糖饮食的雄性和雌性小鼠的海马体和皮层中的认知障碍和代谢物谱改变,可通过饮食逆转正常化!
神经退行性疾病的发病率正在以散发的形式在全球范围内增加,这可能是由于寿命延长和不健康的生活方式所致。特别是,肥胖与心血管疾病、代谢综合征和2型糖尿病(T2D)等共病密切相关,这些疾病影响大脑,并与轻度认知障碍、阿尔茨海默病或血管性痴呆有关。与肥胖和代谢紊乱相关的脑功能障碍机制包括葡萄糖毒性、血管功能障碍、线粒体损伤、氧化应激、突触衰竭或神经炎症。在啮齿动物模型中,肥胖和代谢综合征与脑功能和新陈代谢的改变有关。

磁共振波谱(MRS)可以对区域代谢谱进行无创分析。糖尿病和相关共病已被证明会引起脑内n -乙酰天冬氨酸、肌酸、胆碱、肌醇、谷氨酸和谷氨酰胺浓度的变化。在多种糖尿病模型中也观察到代谢的改变,在长期暴露于致肥性饮食而产生代谢综合征的啮齿动物中也观察到代谢的改变。虽然长期接触致胖饮食引起的代谢综合征是可逆的,然而,由致肥胖饮食引起的脑功能障碍是否由永久性脑改变引起仍有待确定。本研究旨在验证长期接触高脂肪高蔗糖饮食(HFHSD)会导致大脑功能(行为)和新陈代谢的可逆改变这一假设。

本研究检查了肥胖饮食(高脂肪和高蔗糖饮食;HFHSD)引起海马体和皮层代谢的可逆变化以及行为的改变。小鼠暴露于HFHSD24周或16周,然后8周的饮食正常化。实验组小鼠被随机分配到3组,一组接收对照饮食(CD,n = 12雄+ 15名雌),一组高脂肪和高蔗糖饮食(HFHSD)6个月(n = 13雄+ 13名雌),另一组是喂食HFHSD 4个月(n=9雄+ 10雌),然后喂食CD 2个月(图1A)。在体内实验24周后采集脑组织样本(见下文)。
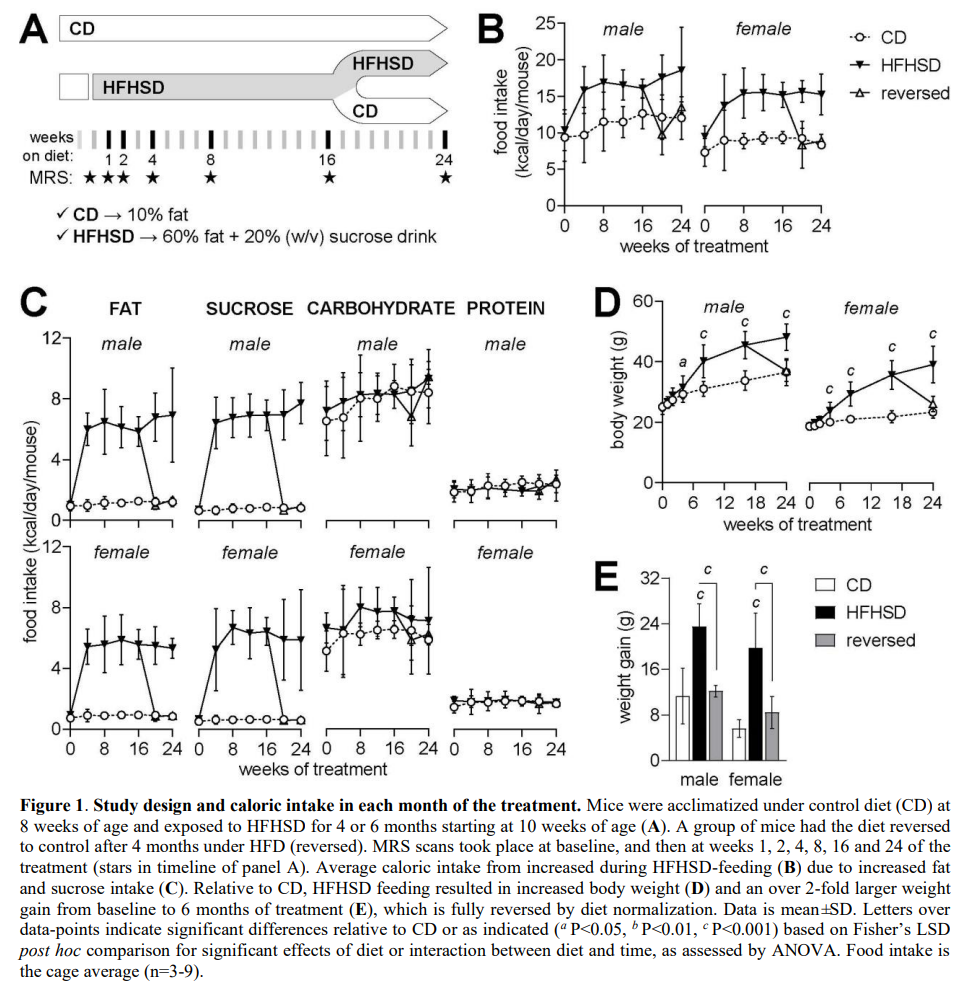
食物摄入量和代谢表型
与对照组相比,食用HFHSD的小鼠摄入了更高的热量(图1B),这是因为摄入了更多的脂肪和蔗糖,而不是碳水化合物或蛋白质(图1C)。因此,喂食HFHSD的小鼠变得超重,但在过渡到对照组饮食后又恢复到正常水平(图1D)。与对照组相比,从基线到研究结束,食用高果糖高脂食品的小鼠的体重增加更高,但饮食逆转的小鼠组没有增加(饮食P<0.001;性别P<0.001;相互作用P=0.657;图1E)。
与先前在喂食致肥胖饮食的小鼠中的研究一致,HFHSD导致葡萄糖稳态的性别依赖性失衡,在饮食逆转后完全恢复(图 2)。有趣的是,在治疗24周结束时,HFHSD相关的葡萄糖耐受在雄性小鼠中比雌性小鼠更严重(图 2B-C),雌性的胰岛素抵抗可以忽略不计(图 2F)。GTT 期间的葡萄糖清除率(图 2A),由曲线下的葡萄糖面积(24周时:饮食P<0.001;性别P<0.001;相互作用P=0.056;图 2B)和推注后2小时的葡萄糖水平(24周时:饮食P<0.001;性别P<0.001;相互作用P=0.025;图 2C)定义,喂食HFHSD后受损。
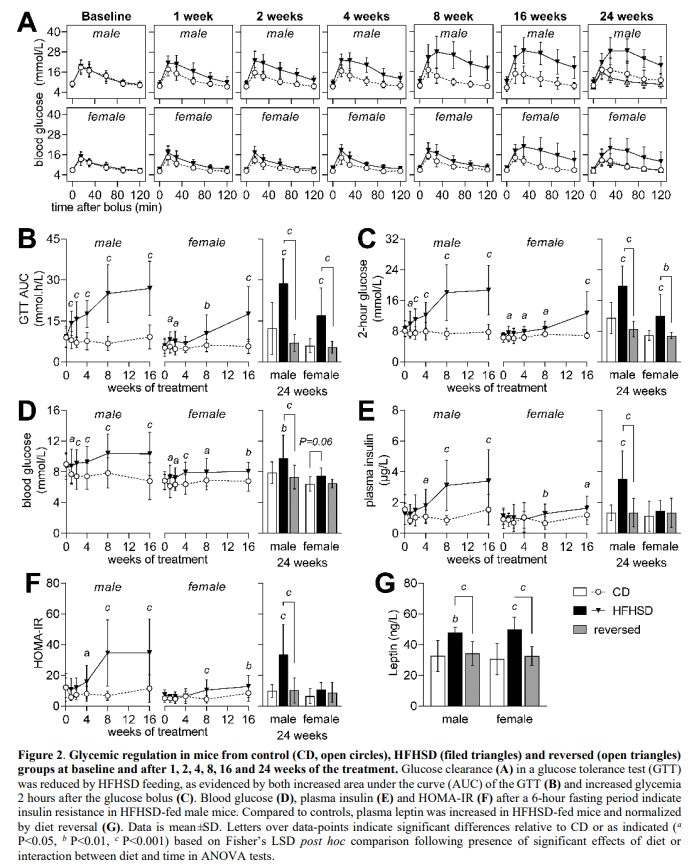
喂食HFHSD的小鼠空腹血糖(饮食P<0.001;性别P<0.001;相互作用P=0.292;图2D)和血浆胰岛素水平(饮食P<0.001;性别P=0.011;相互作用P=0.007;图2E)略有升高。这转化为HOMA-IR(胰岛素抵抗的稳态模型评估)的增加,表明胰岛素抵抗(饮食P<0.001;性别P= 0.001;相互作用P = 0.003;图2 f)。与对照组相比,HFHSD喂养的小鼠血浆瘦素增加,但饮食逆转组没有增加(饮食P<0.001;性别P=0.815;相互作用P=0.801;Fig.1G)。综上所述,HFHSD喂养引起的肥胖可引起葡萄糖耐受不良和胰岛素抵抗,并可通过饮食逆转而正常化。
HFHSD诱导的行为改变
在建立了饮食对血糖控制的可逆影响后,接着研究代谢综合征是否与行为改变相关。通过测量y迷宫在表型发展过程中的自发转换来评估空间工作记忆(图3a)。饮食对自发改变(24周时:饮食P=0.353;性别P = 0.034;交互作用P=0.334),或探索行为由手臂条目的数量描述(在24周:饮食P=0.638;性别P = 0.116;交互P = 0.988)无影响。
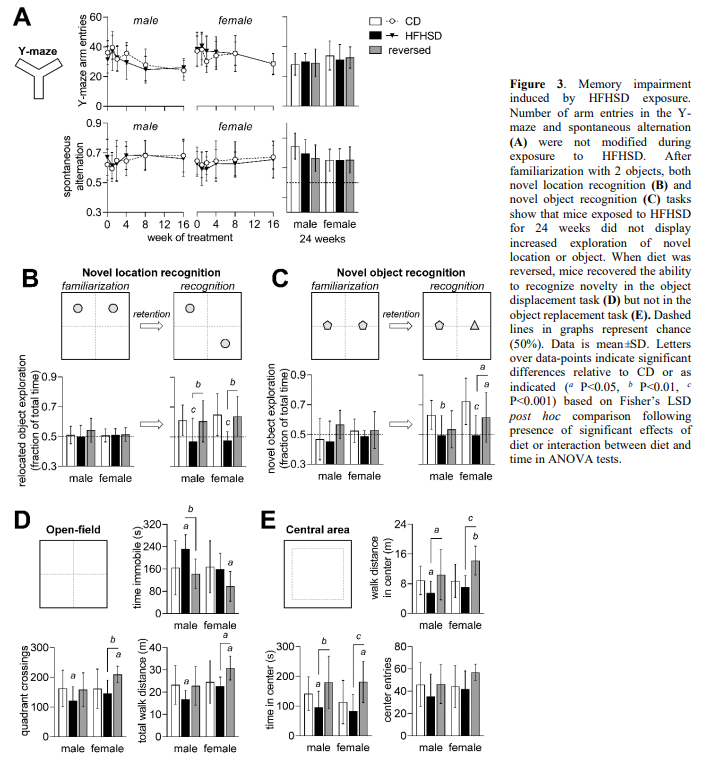
接下来,在引入这些饮食24周后检测了对新颖性的认知。在熟悉了两个物体之后,老鼠通常倾向于花更多的时间去探索一个新的物体,或者一个在竞技场上被取代的物体。当测试新位置识别时(饮食P<0.001;性别P=0.341;相互作用P=0.867;图3C)或新的物体识别(饮食P<0.001;性别P = 0.059;交互P = 0.308;图3 d),与HFHSD相比,逆转饮食组在新颖位置识别任务中完全恢复了记忆表现(图3C),并在新颖物体识别任务中提高了记忆表现(图3D)。
检查了8分钟的露天探索。HFHSD暴露减少了在竞技场内行走的总距离(饮食P=0.006;性别P=0.004;相互作用P=0.224;图 3E)。此外,与对照组相比,喂食HFHSD的雄性小鼠在竞技场的象限中表现出较少的交叉次数(饮食P = 0.008;性别P = 0.047;相互作用P = 0.234),并且增加了静止时间(饮食P = 0.006; 性别P = 0.030; 相互作用P = 0.121)。总而言之,这些结果表明HFHSD暴露后,新的环境探索减少了,并在饮食逆转后正常化。
通常,啮齿动物花费更多的时间探索竞技场的外围,靠近墙壁,而不是没有保护的中心区域。HFHSD喂养小鼠花费更少的时间(饮食P<0.001;性别P=0.375;相互作用P=0.716;图 3F)并在竞技场中心走了较短的距离(饮食P<0.001;性别P= 0.071;互动P = 0.256)。对中心与外围的探索减少表明HFHSD喂养的小鼠的焦虑样行为增加,其在饮食正常化后恢复。
代谢物谱
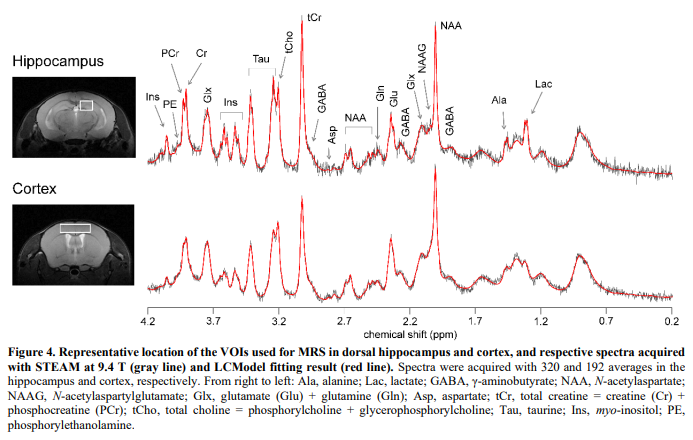
雄性和雌性小鼠的行为变化相似(图3)。此外,之前已经证明,MRS在海马体和皮层中测量的代谢物谱在雄性和雌性小鼠中相似。因此,为了增加统计力,我们将雄性和雌性小鼠分组,分析其代谢产物谱。图4描述了VOI在海马和皮层的位置,以及各自的光谱。
在海马体(图 5),由HFHSD引发的最早代谢改变是乳酸水平的降低(P<0.05,与4周饮食时的对照相比),持续到治疗结束。谷氨酸盐(P<0.01),N-乙酰基氨基甲酸酯(NAA;P<0.05),牛磺酸(P<0.001)和肌酸(P<0.001)相对对照组在8周时增加,并在整个干预过程中保持高水平。在16周时,与对照组相比,HFHSD喂养的小鼠中GABA(P<0.001),肌醇(P<0.01),磷酸肌酸(P<0.001)和谷胱甘肽(P<0.001)的浓度增加。HFHSD喂养还导致治疗8周时丙氨酸水平(P<0.01)和治疗16周时N-乙酰基甲酰谷氨酸(NAAG)水平的短暂变化(P<0.05)。海马体中的所有这些代谢改变在饮食逆转后8周消失(图5)。
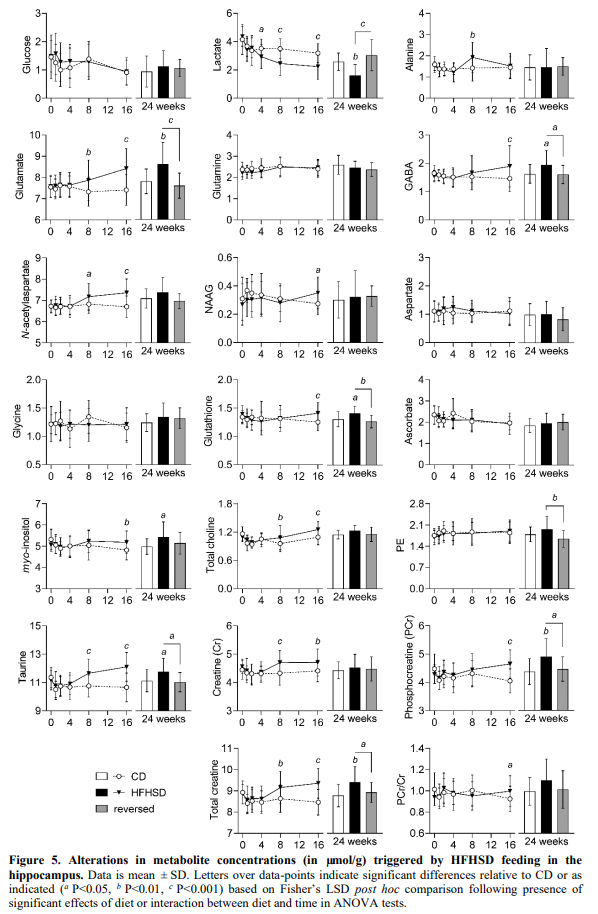
总的来说,皮质内的代谢物分布(图6)与海马相比,HFHSD喂养对HFHSD喂养的影响较小,且变化通常朝着相反的方向。虽然皮质乳酸水平保持不变,但与对照组相比,HFHSD喂养的小鼠从治疗8周开始丙氨酸浓度增加(P<0.01)。与对照组相比,进一步观察到HFHSD诱导的皮质n -乙酰天冬氨酸P<0.05)从8周开始,谷氨酰胺(P<0.01)和谷胱甘肽(P<0.01)从16周开始下降。在HFHSD喂养1周和8周时,皮质甘氨酸浓度呈短暂增加(P<0.05,与对照组相比)。虽然在24周的治疗中,HFHSD喂养的小鼠和对照组的甘氨酸水平相似,但它们通过饮食逆转而增加(P<0.05与对照组和HFHSD相比)。
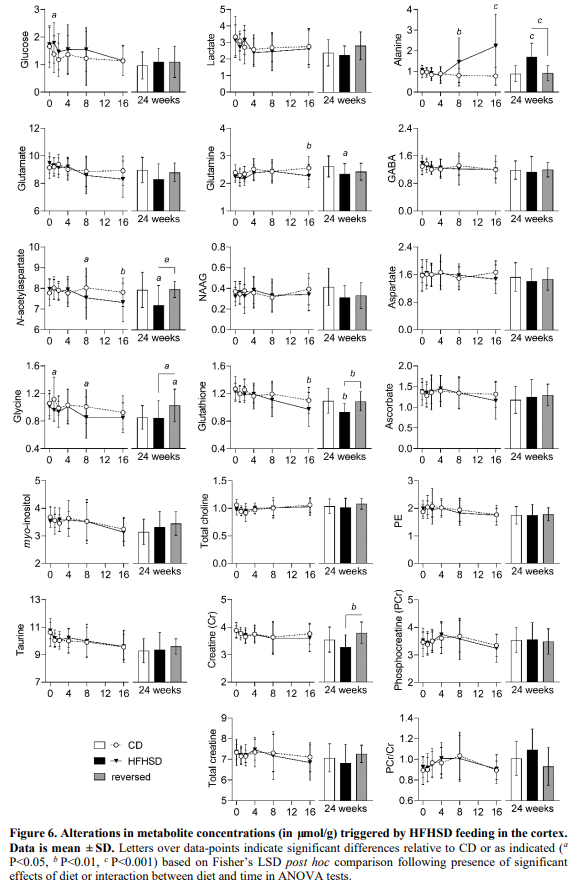
脑葡萄糖水平取决于血糖以及脑葡萄糖摄取和消耗的速率。与血糖升高相一致,与喂养对照饮食的小鼠相比,观察到喂养HFHSD的小鼠脑葡萄糖水平升高的趋势( 图 5-图 6)。
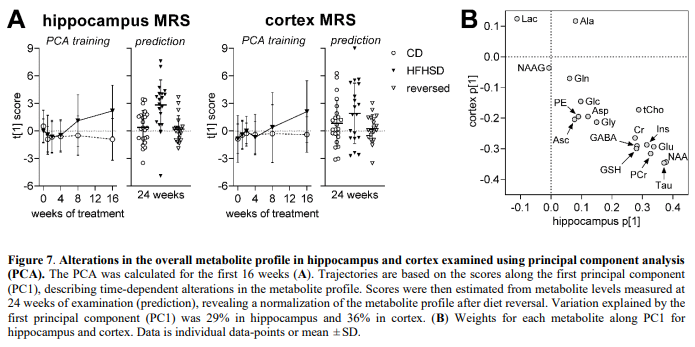
使用主成分分析(PCA)来提供大脑代谢的全局描述。该分析显示,海马体的脑代谢转变(相对于对照组)始于HFHSD喂养8周(图 7A)。对治疗前16周期间收集的MRS数据进行PCA,然后用于计算24周时获得的代谢物谱的PCA得分。该分析显示饮食逆转后海马代谢物谱的正常化(图7A)。皮质的结果不太明显,与饮食干预的前16周在该区域观察到的不太明显的代谢改变一致(图7A)。PCA将牛磺酸和NAA描述为HFHSD对脑代谢谱影响中最具影响力的代谢物(图7B)。
HFHSD中神经炎症和神经退行性变的分析
据报道,暴露于致肥性饮食会发生神经炎症。因此利用荧光显微镜观察Iba1、CD11b、GFAP和谷氨酰胺合成酶,探究HFHSD暴露24周后是否存在神经炎症和胶质细胞增生(图8A)。HFHSD对皮质或海马小胶质细胞(Iba1和CD11b阳性细胞)的面积和数量均无影响(图8B)。反过来,HFHSD诱导激活的小胶质细胞比例显著增加(饮食P<0.001;大脑区域P = 0.221;相互作用P = 0.737),通过饮食逆转使其正常化。经GFAP和谷氨酰胺合成酶(星形胶质细胞特异性酶)免疫标记观察,HFHSD对皮质或海马星形胶质细胞数量无影响(图8C)。
值得注意的是,谷氨酰胺合成酶被用作星形细胞的标记,因为皮质星形细胞仅在皮质表面和一些血管周围显示GFAP染色。海马和皮层中谷氨酰胺合酶所占的区域(图8C)或海马中GFAP所占的区域(未显示)在分析的区域中也相似。对皮层和海马蛋白提取物中Iba1和GFAP的免疫印迹在3组中相似,证实了小胶质细胞和星形胶质细胞的总面积没有变化(图8D)。此外,还没有观察到海马中炎症调节因子NF-κβ或细胞因子表达水平的改变(图8E)。
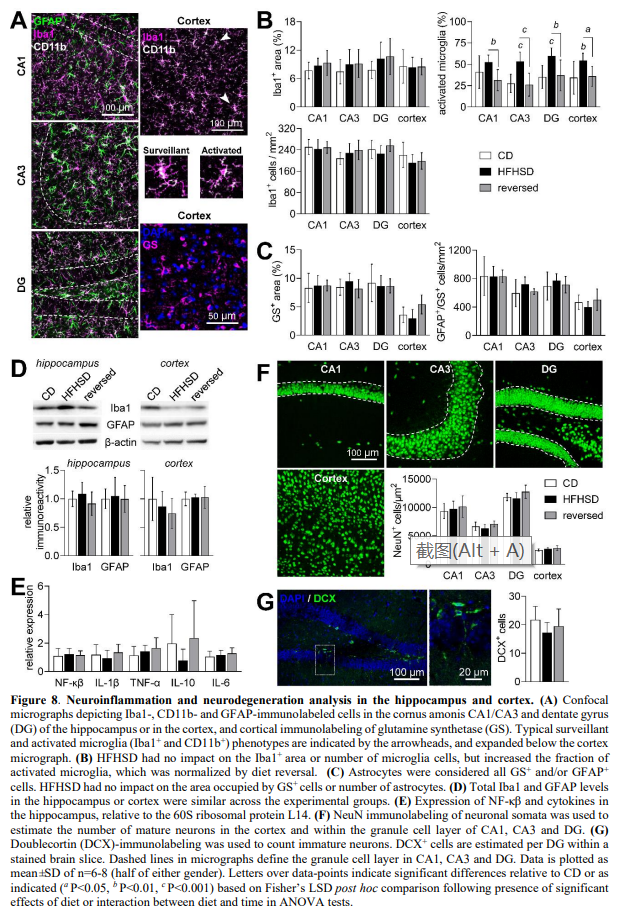
NeuN免疫标记显示,HFHSD对皮质或海马颗粒细胞层的成熟神经元数量没有影响(图8F)。此外,在海马分子层或海马门内未观察到HFHSD诱导的神经元计数变化。此外,海马齿状回双皮质蛋白阳性细胞(未成熟神经元)的数量在各实验组之间没有变化(图8G)。总之,这些结果表明,在不存在促炎表型、星形胶质细胞增生或神经元缺失的情况下,长期HFHSD喂养时表型小胶质细胞发生改变。
综上,喂食HFHSD的小鼠出现肥胖,葡萄糖不耐受和胰岛素抵抗,雄性小鼠的表型比雌性小鼠更严重。相对于对照组,雄性和雌性HFHSD喂养的小鼠都表现出焦虑样行为增加,物体识别任务中的记忆受损,但保留了通过Y迷宫中的自发交替评估的工作空间记忆。在海马体和皮层中都观察到代谢物谱的改变,但在海马体中更明显。HFHSD诱导的代谢变化包括乳酸,谷氨酸盐,GABA,谷胱甘肽,牛磺酸,N-乙酰基隔膜酸,总肌酸和总胆碱水平的改变。值得注意的是,HFHSD诱导的代谢综合征,焦虑,记忆障碍和大脑代谢改变在饮食正常化8周后恢复。总之,长期HFHSDy饮食引起的皮质和海马紊乱是可逆的,而不是永久性组织损伤的结果。
总的来说,本研究揭示了HFHSD喂养的小鼠皮质和海马代谢物谱的明显系统性改变。代谢谱的变化表明能量代谢的改变、抗渗透压失衡和线粒体应激的适应以及皮质神经变性。重要的是,尽管这些变化发生在致肥性饮食开始后的几周内,但在恢复健康饮食后,观察到的表型几乎完全逆转。因此,长期HFHSDy饮食引起的皮质和海马紊乱是可逆的,这表明对不健康饮食的反应是适应而不是永久性的脑组织结构损伤。
原文来源:
作者:LILYMED
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








梅斯的资讯真好,干货满满
42
#胰岛#
37
#高糖饮食#
35
#高脂#
53
喜欢
72