Science:阿尔茨海默病突触损伤的新机制,S-亚硝基化级联反应在神经病理中可能具有重要意义
2020-12-31 逻辑神经 Bio生物世界
研究表明,尽管Aβ具有神经毒性,然而去泛素化酶Uch-L1的S-亚硝基化也具有神经毒性,表现为突触损伤,而Uch-L1突变体(C152S)则具有神经保护作用。
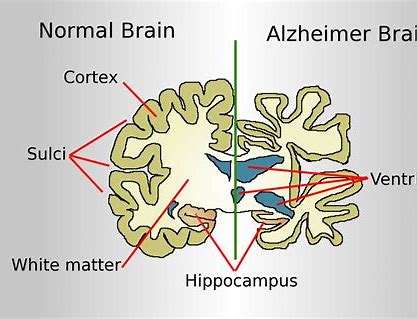
在神经系统中,一氧化氮(NO)过量可以产生亚硝化应激反应,导致神经退行性损伤。在阿尔茨海默病(AD), β-淀粉样肽(Aβ)的低聚化、过度神经兴奋、神经炎症等都会导致NO的产生,继而发生S-亚硝基化。
S-亚硝基化(S-nitrosylation,简称SNO)是一种快速可逆和精确定向的翻译后修饰,指NO阳离子(NO+)共价结合到半胱氨酸残基巯基(S-)上。SNO是系统发育中细胞信号传递的基本机制。
发动蛋白相关蛋白1(Drp1)是一种鸟苷三磷酸酶(GTPase),Drp1的S-亚硝基化会导致Drp1的过度激活,继而导致线粒体的破碎和生物能量的不足,再进而导致突触丢失,而突触数量减少与AD认知能力下降密切相关。因此这种S-亚硝基化反应可能参与了该AD的发病机制。
已被S-亚硝基化的周期蛋白依赖性激酶5(Cdk5)通过去亚硝基化反应将NO传递给Drp1,形成亚硝基化的Drp1。然而,这种病理性的一系列连续反应、及反应参与者还有待确定。这一问题的正确回答,将有助于我们进一步理解AD的发病机制,以及研发潜在的AD治疗药物。
美国斯克利普斯研究所(the Scripps Research Institute)的Stuart A. Lipton教授实验室长期从事于通过研究分子信号通路来阻止突触损伤,以及正常衰老和各种神经退行性疾病中的神经元损伤。在于2020年12月3日以Noncanonical transnitrosylation network contributes to synapse loss in Alzheimer’s disease为题发表在Science上的最新研究文章中,该实验室通过研究AD的体外和体内模型、以及人类AD死后大脑组织揭示了具有不同生化途径的不同催化活性的酶可以形成一种S-亚硝基化级联反应,导致AD突触损失:NO基团从去泛素化酶Uch-L1转移到Cdk5,然后再转移到Drp1。此研究提示一系列异常的亚硝基化途径和去亚硝基化途径在神经退行性疾病的病理生理中可能伴有重要角色。
Uch-L1,全称泛素羧基末端水解酶L1,是一种去泛素化酶,水解泛素羧基末端加合成分,产生泛素单体。为了方便,UCH-L1的S-亚硝基化,或S-亚硝基化的Uch-L1,统简称为SNO-Uch-L1。生物素转换方法(biotin-switch assay)是一种可以用来直接检测细胞或组织中蛋白质巯基亚硝基化(S-Nitrosylation)的生物素标记方法。首先作者通过生物素转换方法在SH-SY5Y和HEK细胞模型证实了SNO-Uch-L1的存在,在AD小鼠中,SNO-Uch-L1的水平明显上升。质谱结果显示Uch-L1的第152位点半胱氨酸的点突变(简称C152S)则会显著减弱这种S-亚硝基化。而且在Tg2576和hAPP-J20两种AD小鼠、以及AD人脑组织中,SNO-Uch-L1导致Uch-L1酶活性降低,而过表达Uch-L1则会改善突触功能和记忆性能。这些结果提示了Uch-L1活性在AD发病机制中的重要性。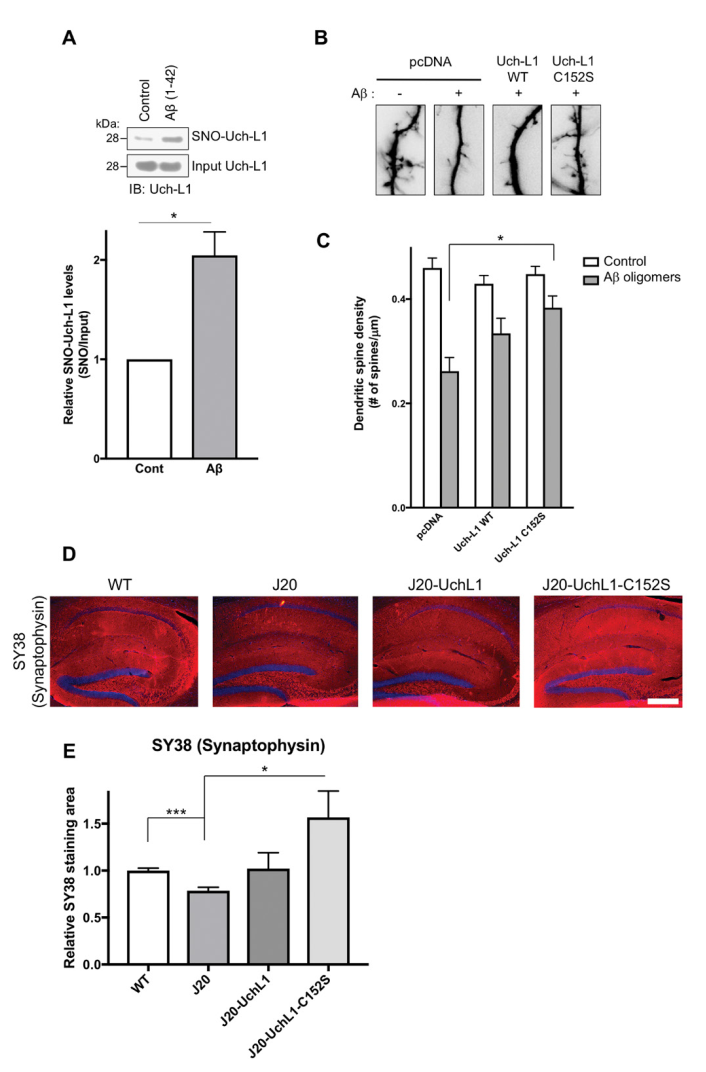
图1 Aβ低聚物诱导SNO-Uch-L1的形成,进而引起突触的缺失
(T. Nakamura et al., Science 2020; aaw0843)
紧接着,作者注意到,在大鼠原代皮层神经元中,过表达Aβ1-42低聚物会有SNO-Uch-L1的形成和突触的丢失(图1A-C)。那么,问题来了,突触的丢失是由Aβ1-42低聚物所引起,还是由SNO-Uch-L1所引起,亦或是由两者共同所致?在过表达Aβ低聚物的AD小鼠的齿状回中注射Uch-L1,免疫组化结果证实SNO-Uch-L1会导致突触的残缺(图1D-E)。这也暗示了人类AD中突触丢失与认知能力下降有密切的神经病理学关系。
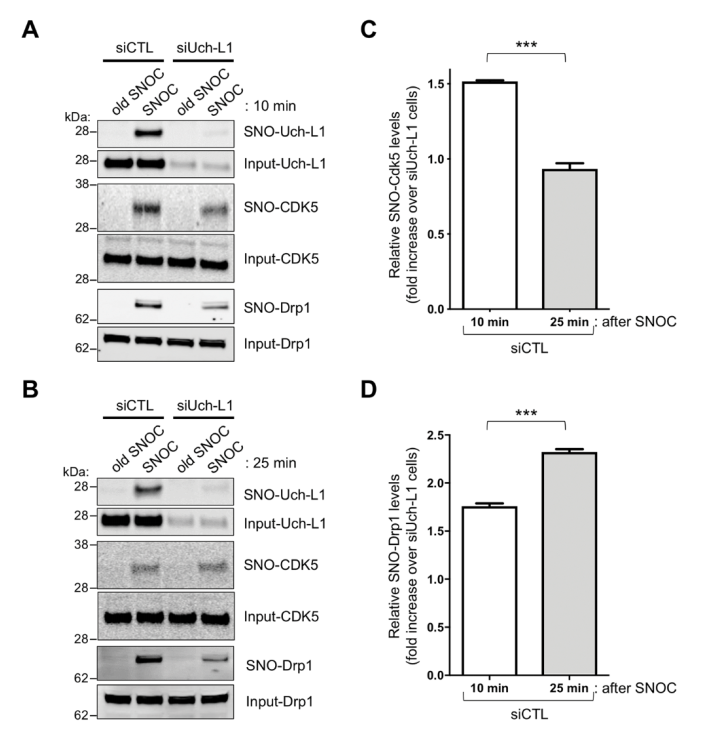
图2 NO基团的连续转移反应: 从Uch-L1转移到Cdk5(SNOC为亚硝基半胱氨酸,提供NO基团)
(T. Nakamura et al., Science 2020; aaw0843)
那么,在Uch-L1、Cdk5和Drp1三者之间,NO的转移有什么顺序关系?或从谁到谁再到谁(图2A)?之前有研究显示NO可以从SNO-Cdk5转移到Drp1,但是Cdk5上游的NO转移机制,特别是由Aβ介导的SNO机制,我们并不清楚。通过免疫印迹、生物素转变方法、SNO蛋白形成相对速率比较等一系列实验,作者观察到:在HEK细胞模型细胞模型内敲低Uch-L1则会明显观察到Cdk5和Drp1、以及SNO-Cdk5和SNO-Drp1的先(10分钟)后(25分钟)下降(图2-3);而在神经元细胞模型SH-SY5Y中,相比较野生型Uch-L1,表达突变体Uch-L1,即C152S(前文结果可知其可显著抑制Uch-L1的SNO)后,SNO-Cdk5和SNO-Drp1明显较少(图3A-E)。这些结果说明了NO转移顺序或SNO先后顺序,即从Uch-L1到Cdk5再到Drp1。
图3 NO基团的连续转移反应: 从Uch-L1到Cdk5再到Drp1
(T. Nakamura et al., Science 2020; aaw0843)
能斯特方程(Nernst equation)是指用以定量描述某种离子在两种不同体系间形成的扩散电位的方程表达式。在电化学中,能斯特方程用来计算电极上相对于标准电势而言的指定氧化还原对的平衡电压。简言之,能斯特方程能够表征离子浓度改变时电极电势的变化。因此作者设计了一种能斯特方程,定量分析了S-亚硝基化反应(SNO)的热力学特征。结果也再一次肯定了上述关于NO基团连续转移的结论。
这些研究结果与人类AD的神经病理生理学的相关性如何?因此,文章最后,研究人员应用AD患者死后脑组织进行了分析,发现:在AD疾病晚期SNO-UchL1的量显著增加,而对照组SNO-Uch-L1的量极低(图4A-B),这与Uch-L1的S-亚硝基化反应只有在疾病状态下的出现异常的先前观点是一致的;而且SNO-Uch-L1与总UchL1的比值明显增加,突触缺失也更为严重(图4A-B),这表明了在人AD脑内中SNO-Uch-L1的异常增加,具有(或表现出)突触病理生理意义(或特征),最终可能会加重AD。此外AD小鼠明显中也有这些类似现象(图4B)。
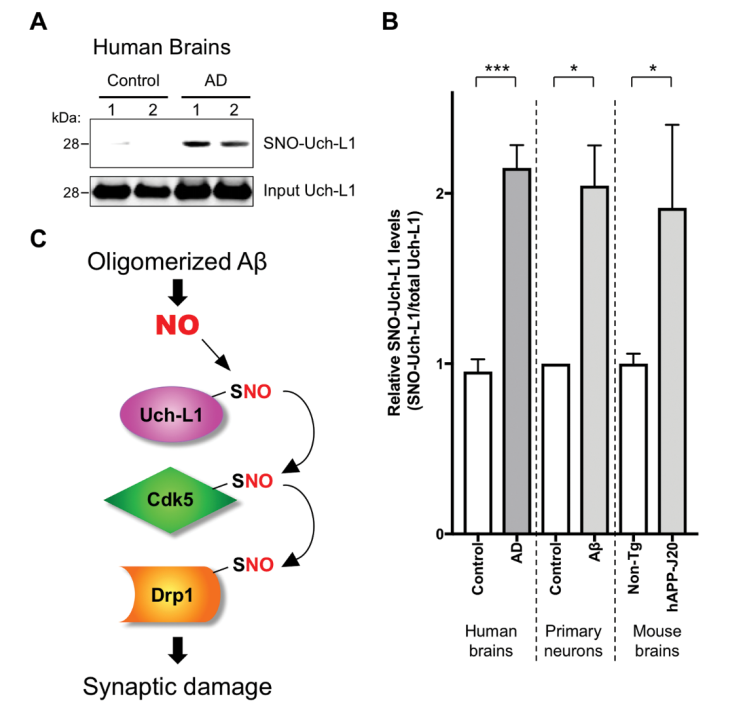
图4 AD患者大脑和小鼠中Uch-L1的SNO及比较,以及S-亚硝基化(NO转移)模型
(T. Nakamura et al., Science 2020; aaw0843)
结论与讨论、观点与展望
总的来说,首先,这项研究表明,尽管Aβ具有神经毒性,然而去泛素化酶Uch-L1的S-亚硝基化也具有神经毒性,表现为突触损伤,而Uch-L1突变体(C152S)则具有神经保护作用。
其次,作者证实了NO的连续转移反应:首先Aβ诱导产生NO,并与Uch-L1发生S-亚硝基化反应,形成SNO-Uch-L1;然后SNO-Cdk5发生S-去亚硝基化反应,产生新NO基团,并转移到Cdk5上,形成SNO-Cdk5;同理,NO基团从SNO-Cdk5转移到Drp1,最终形成SNO-Drp1(图4C)。这一级联反应可能影响AD的进展。
研究也提示我们,揭示泛素水解酶、激酶和GTPase等酶在AD等疾病条件下的亚硝基化反应机制可能是理解这些疾病病理过程的一类新思维,靶向这些酶的亚硝基化活性或去亚硝基化活可能是AD的治疗靶点。
最后,仔细看来,这篇文章的证据并不那么强有力,且还有很多未解之谜,但是研究者所提出的“非经典亚硝基化反应网络”、“去亚硝基化反应网络”,或许为我们将来理解神经退行性疾病(包括AD等)的复杂病理过程开辟了新思维、新方向。这种不同酶之间的亚硝基化级联反应,与经典的AD病理假设(Aβ,tau)、或其他非经典AD病理假设之间的逻辑关系如何?答案未知。
原始出处:
Tomohiro Nakamura, Chang-Ki Oh, Lujian Liao,et al.Noncanonical transnitrosylation network contributes to synapse loss in Alzheimer's disease. Science . 2020 Dec 3;eaaw0843. doi: 10.1126/science.aaw0843.
作者:逻辑神经
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#重要意义#
80
#阿尔茨海#
64
#阿尔茨#
75
#SCIE#
63
#损伤#
81