专访西湖大学蔡尚:肿瘤细胞内确实存在细菌,它们驱动了肿瘤转移
2022-04-14 王聪 “生物世界”公众号
《生物世界》第一时间采访了蔡尚研究员,一起来了解这项突破性成果的研究历程,以及带给我们的启发和影响。
2022年4月7日,西湖大学蔡尚团队在 Cell 发表论文,首次证实乳腺癌组织中存在的多种独特“胞内菌”在肿瘤转移定植过程中发挥关键作用。这项研究是对传统肿瘤转移理论的重大突破,引起了广泛关注。
《生物世界》第一时间采访了蔡尚研究员,一起来了解这项突破性成果的研究历程,以及带给我们的启发和影响。
乳腺癌,其发病率常年位居女性恶性肿瘤首位,因此被称为“粉红杀手”。而据世界卫生组织国际癌症研究署(IARC)发布的2020年全球最新癌症负担数据,乳腺癌已经取代肺癌,成为全球第一大癌症。我国的乳腺癌发病率也在逐年攀升。
更重要的是,乳腺癌的转移复发是导致乳腺癌病患死亡的最重要原因,一些在早期通过手术治疗的乳腺癌患者,在5-20年后可能还会出现转移性复发,这极大影响了乳腺癌患者的治疗和预后。找到乳腺癌转移的驱动力,有助于开发对应的治疗方法。
越来越多的研究表明,肠道菌群与多种类型的肿瘤进展有关,还会影响肿瘤免疫疗法的效果。与此同时,近些年来,肿瘤内菌群的存在及功能越来越受到科学家的关注。
在斯坦福大学工作期间,蔡尚在研究一个肿瘤转移相关基因时,使用抗生素四环素来诱导基因敲除,结果发现,对照组仅添加四环素而没有敲除肿瘤转移相关基因,肿瘤转移同样受到影响。此前也有论文报道抗生素影响肿瘤转移,但原因众说纷纭,他敏锐地意识到,肿瘤的转移可能与抗生素杀伤细菌的能力有关,也就是肿瘤中很可能存在细菌。
2017年,蔡尚回国加入刚刚成立的西湖大学,他决定启动对肿瘤内细菌的研究。而这一决定,可以说是一场探险,因为此时,肿瘤中是否存在细菌,如果存在,它们是否能够发挥作用,在很大程度上还是未知的。
近日,这一场探险迎来里程碑,蔡尚团队在肿瘤内细菌领域取得重大突破,2022年4月7日,蔡尚团队在 Cell 期刊在线发表了题为:Tumor Resident Intracellular Microbiota Promotes Metastatic Colonization in Breast Cancer 的研究论文【1】。
该研究首次证实乳腺癌组织中存在的多种独特 “胞内菌”在肿瘤转移定植过程中所起的关键作用。
这一理念是对传统肿瘤转移理论的重大突破,为深入理解肿瘤转移及临床治疗乳腺癌提供了全新的思路。

西湖大学生命科学学院博士后付爱坤,博士生尧冰清和董婷婷为论文共同第一作者,蔡尚研究员为通讯作者
对于这项突破性成果,蔡尚直言要感谢西湖大学给了自己足够的时间和空间,营造了敢于探索未知,不畏艰难失败的科研氛围。学校不以论文为考核指标,而是鼓励做最前沿的研究,充足的科研经费和优厚的薪酬,让自己能够沉心静气地坚持做开创而不跟随的研究。
2003年,从北京大学生命科学学院本科毕业后,蔡尚前往印第安纳大学生物化学系攻读博士学位,从事细胞分裂过程中纺锤体组装与染色体排列的分子机制的研究。2010年开始,蔡尚在斯坦福大学干细胞与再生医学研究所从事博士后研究工作,开始专注于乳腺癌研究。
2017年,蔡尚回国加入西湖大学生命科学学院,并组建了自己的实验室,开启了对肿瘤内细菌的研究,他们从经典的小鼠自发乳腺癌模型出发,构建了严格的肿瘤菌群研究体系,探索肿瘤微生物在肿瘤进展中的作用。

蔡尚团队部分成员
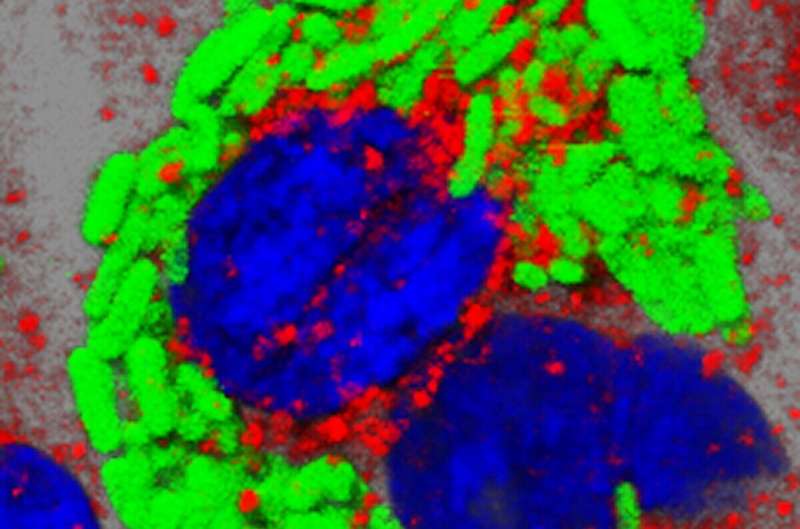
蔡尚告诉《生物世界》,彼时,肿瘤组织“胞内菌”还是一个未被证实的猜想,要想证实这一点,首先要看到它们的存在。研究团队不断改良检测和染色方法,提高灵敏度、信噪比和准确性,直到能够检测出10000个肿瘤细胞中仅含的1个细菌。最终,他们观察到了小鼠肿瘤里的细菌定位,并通过高分辨率的电镜清晰地看到了细菌存在于细胞质内。
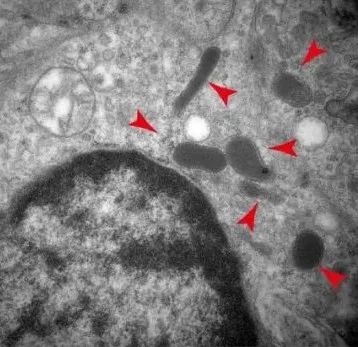
小鼠自发乳腺癌模型中存在胞内菌
2020年5月,一篇 Science 论文引起了广泛关注【2】,以色列魏茨曼研究所的研究人员通过对乳腺癌、肺癌、卵巢癌、胰腺癌、黑色素瘤、骨癌和脑肿瘤这7种常见实体瘤的超过1526个样本的分析,发现大部分实体瘤中含有细菌,这些细菌大多是存在于癌细胞内的“胞内菌”。而且,这些细菌可能具有肿瘤特异性,不同类型肿瘤中具有不同种类的细菌。
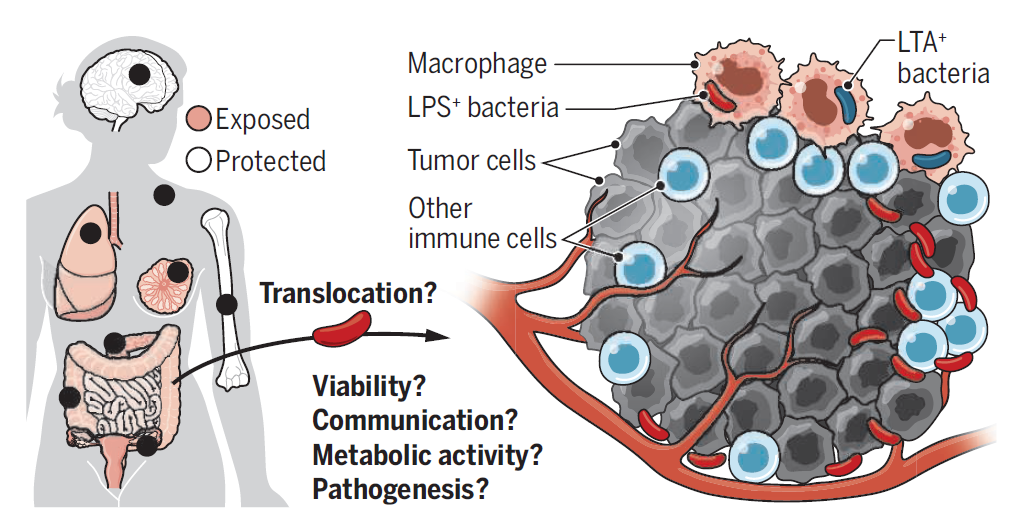
这些新的证据表明,细菌是多种肿瘤组织的组成部分,它们存在于肿瘤细胞内部,因此得以躲避免疫系统攻击,从而存活下来。
但它们在肿瘤的发生、发展中发挥什么样的作用?肿瘤中低生物量的细菌,是可有可无的旁观者,还是肿瘤进展的推动者?这些问题仍然有待解答。
蔡尚团队决定进一步探索这些细菌在肿瘤中的功能。他们通过调节抗生素组合种类和注射方式的搭配,实现了“定向”清除肿瘤菌群的目的。实验结果显示,清除肿瘤菌群之后,肿瘤重量并没有受到影响,但肺转移显着下降。这表明,肿瘤菌群很可能影响的不是肿瘤的生长,而是转移过程。
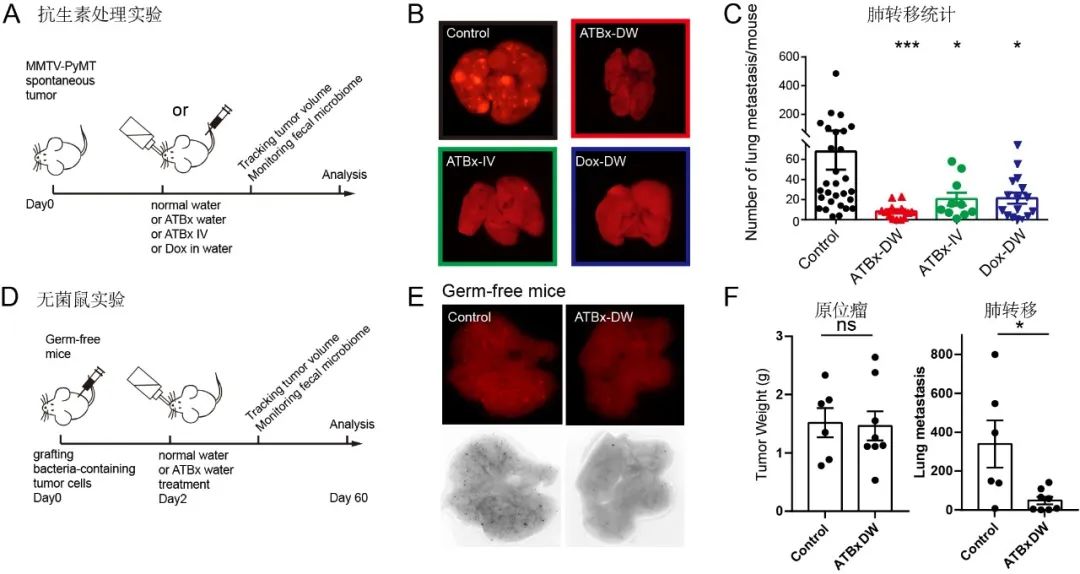
抗生素清除实验证明肿瘤菌群对于肿瘤转移非常重要
接下来,蔡尚团队发现,循环肿瘤细胞能够带着胞内菌转移到远端器官;此外,注射胞内菌能让那些原本不易转移的乳腺肿瘤开始转移;而使用抗生素消除这些胞内菌,则能减少乳腺肿瘤的肺转移,而不影响原位肿瘤的生长。
这些发现,有力地证明了肿瘤胞内菌可以促进肿瘤细胞的转移。
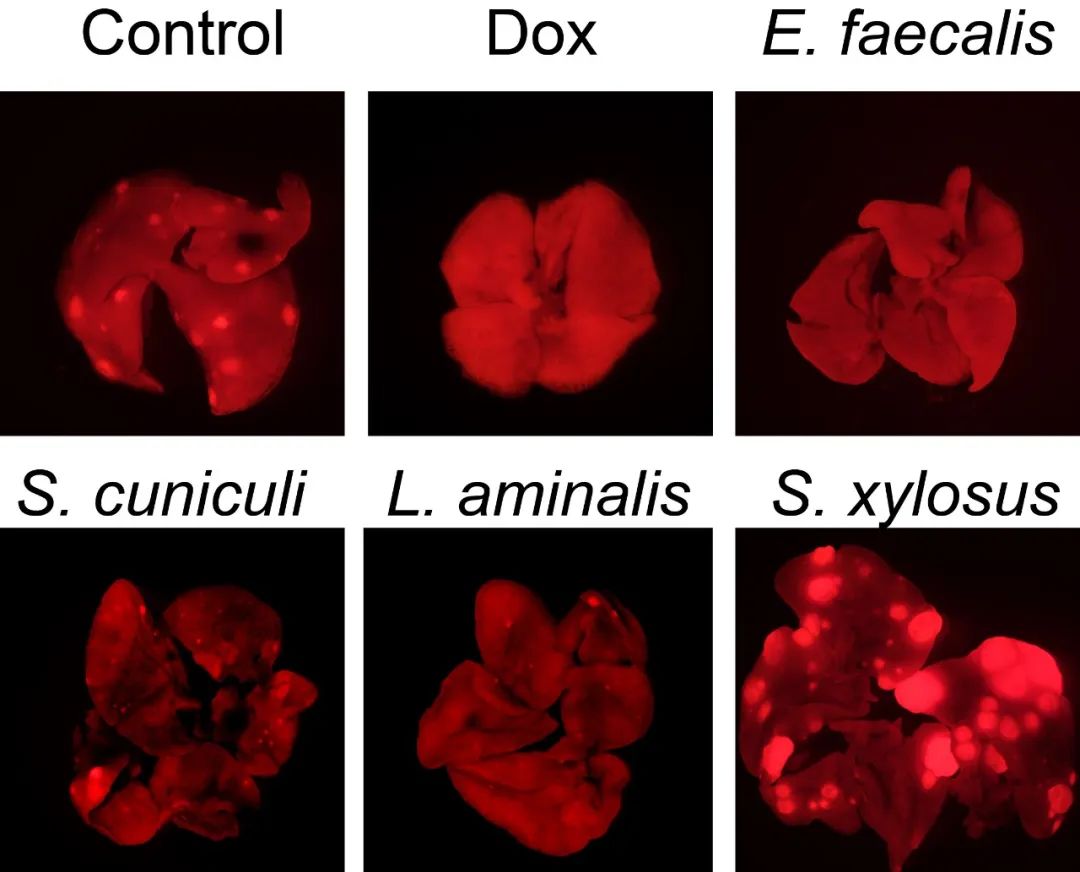
细菌回输促进乳腺癌转移
蔡尚团队还对乳腺癌组织中的细菌进行了非常详尽的分析和鉴定,发现这些“胞内菌”大多是革兰氏阳性菌,通常为兼性厌氧菌,它们种类众多,但以肠球菌、乳杆菌、链球菌、葡萄球菌为主,这四种菌占比达到80%左右。其中链球菌、乳杆菌、葡萄球菌能够促进肿瘤转移,而肠球菌则似乎不发挥作用。为何这些细菌在乳腺癌肿瘤组织中富集,还有待进一步研究,这可能与其特定的肿瘤微环境等因素有关。
蔡尚团队进一步揭示了胞内菌促进肿瘤转移的机制,肿瘤细胞在转移时,会受到血管中血压(液流压力)带来的损伤,但胞内菌入侵肿瘤细胞后,会通过特定的信号通路(RhoA-ROCK)来重塑细胞骨架,帮助肿瘤细胞抵抗血管里的压力,避免转移过程中受到损伤。这也完美解释了为什么携带胞内菌的肿瘤细胞拥有更强的远端器官转移能力。
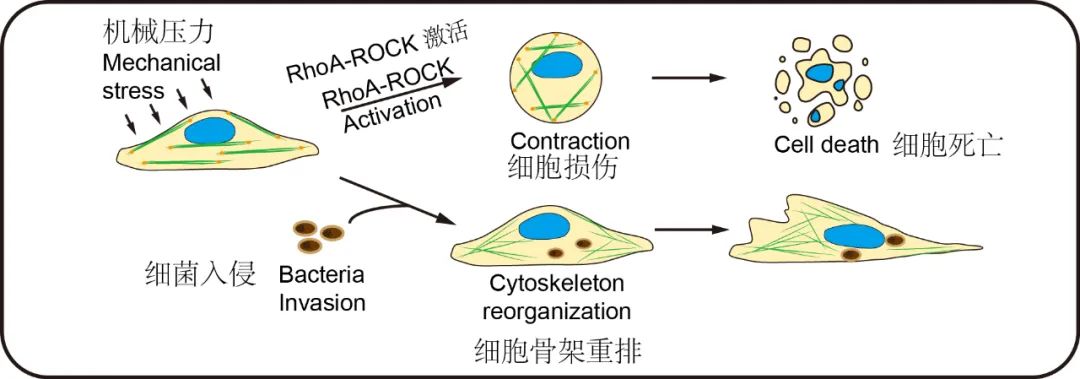
胞内菌的入侵重塑了肿瘤细胞的细胞骨架,以此来抵抗液流压力
最后,蔡尚团队从小鼠回归到人体,收集了配对的乳腺癌病人的肿瘤组织、癌旁组织和淋巴结组织,用 qPCR 结合 16S 测序定量和定性地分析各自菌群的组成。结果显示,小鼠乳腺癌组织和人类乳腺癌组织具有相同的微生物谱和动态变化,这表明,人类乳腺癌菌群可能在人类癌症发生和进展中起着相似的作用。
蔡尚表示,这项研究结果表明,肿瘤内隐藏着一个微生物群(肿瘤胞内菌),虽然生物量很低,但却在促进肿瘤转移方面发挥着重要作用。因此,针对这些胞内菌的干预有望抑制肿瘤转移,推动癌症治疗。
但蔡尚还强调,这项研究并不意味着抗生素就能给癌症患者的治疗带来益处,因为肿瘤转移的机制很复杂,肿瘤胞内菌介导的转移只是其中之一,控制这些胞内菌可能有助于抑制肿瘤转移,因此,抗生素可能有助于胞内菌介导的肿瘤转移。如何管理这些肿瘤胞内菌以改善癌症治疗是接下来一个值得研究的重要方向。
肠道菌群和免疫系统对肿瘤转移同样有着影响,蔡尚表示,研究团队花了很多精力来排除肠道菌群和免疫系统与肿瘤胞内菌共同作用以影响肿瘤转移,例如通过无菌小鼠(没有肠道菌群)和免疫缺陷小鼠的实验,表明肿瘤胞内菌可以独立于肠道菌群和免疫系统来发挥促进肿瘤转移的作用。接下来,团队将进一步深入分析这些细菌是如何侵入肿瘤细胞并整合在细胞内,以及携带胞内菌的肿瘤细胞如何与免疫系统相互作用的。
100多年前,美国医生威廉 · 科利(William Coley)意外发现一位癌症患者手术后的伤口感染了化脓性链球菌后,肿瘤竟然消失了,也由此开启了肿瘤免疫治疗的新篇章。近年来,一些研究团队和创业公司开始通过基因工程改造的细菌感染来激活免疫系统治疗实体瘤。而蔡尚团队的这项研究提示了我们,基于基因工程细菌的肿瘤免疫治疗有很大的应用前景,但是也要额外谨慎,需要确认这些细菌在激活免疫系统杀伤肿瘤细胞的同时,不会促进肿瘤转移。
最后,蔡尚表示,这项研究成果历时5年,从猜想、假设,到一步步证实,鉴定了肿瘤微环境中长期被忽视的新成员——肿瘤胞内菌,这些隐藏在细胞内部的微生物能够调控肿瘤细胞行为,通过不同于大多数癌症药物靶向的遗传、表观遗传或代谢成分在肿瘤转移中发挥关键作用,揭示了影响肿瘤转移的全新因素,开拓了肿瘤研究的新方向,也为临床控制肿瘤转移提供了全新的视角。
论文链接:
https://www.cell.com/cell/fulltext/S0092-8674(22)00260-4
https://www.science.org/doi/10.1126/science.aay9189
https://www.science.org/doi/10.1126/science.abc1464
作者:王聪
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言





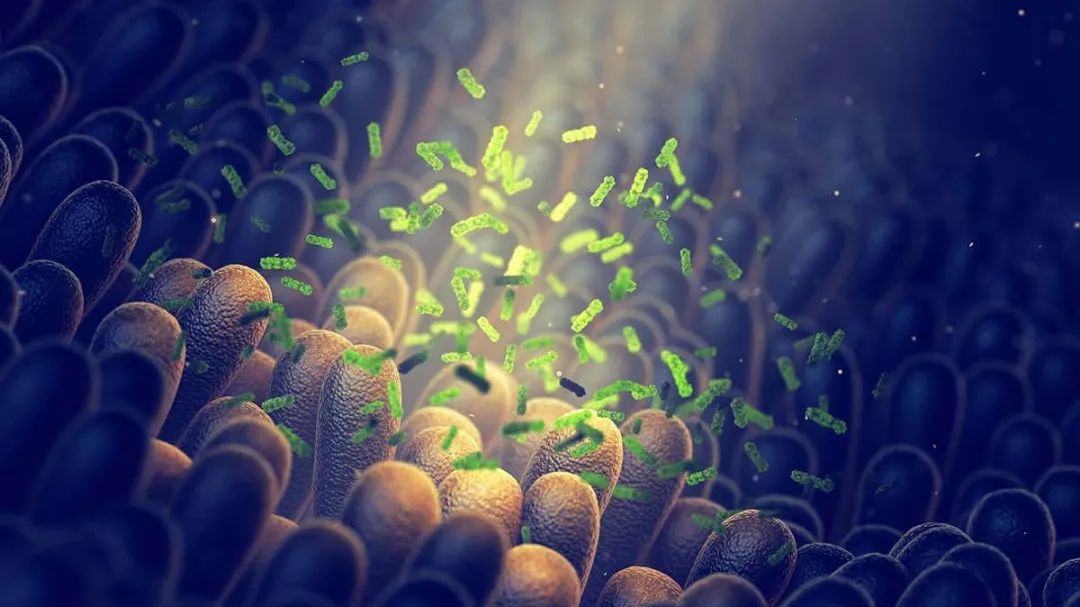


以色列魏茨曼研究所的研究人员通过对#乳腺癌#、#肺癌#、#卵巢癌#、#胰腺癌#、#黑色素瘤#、#骨癌#和#脑肿瘤#这7种常见实体瘤的超过1526个样本的分析,发现大部分#实体瘤#中含有细菌,这些细菌大多是存在于癌细胞内的“#胞内菌#”。#肿瘤内细菌##瘤内细菌#。 这些胞内菌,或瘤内细菌参与了肿瘤的复杂生物学行为,包括促进肿瘤的转移,肿瘤的增殖,当然,也介导了#肿瘤免疫#,因此,合理利用这些细菌,可能有助于#肿瘤免疫治疗#。 这些细菌是多样的,大多是#厌氧菌#和#革兰氏阴性菌#为主,如#沙门氏菌#,未来可以通过#基因工程#进行减毒,然后应用于临床。
199
#专访#
101
#肿瘤#细胞内确实存在#细菌#,#乳腺癌#中存在#胞内菌#
175
#肿瘤转移#
109
#肿瘤细胞#
165