一作兼通讯!Nature系列综述:蛋白质异构体提高药物的特异性和治疗效果
2024-09-09 BioMed科技 BioMed科技
讨论了蛋白质异构体在药物发现中的重要作用,以及如何利用这些异构体来提高药物的特异性和治疗效果。
大多数蛋白质编码基因能够通过选择性剪接产生多种蛋白质异构体,这些异构体在结构和功能上可能存在显著差异,且其表达可能在特定疾病、组织或发育阶段中具有特异性。然而,在药物发现中,这些异构体通常被忽视,未能充分利用它们在疾病治疗中的潜力。随着对蛋白质异构体在疾病中作用认识的深入,研究人员开始探索以蛋白质异构体为中心的治疗方法,以期提高药物的靶向性和特异性,减少不良反应,并为那些因异常蛋白质异构体产生而导致的疾病提供更有效的治疗方案。

澳大利亚加文医学研究所Robert J. Weatheritt、Peter Kjer-Hansen联合悉尼大学Tri Giang Phan讨论了蛋白质异构体在药物发现中的重要作用,以及如何利用这些异构体来提高药物的特异性和治疗效果。相关内容以“Protein isoform-centric therapeutics: expanding targets and increasing specificity”为题发表在《Nature》系列综述期刊《Nature Reviews Drug Discovery》上。
【主要内容】
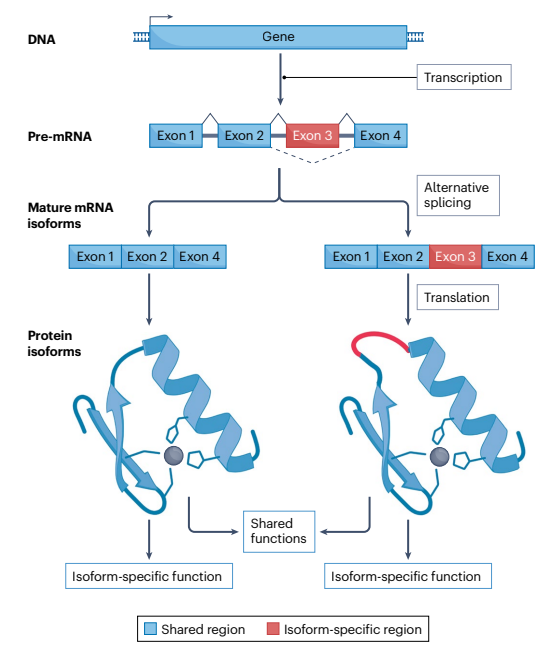
图1 基因可以通过选择性verna剪接产生多种蛋白亚型
基因通过选择性RNA剪接产生多种蛋白质异构体,这些异构体可能具有共享功能以及特定于某个异构体的独特功能。在这一过程中,前体mRNA从编码基因转录而来,通过选择性剪接调节哪些外显子包含在成熟的mRNA转录本中,从而产生多个mRNA和蛋白质异构体。这些异构体可能在特定的细胞类型或发育阶段中表达,这种空间或时间上的精确性可能在生物学上具有重要意义。
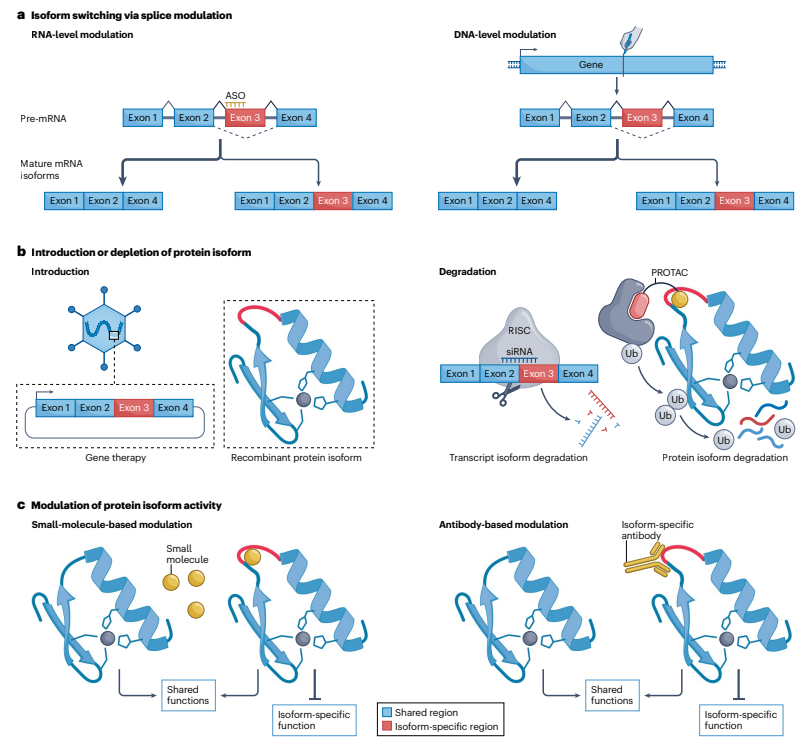
图2 功能依赖性蛋白异构体中心疗法的三种作用模式
文章概述了依赖于蛋白质异构体功能的三种治疗模式:
异构体转换(Isoform switching):
这种策略通过改变剪接模式来调整不同蛋白质异构体之间的比例,而不改变基因的总体表达水平。实现方式包括使用反义寡核苷酸(ASOs)或小分子药物在RNA水平上进行剪接调节,或者通过基因编辑技术在DNA水平上实现永久性的剪接模式改变。例如,针对某些遗传性疾病,可以通过ASOs设计来促进或抑制特定剪接位点的使用,从而减少或消除致病异构体的产生。
异构体引入或耗竭(Isoform introduction or depletion):
这种策略通过增加或减少特定蛋白质异构体的总量来改变细胞中异构体的比例。可以通过基因治疗、直接注射mRNA或重组蛋白来引入缺失或功能关键的蛋白质异构体。耗竭特定异构体可以通过使用siRNA、ASOs或PROTACs来实现,这些方法可以特异性地降低特定mRNA或蛋白质的水平。例如,在癌症治疗中,可以通过siRNA降低促进肿瘤生长的特定蛋白质异构体的表达。
异构体活性调节(Modulation of isoform activity):
这种策略旨在直接调节特定蛋白质异构体的活性,而不是改变其表达水平。可以通过小分子药物或异构体特异性抗体来实现,这些药物可以特异性地结合并调节异构体的功能。例如,在炎症性疾病中,可以通过小分子药物抑制特定炎症介质的活性,从而减轻炎症反应。
这三种模式提供了针对蛋白质异构体的多样化治疗策略,可以针对不同的疾病状态和治疗需求进行选择和优化。
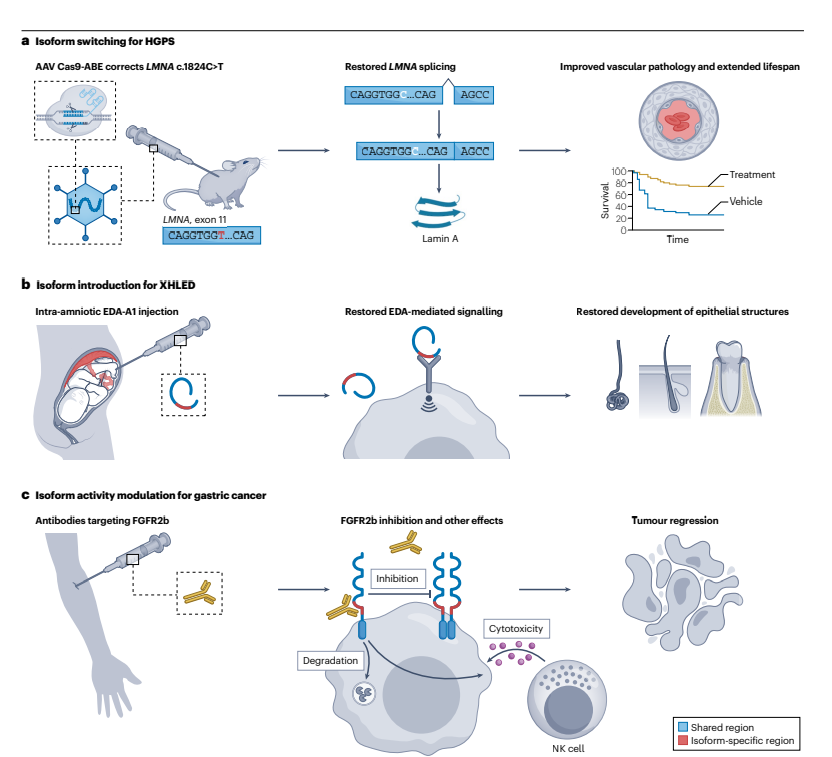
图3 功能依赖性蛋白异构体中心疗法的实例
通过三个具体的例子阐释了功能依赖型蛋白质异构体中心治疗方法的应用:
a) 在Hutchinson-Gilford早老症(HGPS)的治疗中,使用基于CRISPR-Cas9系统的碱基编辑器(Cas9-ABE)针对LMNA基因中的特定突变进行校正,从而恢复了正常的剪接模式,改善了血管病变并延长了小鼠模型的寿命;
b) 在X-连锁无汗性外胚层发育不良(XHLED)的治疗中,通过在胎儿发育期间向羊膜腔内注射EDA-A1蛋白异构体,恢复了EDA介导的信号传导,促进了上皮结构的正常发育;
c) 在胃癌治疗中,使用针对FGFR2b蛋白异构体的抗体,通过抑制其信号传导、促进受体下调以及引发抗体依赖性细胞毒性,导致肿瘤退缩。这些例子展示了通过精确靶向特定蛋白质异构体来实现治疗效果的潜力。
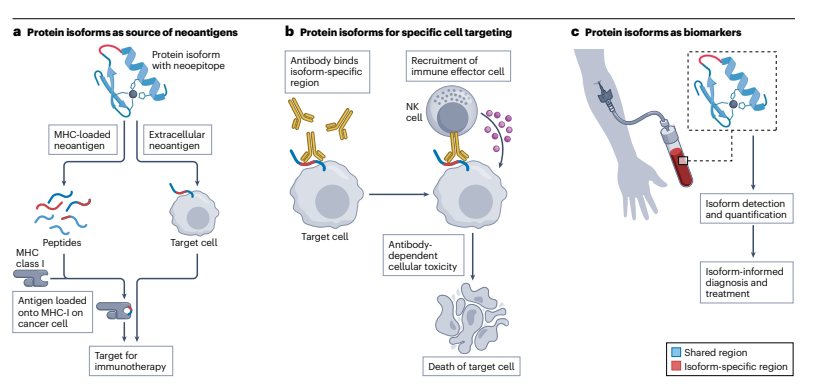
图4 与蛋白质异构体的功能性无关的临床用途
蛋白质异构体在临床应用中的三种功能不相关的用途:
a) 作为癌症免疫治疗的靶标,其中含有癌症新表位的蛋白质异构体可以产生新抗原,这些新抗原可以被免疫系统识别并用于激活针对癌症细胞的免疫反应;
b) 作为特定细胞群体的靶向标记,例如,通过抗体结合到肿瘤细胞特异性的蛋白质异构体区域,可以触发免疫效应细胞的招募,从而引发抗体依赖性细胞毒性;
c) 作为诊断生物标志物,蛋白质异构体可以在患者样本中被检测和定量,用于疾病诊断、治疗决策和预后评估。这些应用展示了蛋白质异构体在药物开发和临床治疗中的多样化潜力。
这三种应用方式展示了蛋白质异构体在现代医学中的多方面价值,它们不仅能够作为治疗的靶点,还能够在疾病的管理和治疗中发挥关键作用。
【全文总结】
这篇文章全面回顾了蛋白质异构体在药物发现中的潜力和应用,强调了针对特定蛋白质异构体的药物开发策略,包括异构体转换、引入或耗竭以及活性调节,旨在提高治疗的特异性和减少副作用。文章还探讨了蛋白质异构体作为细胞类型特异性药物传递和免疫治疗的靶标、癌症新抗原的来源以及诊断生物标志物的临床潜力。尽管这一领域仍处于早期阶段,但蛋白质异构体中心的治疗方法为开发更安全、更有效的药物提供了新的方向,并可能为那些缺乏有效治疗选项的疾病带来新的希望。
原文链接:
作者:BioMed科技
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#癌症免疫治疗# #蛋白质异构体# #异构体转换#
25