深度盘点:2020年FDA批准53款新药上市,肿瘤药占1/3
2020-12-27 MedSci整理 MedSci原创
2020年的上半年,美国FDA的药物评估与研究中心(CEDR)已经批准了
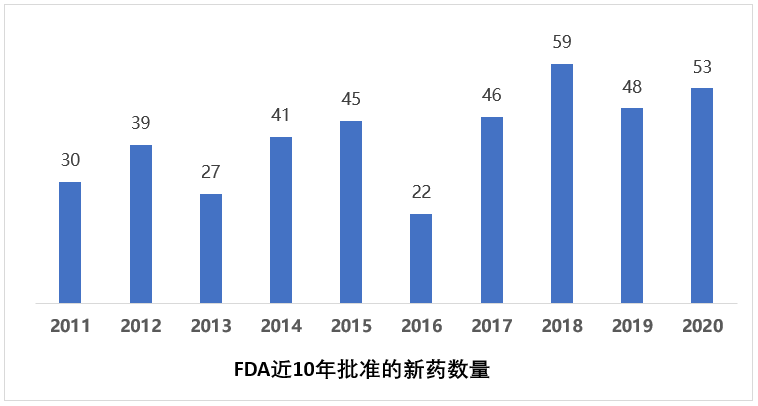
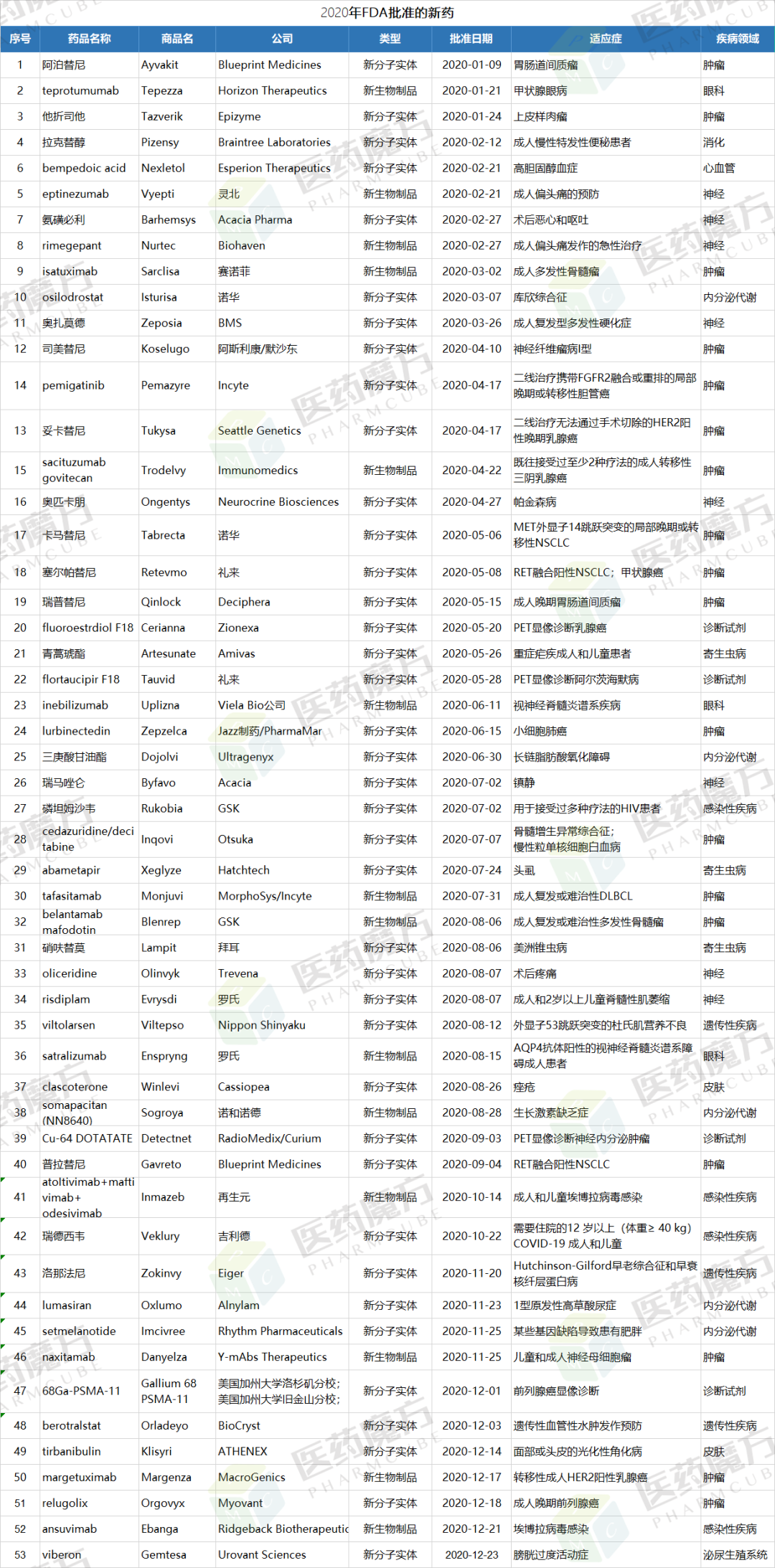
2020年,FDA共批准53款新药(截至2020/12/26),其中包括39个新分子实体和14个新生物制品。虽然疫情对各家公司的药物开发计划产生较大影响,也对各国政府监管机构的日常运行造成了冲击,但是FDA在2020年的药品审批速度丝毫没有放缓,批准的新药数量放在近10年仍是第2高的水平,仅次于2018年的59种。其中,2020年的上半年批准了25款创新药,下半年批准达28种。其中大部分梅斯医学都给予及时地报道。
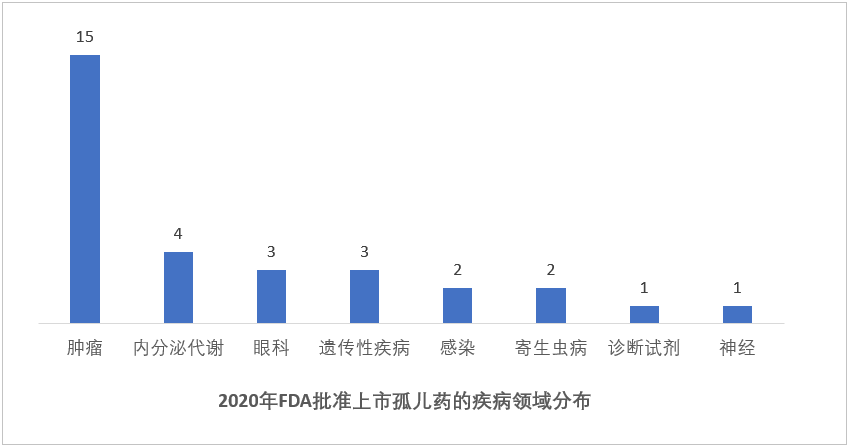
从疾病领域来看,2020年FDA批准的新药仍以肿瘤药居多,占比34%(18/53),其他占比较高的疾病领域还包括神经(15%,8/53)、内分泌代谢(9%,5/53)、诊断试剂(7%,4/53)、感染性疾病(7%,4/53)。
从药物剂型来看,2020年FDA批准的新药中注射剂最多,占比50%(26/53),其次是普通口服片剂和胶囊剂。
从审评方式上看,今年共有26个新药是以“优先审评”的方式获得FDA批准上市,其中包括23个新分子实体和3个新生物制品。有31个品种被FDA授予“孤儿药”资格,占所有获批新药的58%。
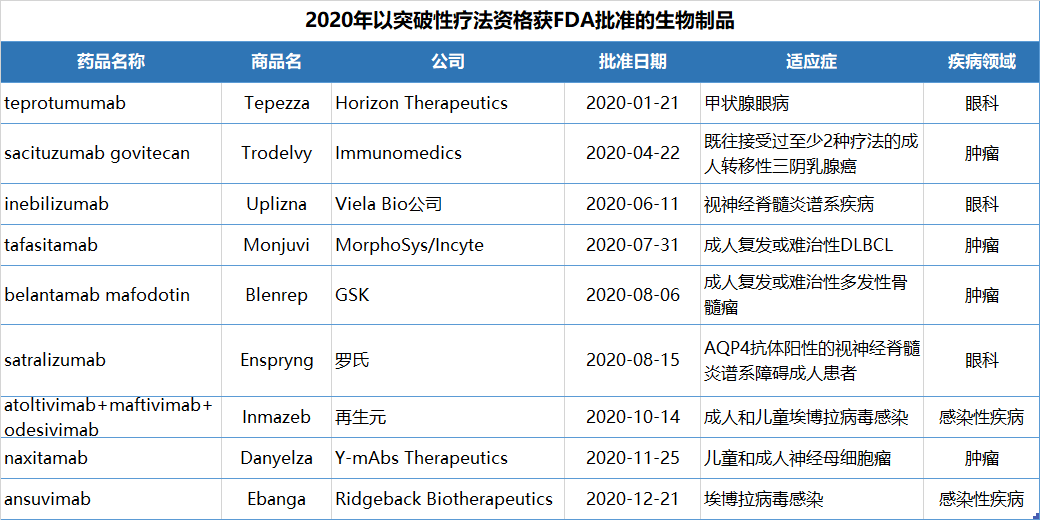
2020年FDA获批的新药中,有9款属于First-in-class药物。2020年获批的53个新药中,共有22个(42%)被FDA授予突破性疗法(BTD)资格,包括 9个生物制品,占今年获批生物制品的64%。另有13个获得BTD资格的是小分子药物,占到今年获批小分子药物的33%。
1、K药获批治疗复发/难治性cHL成人患者
商品名:Keytruda(K药)
公司:默沙东
批准时间:2020年10月
适应症:用于治疗接受过一线疗法的复发/难治性cHL成人患者以及难治性cHL,或经二线及二线以上治疗后复发的cHL儿童患者。
Keytruda是首个获批治疗接受过一线疗法的复发/难治性cHL成人患者的抗PD-1疗法。其中Keytruda作为PD-1抑制剂通过抑制T细胞表面表达的PD-1受体与其配体的结合,激活T细胞并增强其抗癌免疫反应。
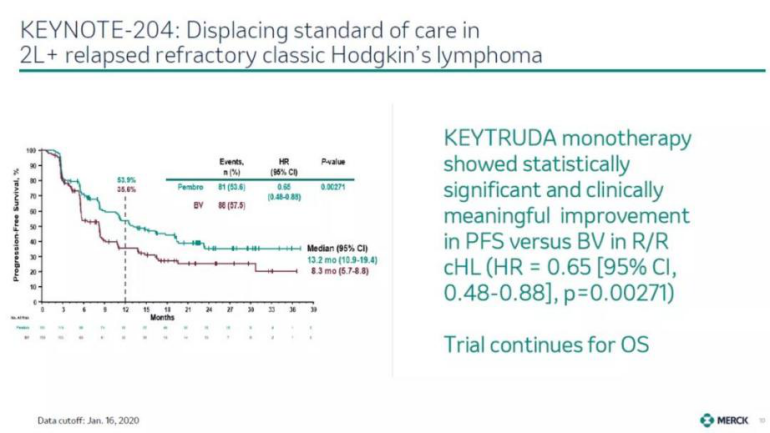
此次批准,是基于3期临床试验KEYNOTE-204的结果,在该试验中,与目前标准疗法相比,Keytruda使患者疾病进展或死亡风险显著降低了35%(HR=0.65,95% CI,0.48-0.88;p<0.0027)。此外,接受Keytruda治疗的患者的中位无进展生存期(PFS)为13.2个月(95% CI,10.9-19.4),接受标准疗法治疗的患者的PFS为8.3个月(95% CI,5.7-8.8)。
2. O药成为恶性胸膜间皮瘤唯一获批的免疫疗法
药品名:纳武利尤单抗
商品名:Opdivo(O药)
公司:百时美施贵宝
批准时间:2020年10月
适应症:欧狄沃联合伊匹木单抗用于既往未经治疗的、不可切除的恶性胸膜间皮瘤患者,成为首个且目前唯一获批的免疫疗法
欧狄沃是一种PD-1免疫检查点抑制剂,利用人体自身免疫系统来帮助机体恢复抗肿瘤免疫反应。也正是因为这种通过利用人体自身免疫系统来抗击癌症的特性,使欧狄沃已成为多种肿瘤类型的重要治疗选择。并且在11月23日中国国家药监局药品审评中心(CDE)网站最新公示,欧狄沃+伊匹木单抗联合疗法以“符合附条件批准的药品”拟纳入优先审评。
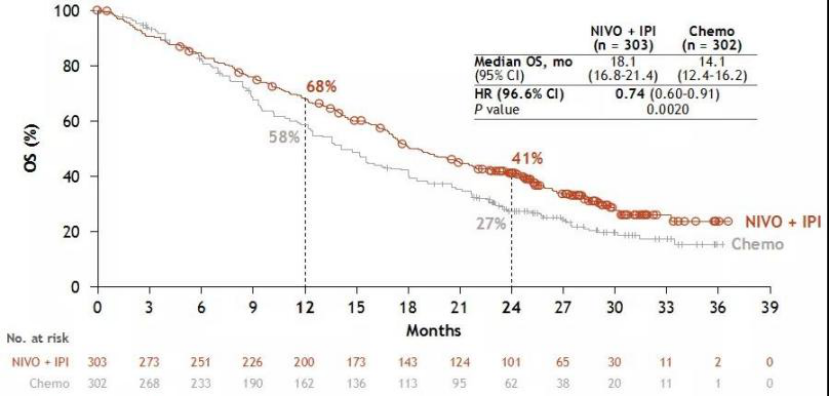
此次获批是基于III期临床研究CheckMate -743的预设期中分析的结果。研究显示,在随访至少22.1个月后,欧狄沃联合伊匹木单抗组(n=303)患者的总生存期(OS)优于含铂标准化疗组(n=302)(风险比[HR]:0.74 [95%置信区间: 0.61, 0.89];p=0.002),双免疫治疗组的中位总生存期(mOS)为18.1个月(95%置信区间:16.8, 21.5),化疗组为14.1个月(95%置信区间:12.5, 16.2)。双免疫治疗组患者2年生存率为41%,而化疗组仅为27%。
3.全球首个BCMA靶向疗法!BLENREP获批治疗R/R MM后线治疗
药品名:belantamab mafodotin
商品名:BLENREP
公司:葛兰素史克
批准时间:2020年8月
适应症:用于既往接受过至少4种疗法(包括抗CD38单克隆抗体,蛋白酶体抑制剂和免疫调节剂)的复发性或难治性多发性骨髓瘤的成年患者。在最后一次治疗中被证明疾病进展的复发或难治性多发性骨髓瘤(R/R MM)成人患者。详细:靶向BCMA的ADC药物belantamab mafodotin,获得FDA咨询小组支持治疗复发或难治的多发性骨髓瘤患者
Blenrep 是抗体-药物偶联物(ADC),抗体成分是针对BCMA的岩藻糖基化IgG1,BCMA是在正常B淋巴细胞和多发性骨髓瘤细胞上表达的蛋白质。小分子成分是微管抑制剂MMAF,通过与BCMA结合后,将belantamab mafodotin-blmf内在化,然后经过蛋白水解切割释放MMAF。释放的MMAF在细胞内破坏了微管网络,导致细胞周期停滞和凋亡。
根据总缓解率,该适应症获得加速批准。BLENREP是全球首个获批的抗BCMA (B细胞成熟抗原)疗法。
此次批准,基于DREAMM临床试验项目6个月的数据,包括关键性的DREAMM-2研究。该实验6个月的初步结果显示:Blenrep 2.5mg/kg Q3W单药治疗的ORR为31%(97.5%CI:21-43)、中位缓解持续时间(DoR)尚未达到,但在病情缓解的患者中,有73%的患者DoR≥6个月。最常见的不良反应(≥20%)是角膜病变、视力下降、恶心、视力模糊、发热、输液相关反应和疲劳。角膜病变的特征是角膜上皮的变化,如眼部检查所见,可表现为有或无症状。在汇总安全群体的218例患者中,77%发生眼部不良反应,包括角膜病变(76%)、视力变化(55%)、视力模糊(27%)和干眼症(19%)。角膜不良事件在每次给药前通过眼部检查进行监测,适当时允许剂量减少或中断。患者还使用了不含防腐剂的眼药水。在2.5mg/kg组中,导致停药的角膜病变影响了2.1%的患者。
该研究的13个月随访数据结果显示:Blenrep(2.5mg/kg,Q3W)单药治疗的ORR为31%(与6个月数据一致)、DoR为11个月(95%CI:4.2-未达到)、OS为14.9个月(95%CI:9.9-未达到)。在病情缓解的患者中,大多数(58%)病情取得了非常好的部分缓解或更好缓解(≥VGPR),包括2例严格的完全缓解(sCR)和5例完全缓解(CR)。获得临床受益的患者比例为36%(95%CI:26.6-46.5)。
4.口服抗癌药Inqovi获批治疗白血病
商品名:Inqovi
公司:Otsuka
批准时间:2020年7月
适应症:用于治疗骨髓增生异常综合征和慢性粒单核细胞白血病。
Inqovi是由化疗药物地西他滨和cedazuridine组成的一款口服复方制剂,而传统的治疗方法以输液为主,通过口服用药可避免长期输液带来的不便。详细:FDA批准血液癌口服药物——低甲基化制剂Inqovi
此次批准是基于 III 期ASCERTAIN临床试验的积极结果。这是一项随机、开放标签、交叉研究,在138例既往未接受治疗(初治)和已接受治疗(经治)的MDS和CMML患者中开展。
在试验中,对于中高风险MDS或CMML患者总计 5 天的给药,与静脉注射地西他滨相比,口服C-DEC显示出相同的地西他滨暴露剂量。
结果显示,研究到达了主要终点:在 5 天给药期内,与地西他滨静脉给药相比,口服C-DEC时,AUC全身暴露达到 98.9(90% CI,92.7-105.6)。在可评估的患者中,口服C-DEC的完全缓解率(CR)为12%,总体缓解率(OR)为64%。此外,大约一半以前依赖输血的患者在接受治疗8周内不再需要输血。Inqovi 的安全性特征也与静脉注射地西他滨相似。

5.Selpercatinib获批治疗RET突变NSCLC、甲状腺癌
药品名:Selpercatinib
商品名:Retevmo
公司:礼来
批准时间:2020年5月
适应症:用于治疗RET基因突变或重排的非小细胞肺癌、甲状腺髓样癌和其他类型甲状腺癌患者。
RET融合存在于大约2%的非小细胞肺癌、10-20%的乳头状甲状腺癌(PTC)和其他类型甲状腺癌、以及其他癌症(如结直肠癌)亚组中;RET点突变存在于大约60%的甲状腺髓样癌(MTC)中。Selpercatinib是一种强效、口服、高度选择性转染期间重排(RET)激酶抑制剂,通过阻断RET激酶,从而有助于阻止癌细胞生长。详细:FDA:礼来口服RET抑制剂selpercatinib在美国上市
该批准基于1/2 期LIBRETTO-001期试验的结果,该试验评估了selpercatinib在RET变异的NSCLC和甲状腺癌中的作用。详细:NEJM:Selpercatinib用于RET融合阳性非小细胞肺癌患者的治疗
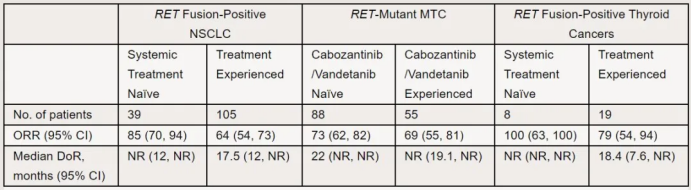
NSCLC组包括105例接受过含铂化疗的RET融合阳性NSCLC 成人患者。这些患者ORR为64%,DOR超过6个月的患者比例为81%。39名未接受过治疗的患者,ORR为84%,DOR超过6个月的患者比例为59%。
MTC人群包括≥12岁的晚期或转移性RET突变阳性成人和儿童患者。在预先接受过卡博替尼或凡德他尼治疗的55位患者中,ORR为69%,DOR超过6个月的患者比例为76%。在未接受治疗的患者中,ORR为73%,DOR超过6个月的患者比例为61%。
RET融合阳性甲状腺癌组包括≥12岁的成人和儿童患者。该队列包括19例放射性碘难治性(RAI)且接受过另一系统治疗的RET融合阳性甲状腺癌患者和8例RAI难治性且未接受任何其他治疗的RET融合阳性甲状腺癌患者。在预先接受过治疗的19位患者中,ORR为79%,DOR超过6个月的患者比例为87%。在仅接受过RAI的8例患者中,ORR为100%,DOR超过6个月的患者比例为75%。
6.Capmatinib获批治疗NSCLC met14
药品名:Capmatinib
商品名:Tabrecta
公司:诺华
批准时间:2020年5月
适应症:治疗携带MET外显子14跳跃突变的转移性非小细胞肺癌(NSCLC)患者,包括一线治疗(初治)患者和先前接受过治疗(经治)的患者。详细:FDA:批准MET抑制剂capmatinib上市用于MET突变NSCLC的治疗
MET基因突变发生于3%-4%的非小细胞癌(NSCLC)患者中,这些患者一般年龄较大,且预后较差。Capmatinib(卡马替尼)作为一种可口服且高选择性的小分子MET抑制剂,可靶向治疗因MET外显子14跳跃突变引起的肺癌。
FDA的批准是基于名为GEOMETRY mono-1的2期临床试验。此外,FDA还批准FoundationOne CDx(F1CDx)作为Capmatinib的伴随诊断产品,用于检测肿瘤组织中的MET外显子14跳跃突变。
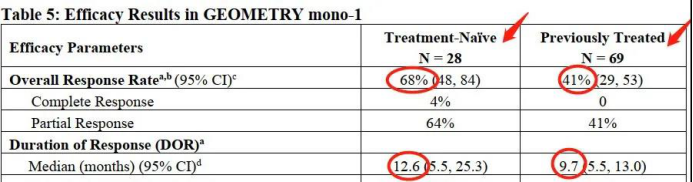
该研究在94例携带MET外显子14跳跃突变的晚期或转移性NSCLC成人患者中开展。在初治和经治患者中,经双盲独立审查委员会(BIRC)评估Capmatinib治疗的总缓解率分别为68%和41%,中位反应持续时间分别为12.6个月和9.7个月。结果显示,无论患者既往是否接受过治疗(一线和后线),Capmatinib均能带来显著治疗效果。
7.Ripretinib获批治疗晚期胃肠道间质瘤
药品名:Ripretinib
商品名:Qinlock
公司:Deciphera Pharmaceuticals
批准时间:2020年5月
适应症:晚期胃肠道间质瘤(GIST)患者。
Qinlock为蛋白激酶抑制剂,可口服使用,用于治疗已经接受过3种以上蛋白激酶抑制剂疗法,其中包括伊马替尼(imatinib)的成人GIST患者。Qinlock可阻断胃肠道间质瘤中涉及的第9、11、13、14、17、18外显子中的起始和继发KIT突变以及SM中发现的原发性KIT第17号外显子D816V突变。同时还可抑制第12、14、18外显子中的原发性PDGFRα突变,包括涉及第18外显子D842V突变的胃肠道间质瘤。详细:四线疗法Ripretinib获FDA批准
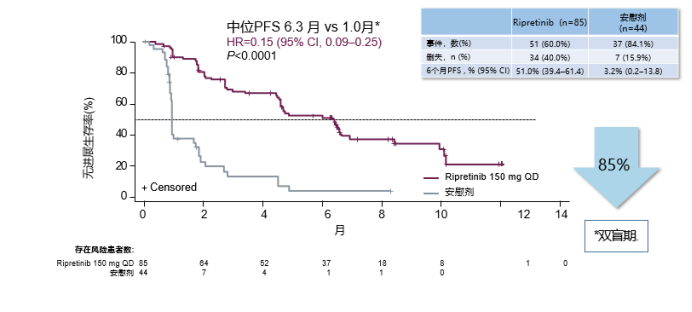
批准是基于3期INVICTUS试验的结果,在该试验中,Qinlock的中位PFS为6.3个月,而安慰剂为1个月。与目标人群的安慰剂相比,Qinlock可使疾病进展或死亡的风险降低了85%。
8.pemigatinib获批FGFR2融合或重排的局部晚期或转移性胆管癌患者
药品名:pemigatinib
商品名:Pemazyre
公司:Incyte
批准时间:2020年4月
适应症:用于治疗既往接受过治疗的携带FGFR2融合或重排的局部晚期或转移性胆管癌患者,该疗法获得FDA的提前获批。
Pemazyre 是一种选择性的成纤维细胞生长因子受体(FGFR)抑制剂,对FGFR1、FGFR2、FGFR3均有抑制作用。而FGFRs基因的融合、重排、易位和扩增与多种癌症的发生和进展密切相关。详细:FDA批准胆管癌FGFR靶向药pemigatinib获批
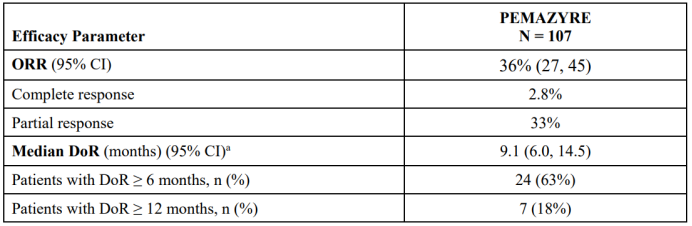
批准基于FIGHT-202的结果,这一项开放标签、单臂、国际多中心2期临床研究,研究分为3个队列:队列A(n=107)为FGFR2融合或重排患者,队列B(n=20)为其他FGF/FGFR基因改变患者,队列C(n=18)为不存在FGF/FGFR基因改变患者。结果揭示携带FGFR2基因融合的胆管癌患者(A组),在二线治疗时接受Pemazyre后的ORR可达36%,达到了主要终点,其中2.8%的患者完全缓解,33%的患者部分缓解。DOR为9.1个月,DCR为88.2%,mPFS为6.9个月,mOS为21.1个月。
9.图卡替尼获批HER2+乳腺癌
药品名:图卡替尼 tucatinib
商品名:Tukysa
公司:Seattle Genetics
批准时间:2020年4月
适应症:联合化疗(曲妥珠单抗和卡培他滨)用于治疗无法通过手术切除并且之前已经接受过一种以上疗法的HER2阳性晚期乳腺癌患者。
妥卡替尼结构式
该疗法可有效延长患者无进展生存期以及脑转移患者的OS和PFS。详细:FDA批准Seattle Genetics的口服酪氨酸激酶抑制剂Tukysa,治疗HER2阳性转移性乳腺癌
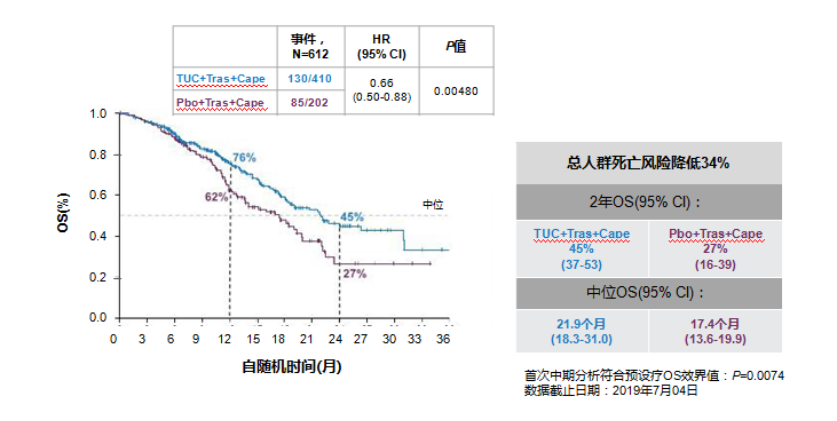
该批准基于关键性试验HER2CLIMB(双盲安慰剂对照试验)的结果,该试验招募了612例先前曾分别接受过曲妥珠单抗、帕妥珠单抗等疗法治疗后复发的患者。在试验开始时有48%的患者有脑转移。
结果显示,接受安慰剂联合曲妥珠单抗和卡培他滨治疗的患者,其中位无进展生存期为5.6个月;而接受Tukysa联合曲妥珠单抗和卡培他滨的患者,中位无进展生存期为7.8个月。详细:NEJM:Tucatinib、曲妥珠单抗联合卡培他滨治疗转移性HER2阳性乳腺癌,NEJM:妥卡替尼治疗HER-2转移性乳腺癌
在入组时已发生脑转的患者中,接受安慰剂联合疗法的中位无进展生存期为5.4个月,而接受Tukysa联合治疗的患者中位无进展生存期为7.6个月。

在中位总生存期方面,安慰剂组患者为17.4个月,Tukysa组为21.9个月。
Tucatinib由Seattle Genetics开发,于4月17日获FDA批准上市,是FDA在“ORBIS计划”下批准的首个新分子实体药物。曾获得FDA授予的突破性疗法认定,孤儿药、优先审评和快速通道资格。Tucatinib目前尚无在国内申报记录。
10.Selumetinib上市,FDA批准的首个1型神经纤维瘤病药物
药品名:selumetinib 司美替尼
商品名:Koselugo
公司:阿斯利康、默沙东
批准时间:2020年4月
适应症:用于2岁及以上儿童和青少年的神经纤维瘤病I型(NF1)患者,此外这些患者伴有症状性和/或进展性、无法手术的丛状神经纤维瘤(PN)。详细:FDA批准Koselugo作为美国首款治疗儿童1型神经纤维瘤的药物
Koselugo是一款MEK 1/2抑制剂,其中MEK是RAS/MAPK信号通路中的关键蛋白激酶,而NF1的发病正是由于NF1基因突变扰乱了RAS/MAPK信号通路所导致的肿瘤生长。这种肿瘤往往不能完全手术切除,复发风险高。
此批准基于SPRINT试验(NCT01362803),研究的入组人群为NF1儿童患者,有一个可测量的靶病灶PN,不能手术切除但无严重病痛。研究结果显示,总体人群的ORR为66%,所有患者均达到部分缓解,且有82%的受试者持续缓解至少12个月。
11.IMMU132获批治疗三阴乳癌
药品名:sacituzumab govitecan-hziy,IMMU-132
商品名:Trodelvy
公司:Immunomedics
批准时间:2020年4月
适应症:用于治疗既往接受过至少2种疗法的转移性三阴乳腺癌成人患者。
Trodelvy除了是FDA批准的首个治疗三阴乳腺癌的抗体偶联药物,也是首个获批的靶向人滋养层细胞表面抗原2(Trop-2)的抗体偶联药物。Trodelvy可提高客观应答率(ORR)和应答持续时间(DoR),但存在严重中性粒细胞减少和腹泻的风险。详细:FDA批准靶向Trop-2的ADC药物Trodelvy,治疗三阴性乳腺癌
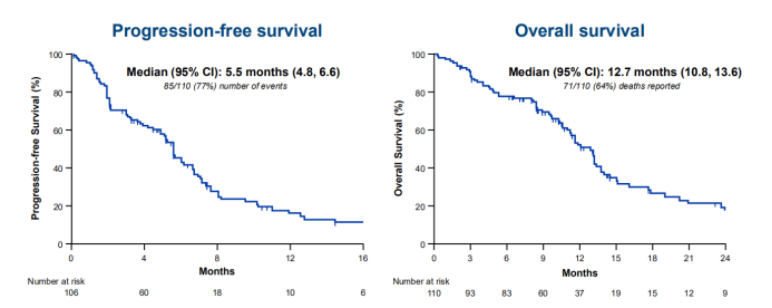
在支持该药加速批准的单臂多中心II期研究IMMU-132-01 (NCT01631552)中,Trodelvy治疗mTNBC的ORR为33.3%、DOR为7.7个月。
今年7月,Trodelvy治疗mTNBC的验证性III期ASCENT研究(NCT02574455)达到主要终点和关键次要终点。数据显示,在先前接受过治疗的晚期mTNBC患者中,与化疗相比,
Trodelvy:
(1)延长中位PFS3.9个月,将疾病进展风险显著降低59%(HR=0.41,95%CI:0.32-0.52,p<0.0001));
(2)延长中位OS5.4个月,将死亡风险降低了52%(HR=0.48,p<0.0001);
(3)提高ORR30%和CBR36%。
这些数据证实了先前II期临床中的结果,表明Trodelvy有潜力改变mTNBC的标准护理,并将为mTNBC患者的科学和临床创新树立一个新的基准,同时为临床实践常用药提供了一个新的替代品。
12.批准了其用于Hutchinson-Gilford早衰综合症和加工缺陷型Progeroid Laminopathies(早熟型椎病)的药物
药品名:lonafarnib
商品名:Zokinvy
公司:Eiger BioPharmaceuticals
批准时间:2020年11月
适应症:12个月及以上的Hutchinson-Gilford早衰综合症和加工缺陷型Progeroid Laminopathies(早熟型椎病)患者。
2020年11月23日,Eiger BioPharmaceuticals宣布美国食品药品监督管理局(FDA)批准了其用于Hutchinson-Gilford早衰综合症和加工缺陷型Progeroid Laminopathies(早熟型椎病)的药物。两种遗传疾病是分开的和截然不同的,但是都导致过早的快速衰老,从而大大降低了受影响儿童的寿命。详细:FDA接受了全球首个早衰症治疗药物Zokinvy的新药申请
Zokinvy是一种口服法尼基转移酶抑制剂,参与蛋白异戊二烯化修饰过程。通过抑制对早衰蛋白的异戊二烯化,它可以降低早衰蛋白在细胞核中的积累。除了用于治疗早衰症和早衰样核纤层蛋白病之外,Zokinvy 也是唯一一个正在开发中的丁型肝炎(HDV)口服药物。
Zokinvy是Eiger最近批准的针对这些破坏性疾病的治疗方法,适用于12个月及以上的患者。口服药物通过防止缺陷的早老蛋白或早老蛋白样蛋白的积累而起作用。在两项开放标签的临床试验中,将62名接受治疗的儿童与另一项自然史研究中未治疗的配对患者进行了比较。Zokinvy被证明可以通过最长的11年随访时间,将早衰症患者的寿命平均延长2.5年。许多患者使用该药物已超过10年。
13.每日1次口服前列腺癌新药
药品名:relugolix
商品名:relugolix(Orgovyx)
公司:Myovant
批准时间:2020年12月
适应症:晚期前列腺癌。
Relugolix是一种每日仅需口服1次的片剂,患者可在家接受治疗,为美国晚期前列腺癌患者提供了一种新的治疗选择。特别是在当前新冠肺炎大流行的情况下,relugolix的获批对于希望避免亲自接受注射剂治疗的患者尤其具有吸引力。详细:FDA批准口服GnRH受体拮抗剂Orgovyx治疗晚期前列腺癌
代号为HERO的III期研究共入组了934例晚期前列腺癌男性受试者,按照 2:1 的比例随机入组,分别接受relugolix或注射用醋酸亮丙瑞林微球治疗(前列腺癌患者标准疗法)。结果显示,在第5-48周,relugolix组睾丸激素被持续抑制至去势水平(≤50ng/dL)的患者比例为96.7%,而亮丙瑞林组这一比例为88.8%。达到非劣效性标准。详细:NEJM:口服Relugolix治疗晚期前列腺癌
研究的次要终点显示,relugolix在快速抑制睾丸激素(开始给药后4 - 15天)、第15天抑制前列腺特异性抗原PSA、降低卵泡刺激素(FSH)水平方面疗效优于亮丙瑞林。
Relugolix是首个获得FDA批准用于治疗晚期前列腺癌的口服促性腺激素释放激素(GnRH)受体拮抗剂。其可通过阻断GnRH受体,阻止脑垂体分泌促黄体生成素和促卵泡激素,从而降低睾丸分泌的睾丸激素水平。而睾丸激素分泌过多是导致前列腺肿瘤生长的重要危险因素。
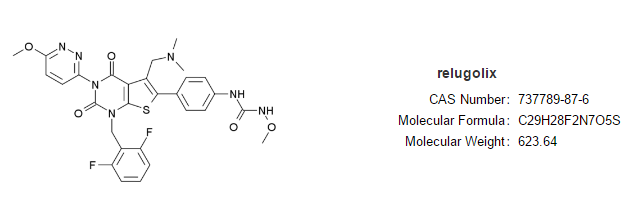
Relugolix结构式
14.12岁以上的痤疮患者
药物名称:Clascoterone
商品名:Winlevi
公司:Cassiopea
批准时间:2020年8月
适应症:1% 浓度Clascoterone乳膏可用于治疗12岁以上的痤疮患者。
1%浓度clascoterone乳膏剂通过局部用药,作用于用药部位的雄激素受体(androgen receptor),达到抑制二氢睾酮(DHT)的局部作用,而二氢睾酮是痤疮病变发生的关键驱动因素之一。与痤疮的口服抗雄激素疗法不同,Clascoterone同时适用于男性和女性。这是近40年来针对痤疮治疗的首个新机制药物。
clascoterone是一种first-in-class的局部雄激素受体抑制剂,通过抑制皮脂产生和炎症来发挥作用。关键性临床试验表明,clascoterone每天2次可减少痤疮产生,并且耐受性良好,常见的不良反应是轻微红斑。
15.FDA批准的首个预防偏头痛的静脉注射药物
产品名称:Vyepti
公司:灵北制药
批准时间:2020年2月
适应症:用于成人偏头痛的预防治疗,是FDA批准的首个预防偏头痛的静脉注射药物。
降钙素基因相关肽(CGRP)是最强力的血管扩张剂,广泛表达于三叉神经节细胞,近年来发现它在偏头痛的发病中起重要作用,可作为治疗偏头痛的新靶点。Vyepti是一种预防偏头痛的单克隆抗体(mAb),能够强效且高特异性抑制降钙素基因相关肽(CGRP)。详细:Lundbeck的CGRP单抗Vyepti用于预防偏头痛,获得美国批准
16.扎伊尔型埃博拉病毒(Zaire ebolavirus)引起的感染
产品名称:Inmazeb
公司:再生元
批准时间:2020年10月
适应症:用于治疗由扎伊尔型埃博拉病毒(Zaire ebolavirus)引起的感染,该药可用于成人和儿童感染者,包括感染检测呈阳性母亲的新生儿。详细:Regeneron的Inmazeb成为首个获得FDA批准的埃博拉病毒治疗药物
Inmazeb是FDA批准的首个用于治疗埃博拉病毒感染的药物,Inmazeb由3种全人IgG1单抗组成,通过再生元专有的VelociSuite®快速反应技术进行开发,目前该技术正被应用于开发针对新型冠状病毒肺炎(COVID-19)的新型抗体鸡尾酒疗法。
17. 12 岁以上(体重≥ 40 kg)需要住院的 COVID-19 成人和儿科患者
产品名称:瑞德西韦 Veklury
公司:Gilead
批准时间:2020年10月
适应症:用于治疗12 岁以上(体重≥ 40 kg)需要住院的 COVID-19 成人和儿科患者。
Veklury是一种抗病毒药物,其作用机制不是直接杀死病毒,而是抑制病毒的发展和复制。FDA 批准Veklury 主要基于3项随机对照临床试验的数据,包括轻度至重度 COVID-19 住院患者中的数据。详细:FDA正式批准首个新冠药物瑞德西韦
18. 儿童的慢性体重管理
产品名称:Imcivree
公司:Rhythm Pharmaceuticals
批准时间:2020年12月
适应症:用于因阿黑皮素原(POMC)、前蛋白转化酶枯草溶菌素1(PCSK1)或瘦素受体(LEPR)基因缺陷导致肥胖的成人和6岁以上儿童的慢性体重管理。详细:FDA批准遗传性肥胖药物Imcivree
Imcivree(Setmelanotide)是一款首创、寡肽类MC4受体激动剂,旨在恢复由于MC4受体上游遗传缺陷而引起的受损的MC4受体通路活性,重新建立罕见肥胖遗传性疾病患者的能量消耗和食欲控制,减少饥饿感、降低体重。在此之前,尚无FDA批准的特定疗法来控制因POMC,PCSK1或LEPR基因缺陷引起的肥胖症患者的体重。
19. 长链脂肪酸氧化障碍(LC-FAOD)儿科和成人患者
产品名称:Dojolvi
公司:Ultragenyx
批准时间:2020年6月
适应症:治疗通过分子诊断确诊的长链脂肪酸氧化障碍(LC-FAOD)儿科和成人患者。
LC-FAOD是由于患者不能将长链脂肪酸转化为能量,进而导致体内葡萄糖的严重耗尽和产生并发症。Dojolvi是一种高纯度、药用级的奇数碳、中链甘油三酯,旨在为LC-FAOD患者提供中链和奇数碳脂肪酸作为能源和代谢物替代品。详细:首款脂代谢紊乱药物Triheptanoin被FDA批准上市
20. 无法完全切除的转移性/局部晚期上皮样肉瘤成人患者
化学名:Tazemetostat
产品名称:Tazverik
公司:Epizyme
批准时间:2020年1月
适应症:用于治疗无法完全切除的转移性/局部晚期上皮样肉瘤成人患者以及16岁以上的儿科患者。
上皮样肉瘤是一种罕见的软组织肉瘤,好发于20-40岁,且男性较为多见。目前针对该疾病主要的治疗方案为手术切除、化疗或放疗。Tazverik是FDA批准的首个EZH2抑制剂,也是FDA批准的首个上皮样肉瘤治疗药物。详细:TAZVERIK(Tazemetostat)已获批准用于治疗上皮样肉瘤
21.预防成人和12岁以上儿科患者的遗传性血管水肿(HAE)发作
化学名:berotralstat
产品名称:Orladeyo
公司:BioCryst Pharmaceuticals
批准时间:2020年12月
适应症:用于预防成人和12岁以上儿科患者的遗传性血管水肿(HAE)发作。
Orladeyo的活性药物成分为berotralstat,是一种每日口服一次的新型、强效且高选择性人血浆激肽释放酶抑制剂,通过研究发现该药物可显著减少HAE发作次数,缓解患者生命。详细:EAACI 2020:长期临床数据证实Berotralstat可稳定持久地减少遗传性血管性水肿患者的发作
22. 首个每日一次口服的非他汀类降LDL-C药物
产品名称:Nexletol
公司:Esperion
批准时间:2020年2月
适应症:用于治疗成人杂合子型家族性高胆固醇血症(HeFH)患者,或者用于需要进一步降低LDL-C的动脉粥样硬化性心血管疾病(ASCVD)患者。详细:Esperion的ATP柠檬酸裂解酶抑制剂Nexletol,获FDA批准治疗心血管疾病
据悉,Nexletol是自2002年以来批准的首个每日一次口服的非他汀类降LDL-C药物。其中Nexletol是一种人工合成的二羧酸衍生物,属于first in class的ATP-柠檬酸裂解酶(ACL)抑制剂,通过抑制肝脏内胆固醇的生物合成和上调低密度脂蛋白受体(LDL-R)来降低LDL-C。
23.对患有任何实体恶性肿瘤的晚期癌症患者的肿瘤突变进行图谱分析
产品名称:Guardant360 CDx
公司:Guardant Health
批准时间:2020年8月
适应症:Guardant360 CDx可用于对患有任何实体恶性肿瘤的晚期癌症患者的肿瘤突变进行图谱分析。同时作为辅助诊断,可识别表皮生长因子受体(EGFR)基因突变的转移性非小细胞肺癌(NSCLC)。
Guardant360 CDx检测主要采用两种技术。一、液体活检,即利用血液样本为专业医护人员提供有关患者肿瘤的遗传信息。与标准组织活检相比,它具有侵入性小、易于重复,且适用于无法进行标准组织活检的肿瘤患者。二、NGS,Guardant360 CDx使用基因测序技术进行高通量肿瘤分析,可同时检测55个肿瘤基因的突变。
24. 治疗库欣综合征
化学名:osilodrostat
产品名称:Isturisa
公司:诺华
批准时间:2020年3月
适应症:用于治疗库欣综合征。
库欣综合征,又称皮质醇增多症,是一种由于多种原因引起的肾上腺皮质长期分泌过多糖皮质激素所产生的临床症候群。Isturisa是一种可口服的皮质醇合成抑制剂,通过抑制11-β羟化酶的产生而起到治疗作用,而11-β羟化酶是负责肾上腺皮质醇合成最终步骤的酶。Isturisa可使库欣综合征患者皮质水平达到正常化,并改善其他临床特征。详细:库欣病新疗法:Isturisa(osilodrostat)获得美国FDA批准
25. 治疗和预防患者术后恶心和呕吐症状(PONV)
化学名称:氨磺必利
产品名称:Barhemsys
公司:Acacia Pharma
批准时间:2020年2月
适应症:可单独使用或联合其它疗法,治疗和预防患者术后恶心和呕吐症状(PONV)。
PONV是外科手术的常见并发症,大约30%的手术患者和80%的高危患者都会发生这一症状。Barhemsys是一种选择性多巴胺D2和D3受体拮抗剂,用于预防PONV时的麻醉诱导,此外外科手术后出现PONV时,通过静脉注射Barhemsys达到缓解的作用。详细:Acacia Pharma针对术后恶心和呕吐的Barhemsy(静脉氨磺必利),喜获FDA批准上市
26.GLP-1受体激动剂
产品名称:Trulicity
公司:礼来
批准时间:2020年2月
适应症:用于患有心血管(CV)疾病或存在多种心血管风险因素的2型糖尿病成人患者,降低主要不良心血管事件(MACE)发生风险。
Trulicity是一种胰高血糖素样肽-1(GLP-1)受体激动剂(RA),每周皮下注射一次,用于2型糖尿病成人患者改善血糖控制。GLP-1 RA是糖尿病药物中备受瞩目的一类药物,是一类新型的胰岛素促分泌制剂,其作用机制与天然激素GLP-1类似,可促进患者进食时机体自身胰岛素的分泌达到降糖作用,此外其具有降糖效果强、低血糖风险较低、同时具有减肥效果和使心血管获益的优势。详细:礼来的GLP-1受体激动剂Trulicity,获得FDA批准用于降低心血管风险
27. 治疗甲状腺眼病
产品名称:Tepezza
公司:Horizon Therapeutics
批准时间:2020年1月
适应症:用于治疗甲状腺眼病。
其中TED是一种常发生于甲亢患者身上的自身免疫性疾病,临床通常表现为眼球突出、复视、视力模糊和面部畸形等,主要由于患者自身抗体激活了眼框内胰岛素样生长因子1受体(IGF-1R)所导致。Tepezza是一种靶向IGF-1R的单克隆抗体,通过与IGF-1R结合并阻断其激活和信号转导,减少炎症并阻止细胞的过度生长。
28.rimegepant
商品名:Nurtec ODT
公司:Biohaven
批准时间:2020年2月
2月27日,FDA批准Biohaven公司的Nurtec(rimegepant)口腔崩解片上市,用于成人急性偏头痛的治疗。
Rimegepant是一种口腔崩解片(ODT),可在无水(或仅有少量水存在)的条件下于口腔中快速崩解,随吞咽动作进入消化道,在口腔内无粘膜吸收。与普通制剂相比,ODT有服用方便、吸收快、生物利用度高、对消化道黏膜刺激性小等优点,受到广泛关注。
FDA对rimegepant的批准基于一项关键的III期临床试验(Study 303)和一项长期开放标签安全性研究(Study 201)的结果。详细:Lancet:Rimegepant崩解片治疗偏头痛
在Study 303研究中,与安慰剂相比,在服用rimegepant后2小时,达到无疼痛和大多数烦人症状(MBS)的共同主要终点方面具有一致的统计学显著差异,rimegepant在缓解疼痛(将中度或重度疼痛减轻为无痛或轻度疼痛)和在1小时内恢复正常功能方面也显示出统计上的优势。对于大多数患者而言,疼痛自由、疼痛缓解、恢复正常功能以及摆脱MBS的益处持续了48小时。重要的是,只需1剂rimegepant就可以看到这些获益。服用rimegepant的患者中有86%在给药后24小时内不需要急救药物(例如NSAIDS,对乙酰氨基酚)。
Study 201研究评估了长期多次服用rimegepant的安全性和耐受性。该研究评估了1798例偏头痛发作的患者,这些患者根据需要服用75mg的rimegepant,每天最多服用1剂。该研究包括1131例暴露于rimegepant至少6个月和863例暴露于至少1年的患者,所有这些患者平均每月至少发生2次偏头痛发作,但该研究尚未确定rimegepant在30天内出现15次偏头痛发作患者身上的安全性。
在临床研究中,少于1%的受试者发生呼吸困难和严重皮疹的超敏反应,包括给药后延迟的严重超敏反应。
29. isatuximab
商品名:Sarclisa
公司:赛诺菲
3月2日,FDA批准赛诺菲的CD38单抗药物Sarclisa (isatuximab-irfc)上市,用于联合泊马度胺和地塞米松治疗既往至少接受过2线以上疗法(包括来那度胺和一种蛋白酶体抑制剂)的复发性难治性多发性骨髓瘤(MM)成人患者。详细:FDA接受了赛诺菲的申请,要求批准isatuximab用于复发难治多发性骨髓瘤患者
isatuximab通过靶向多发性骨髓瘤细胞上CD38受体的特定表位促进肿瘤细胞程序性死亡,是继强生Darzalex(达雷妥尤单抗)之后全球第2款获FDA批准的CD38抗体药物。2019年,Darzalex销售额达到29.98亿美元。
此次批准是基于ICARIA-MM临床试验,结果显示,Sarclisa联合泊马度胺+地塞米松治疗组较泊马度胺+地塞米松治疗组患者的疾病进展和死亡风险降低了40%(HR 0.596),二者的中位无进展生存期(PFS)分别为11.53 和 6.47个月;同时,Sarclisa联合泊马度胺+地塞米松治疗组较泊马度胺+地塞米松治疗组患者的总体缓解率显著提高(60.4%vs. 35.3%)。
安全性方面,Sarclisa联合治疗组最常见的不良反应为中性粒细胞减少症(96%)、输液相关反应(39%)、肺炎(31%)、上呼吸道感染(57%)和腹泻(26%);超过5%的患者发生严重不良反应,包括肺炎(25.3%)和发热性中性粒细胞减少(12.3%);7%的患者因不良反应(3-4级)而停用Sarclisa联合治疗,3%的患者因输液相关反应而停止治疗。
30. ozanimod
商品名:Zeposia
公司:BMS
3月26日,FDA批准BMS的Zeposia (ozanimod) 上市,用于治疗成人复发型多发性硬化症(RMS),包括临床孤立综合征、复发缓解型多发性硬化症(RRMS)、以及活动性继发进展型多发性硬化症(SPMS)。详细:百时美施贵宝的1-磷酸鞘氨醇受体调节剂ozanimod,获FDA批准治疗复发型多发性硬化症
MS是一种人体免疫系统异常攻击大脑、脊髓、视神经的神经细胞髓鞘而引起的慢性疾病,表现为肌肉虚弱、疲劳、视物困难,最终导致残疾。全球大约有230万例MS患者,其中85%在初次确诊时属于复发缓解型MS(RRMS),15%属于原发进展型MS(PPMS)。RRMS患者表现为周期性的疾病复发与缓解,随着疾病的进展,最终会恶化成继发性进展型多发性硬化症(SPMS)。PPMS患者则表现为症状持续恶化,没有明显的缓解期。MS目前尚无法完全治愈。
Ozanimod是鞘氨醇1-磷酸受体(S1PR)调节剂,对淋巴细胞表面的S1PR1和S1PR5均有较高的亲和力。当Ozanimod与受体的结合发生后,可以阻止淋巴细胞离开淋巴结进入中枢神经系统,起到抗炎作用。此外,siponimod也能进入中枢神经系统,直接与少突胶质细胞和星形胶质细胞上的S1PR结合,促进髓鞘再生和防止炎症。
31. opicapone
商品名:Ongentys
公司:Neurocrine Biosciences
4月24日,FDA批准Neurocrine Biosciences公司的Ongentys(opicapone)上市,作为左旋多巴/卡比多巴的辅助疗法,用于治疗处于关闭期的帕金森患者。详细:美国FDA批准帕金森病新药上市,显著缩短“关闭期”时间
帕金森是仅次于阿尔茨海默氏病的美国第二大最常见的神经退行性疾病。据估计,美国帕金森患者大约有100万例,每年新增确诊患者大约为5万例。
opicapone是一种口服选择性COMT抑制剂,能通过抑制分解左旋多巴的COMT酶,进而减少其在血液中的分解,使得更多药物到达患者大脑,最终起到延长疗效和实现患者运动功能的作用。
32. fluoroestrdiol F18
商品名:Cerianna
公司:Zionexa
5月20日,FDA批准Zionexa公司的Cerianna(fluoroestrdiol F18)上市,Cerianna是一种放射学诊断试剂,适用于使用正电子发射断层扫描(PET)成像,作为活检的辅助手段,检测复发/转移性乳腺癌患者的雌激素受体(ER)阳性病变。
33. artesunate
商品名:Artesunate
公司:Amivas
5月26日,FDA批准Amivas公司的Artesunate(artesunate,青蒿琥酯静脉注射剂)上市,用于治疗重症疟疾成人和儿童患者。
青蒿琥酯静脉注射剂的疗效和安全性在1项亚洲开展的随机对照试验(试验1)和1项非洲开展的支持性随机对照试验中(试验1)得到证实。
试验1共入组1461例患者(包括202例年龄不到15岁的儿童患者),试验2共入组5425例年龄小于15岁的重症疟疾患者。这两项研究中,入组患者分别接受青蒿琥酯和对照药物奎宁的治疗。结果显示,青蒿琥酯治疗组患者死亡率显著低于奎宁治疗组。
安全性方面,试验1中患者常见的不良反应为急性肾功能衰竭(需要透析)、血红蛋白尿和黄疸。试验2的安全性与试验1基本相似。
34.flortaucipir F18
商品名:Tauvid
公司:礼来
5月28日,FDA批准礼来的Tauvid(flortaucipirF18)上市,Tauvid是一种放射学诊断试剂,适用于使用正电子发射断层扫描(PET)成像,评估阿尔茨海默病患者大脑中聚集的tau神经纤维缠结(NFTs)的密度和分布。
35.inebilizumab
商品名:Uplizna
公司:Viela Bio公司
6月11日,FDA批准Viela Bio公司的CD19单抗Uplizna(inebilizumab)上市,用于治疗AQP4阳性的成人视神经脊髓炎谱系疾病(NMOSD)患者。豪森药业曾于2019/5/28与Viela Bio公司达成协议,斥资2.2亿美元获得了该药中国权益。
此次批准是基于一项代号为N-Momentum的关键性临床试验结果。该研究共纳入230例NMOSD患者,其中包括213例AQP4阳性患者。结果显示,接受治疗6个月后,89%的AQP4阳性患者疾病没有复发,而安慰剂组这一数值为58%,到达主要终点。另外,接受inebilizumab治疗的患者在关键的次要终点上也显示出显著的统计学差异,包括降低NMOSD相关的住院率。详细:Lancet:Inebilizumab可降低视神经脊髓炎谱系疾病 (NMOSD)发作风险
inebilizumab安全性和耐受性良好,最常见的不良反应为尿路感染(20%)、鼻咽炎(13%)、输液反应(12%)、关节痛(11%)和头痛(10%)。
NMOSD是一种罕见自身免疫疾病,患者体内过度活跃的免疫细胞和自身抗体会攻击视神经和脊髓,导致患者会出现失明、截瘫、感觉丧失、膀胱失调、以及外周疼痛等症状。据估计,80%的NMOSD患者AQP4抗体呈阳性。inebilizumab可以结合B细胞表面的CD19抗原,耗竭CD19+B细胞。
36. lurbinectedin
商品名:Zepzelca
公司:Jazz制药公司/PharmaMar
6月15日,FDA加速批准Jazz制药公司/PharmaMar公司的Zepzelca(lurbinectedin) 上市,用于治疗铂类药物化疗后疾病进展的转移性小细胞肺癌。该药美国市场销售权益归Jazz制药所有,中国开发及商业化权益则归绿叶制药所有。详细:转移性小细胞肺癌(SCLC)新药Zepzelca(lurbinectin)已获批准
lurbinectedin是海鞘素衍生物,为RNA聚合酶II的抑制剂,能够与DNA双螺旋结构上的小沟共价结合,抑制RMG1和RMG2,使肿瘤细胞在有丝分裂过程中畸变、凋亡、最终减少细胞增殖。2018年8月,FDA授予lurbinectedin用于治疗小细胞肺癌的孤儿药资格。
37. avapritinib
化学名:avapritinib
商品名:Ayvakit
公司:Blueprint Medicines
1月9日,FDA批准Blueprint Medicines公司的Ayvakit (avapritinib)上市,用于治疗携带血小板源性生长因子受体 α(PDGFRA)基因18外显子突变的不可手术或转移性成人胃肠道间质瘤(GIST)患者,其中也包括D842V 位点突变这种最常见的18外显子跳跃突变类型。详细:Blueprint的Ayvakit成为美国首个获批治疗罕见胃肠道间质瘤突变的靶向疗法
Avapritinib是一种口服的、具有高活性高选择性的KIT及PDGFRα抑制剂。具有KIT及PDGFRα突变(包括KIT D816V、PDGFRα D842V 和KIT 外显子17突变)的多种疾病对标准疗法响应很差,缺乏有效的治疗方式,avapritinib针对以上突变在临床前均表现了很好的活性。
GIST是一类起源于胃肠道间叶组织的肿瘤,占消化道间叶肿瘤的大部分。GIST 可以发生于消化道的任何部位,以胃和小肠最为常见,分子机制是编码酪氨酸激酶受体蛋白基因 KIT(CD117) 或血小板源性生长因子受体 α(PDGFRα) 基因激活突变所致。大约6%的新确诊患者携带PDGFA外显子18突变。
38. lactitol
商品名:Pizensy
公司:Braintree实验室
2月12日,FDA批准Braintree实验室开发的Pizensy(lactitol)上市,用于治疗慢性特发性便秘(CIC)成人患者。
CIC是一种以排便困难、排便次数不频繁、腹痛腹胀为主要特征的疾病,在美国,大约有3500万人受到这一疾病的困扰。目前,临床上主要以包括泻药在内的药物进行治疗,这类药物虽然能一定程度缓解病人症状,但同时也带来了药物依赖。
Pizensy是一种口服乳糖醇疗法,属于渗透性泻药,它能够促进水分进入肠道,进而达到通便作用。一项随机、双盲、安慰剂对照的多中心临床试验结果表明,Pizensy治疗组较安慰剂组患者在一周内达到3次完全自发排便次数(CSBMs)或者较基线比至少增加1次CSBMs的患者比例分别为25%和13%,到达主要终点。
安全性方面,常见的不良反应为上呼吸道感染、腹胀、腹泻、血肌酐磷酸激酶升高、腹胀和血压升高。
39.FDA 首次批准头部虱子新药Xeglyze
药物名称:abametapir
商品名:Xeglyze
公司:Dr. Reddy’s
批准时间:2020年7月
适应症:1% 浓度Clascoterone乳膏可用于治疗12岁以上的痤疮患者。
2020年7月24日,美国FDA首次批准来自印度大药厂Dr. Reddy’s的Xeglyze (abametapir)上市,用于6个月及以上患者头部虱子感染的局部治疗(topical treatment of head lice infestation)。本品是一款浓度为0.74% [w/w]的洗液剂型。此前报道:Abametapir洗剂,只需10分钟,即可治疗头虱!
Xeglyze (abametapir)在美递交的新药上市申请属于505(b)(1) NDA,Type 1 - New Molecular Entity。Xeglyze的主要活性成分abametapir是一种金属蛋白酶抑制剂,在使用Xeglyze洗头发后,抑制头虱孵卵化蛋,影响虫卵发育和和成虫虱子存活。
Xeglyze最早由澳大利亚制药企业Hatchtech Pty Ltd研制开发,2015年9月向美国FDA提出新药上市申请,历时约5年获批上市。2015年9月,Hatchtech包含美国在内的部分地区产品权益转让给Dr. Reddy’s。本次批准触发向Hatchtech Pty Ltd支付2,000万美元的先前合同约定的商业化里程碑付款。
40. 多重耐药HIV成人感染
化学名:磷坦姆沙韦(fostemsavir )
商品名:Rukobia
适应症:联合其他抗逆转录病毒(ARV)药物治疗因耐药、不耐受或安全性而无ARV方案、且既往接受过多种治疗方案的多重耐药HIV成人感染者。详细:FDA批准新型抗HIV疗法Rukobia,用于治疗选择有限的患者
Fostemsavir是一款“first-in-class”HIV病毒附着抑制剂。是temsavir的前体药物,temsavir能够与HIV-1包膜糖蛋白gp160复合体的gp120亚基相结合,阻断病毒与细胞CD4受体的相互作用,从而防止病毒感染宿主细胞。

磷坦姆沙韦结构式
Fostemsavir由GSK开发,于今年7月2日获FDA批准上市。此前,美国FDA曾授予fostemsavir突破性疗法认定和快速通道资格、优先审评资格。Fostemsavir目前在中国尚无申报记录。
41.RET融合阳性的局部晚期或转移性NSCLC成人患者
化学名:普拉替尼(pralsetinib)
适应症:转移性RET融合阳性非小细胞肺癌
普拉替尼今年9月4日被FDA首次批准,用于治疗RET融合阳性的局部晚期或转移性NSCLC成人患者。12月1日,普拉替尼获得FDA批准用于需要全身治疗的12岁以上儿童及成人晚期或转移性RET突变甲状腺髓样癌,以及需要全身治疗且放射性碘难治的12岁及以上儿童及成人晚期或转移性RET融合阳性MTC。详细:FDA批准Gavreto(pralsetinib)治疗转移性RET融合阳性非小细胞肺癌,FDA批准RET抑制剂pralsetinib新适应症!治疗甲状腺髓样癌
普拉替尼结构式
普拉替尼是Blueprint公司开发,基石药业拥有该药单药或联合治疗在大中华地区的独家临床开发与商业化权利。12月18日,CDE授予普拉替尼突破性疗法资格,目前在国内处于“申报上市”阶段。
42.PH1药物
化学名:lumasiran
适应症:1型原发性高草酸尿症(PH1)
类型:RNAi类药物
PH1是一种罕见的常染色体隐性遗传病,由于患者肝脏代谢异常导致内源性草酸盐产生过多,过量的尿草酸盐从肾脏排泄,可导致危及生命的终末期肾病(ESRD)和其他系统性并发症。疾病表现的异质性常常导致诊断延迟,尤其在成年PH1患者中,从症状出现到确诊中位时间约为6年。PH1未经治疗会导致进行性肾脏损害。ESRD患者需要进行透析以除去血液中的代谢物及草酸盐直到能够或符合条件接受双重或连续肝/肾移植。详细:FDA为Alnylam的RNAi疗法Lumasiran授予优先审查,用于治疗1型原发性高草酸尿症
Lumasiran是一种靶向羟基酸氧化酶1(HAO1)mRNA的RNAi疗法,该mRNA参与编码乙醇酸氧化酶(GO),而GO是一种可导致PH1缺陷的上游酶。lumasiran通过降解HAO1 mRNA,减少GO的合成,抑制草酸生成。Lumasiran通过皮下注射给药,每月注射1次,连续治疗3个月后按实际体重每季度注射1次。对于体重低于10kg的患者,仍需每月持续给药。
Lumasiran由Alnylam开发,并于11月19日获FDA批准上市,这是首个批准用于治疗PH1的药物,也是Alnylam获批的第3款RNAi疗法。Lumasiran目前在国内尚无申报记录。
43.成人和儿童埃博拉病毒感染
化学名:ansuvimab
适应症:成人和儿童埃博拉病毒感染。
埃博拉病毒是一种能引起人类和其他灵长类动物产生埃博拉出血热的烈性传染病病毒。它通过直接接触感染者或野生动物的血液、体液和组织而传播。
ansuvimab是一种1995年从刚果埃博拉疫情的幸存者身上分离的单克隆抗体,通过阻断病毒与细胞受体的结合,阻止病毒进入细胞。是FDA批准的第2款治疗埃博拉病毒感染的疗法。今年10月,FDA批准再生元的中和抗体鸡尾酒疗法Inmazeb治疗埃博拉病毒感染。
Ansuvimab由Ridgeback开发,并于今年12月21日获FDA批准,是FDA批准的唯一一款冻干型单针注射埃博拉治疗药物。
44.Sogroya(Somapacitan)美国获批治疗成人生长激素缺乏症(GHD)
化学名:somapacitan-beco
商品名:Sogroya
适应症:成人治疗生长激素缺乏症(GHD)
Sogroya(somapacitan-beco)是一种人生长激素(hGH)的长效类似物,采用了已应用于延长胰岛素、GLP-1半衰期方面将近20年的蛋白质技术。somapacitan是由天然的hGH经过修饰以增强其与血浆蛋白白蛋白(albumin)的结合,使其适合每周一次给药。
- GHD是一种以脑垂体前叶分泌生长激素不足为特征的疾病,垂体前叶是一个位于大脑底部的小腺体,可产生多种激素。生长激素是一种由脑垂体产生的蛋白质,调节生长和新陈代谢。
2020年09月02日 美国食品和药物管理局(FDA)批准诺和诺德(Novo Nordisk)每周一次长效生长激素衍生物Sogroya(somapacitan-beco),用于成人治疗生长激素缺乏症(GHD)。www.100pei.com
- 在治疗成人GHD方面,Sogroya是第一个每周只需皮下注射一次的人生长激素(hGH)疗法,而其他经FDA批准的hGH制剂必须每天注射。
Sogroya在一项随机、双盲、安慰剂对照试验中进行了评估。该试验入组了300例GHD患者,这些患者在研究前至少三个月从未接受过生长激素治疗或停止使用其他生长激素制剂治疗。试验中,患者被随机分配接受:
- 每周一次皮下注射Sogroya
- 每周一次安慰剂(无效治疗)
- 每日一次注射Norditropin(somatropin)
Sogroya的有效性是由躯干脂肪的百分比变化确定,躯干脂肪是积聚在身体躯干或中心区域的脂肪,由生长激素调节,可与严重的医学问题相关。
结果显示,在34周治疗期结束时,接受每周一次Sogroya组患者躯干脂肪平均减少了1.06%,而安慰剂组患者躯干脂肪增加了0.47%、每日一次Norditropin组患者躯干脂肪减少2.23%。每周一次Sogroya组患者和每日一次Norditropin组患者在其他临床终点也有类似的改善。
该试验中,Sogroya最常见的副作用包括:背痛、关节痛、消化不良、睡眠障碍、头晕、扁桃体炎、手臂或小腿肿胀、呕吐、肾上腺功能不全、高血压、血肌酸磷酸激酶(一种酶)增加、体重增加和贫血。
45. 拜耳Lampit(硝呋莫司,易分散刻痕片)获美国FDA批准上市
美国食品和药物管理局(FDA)已批准Lampit(nifurtimox,硝呋莫司)刻痕片,用于儿科患者(0岁至18岁以下,体重≥2.5公斤),治疗由克氏锥虫(T. cruzi)引起的恰加斯病(Chagas disease,又名:南美锥虫病)。详细:FDA批准Lampit(nifurtimox)用于治疗儿童恰加斯病
46. FDA批准罕见代谢疾病首款药物疗法
化学名:triheptanoin,三庚酸甘油酯
商品名:Devolve
公司:Ultragenyx
批准时间:2020年6月
2020年6月30日,致力于开发罕见病创新疗法的Ultragenyx Pharmaceutical公司宣布,美国FDA已批准Devolve(triheptanoin,三庚酸甘油酯)作为卡路里和脂肪酸的来源,治疗通过分子诊断确认的长链脂肪酸氧化障碍(LC-FAOD)儿科和成人患者。LC-FAOD是一组威胁生命的罕见遗传性疾病,患者机体无法将长链脂肪酸转化为能量。Dojolvi是一种高纯度、人工合成的7碳脂肪酸甘油三酯,专门为LC-FAOD患者提供中链、奇数碳脂肪酸作为能源和代谢产物替代品。新闻稿指出,这是治疗这些患者的首款获批药物疗法。详细:首款脂代谢紊乱药物Triheptanoin被FDA批准上市
LC-FAOD是一组以机体不能将长链脂肪酸转化为能量的代谢缺陷为特征的常染色体隐性遗传病。患者由于不能将脂肪转化为能量,导致体内葡萄糖严重耗竭,出现严重并发症,从而导致住院或早夭。由于存在包括早期死亡在内的严重结局风险,LC-FAOD被纳入美国和某些欧洲国家的新生儿筛查检测。
Dojolvi是一种高纯度、药用级、奇数碳中链甘油三酯,在甘油骨架上通过多个化学合成步骤添加了三个7碳脂肪酸形成。它旨在为LC-FAOD患者提供中链、奇数碳脂肪酸作为能源和代谢物替代品。
47.瑞马唑仑
商品名:Byfavo
公司:Acacia Pharma
7月2日,FDA批准Acacia Pharma的Byfavo(瑞马唑仑)上市,用于镇静。
瑞马唑仑是一种新型苯二氮类药物,为超短效GABAa受体激动剂,该药已经在中国获批上市,国内权益归人福医药所有。
48.tafasitamab-cxix
商品名:Monjuvi
公司:MorphoSys/Incyte
7月31日,FDA批准MorphoSys/Incyte公司的Monjuvi(tafasitamab-cxix)上市,联合来那度胺,二线治疗成人复发/难治性弥漫性大B细胞淋巴瘤(DLBCL)患者,包括低级别淋巴瘤引起的DLBCL,以及不适合接受自体干细胞移植(ASCT)的患者。详细:FDA批准Monjuvi(tafasitamab-cxix)联合来那度胺治疗复发难治弥漫性大B细胞淋巴瘤
Monjuvi是一种CD19单抗,II期L-MIND研究结果表明,接受Monjuvi治疗的患者总应答率(ORR)为55%,到达主要终点,其中,完全应答(CR)率为37%,部分应答率(PR)为18%。 中位反应持续时间(mDOR)为21.7个月,到达次要终点。
安全性方面,Monjuvi最常见的不良反应有中性粒细胞减少、疲劳、贫血、腹泻、血小板减少、咳嗽、发热、周围水肿、呼吸道感染和食欲下降。
49.oliceridine
商品名:Olynvik
公司:Trevena
8月7日,FDA批准Trevena公司的Olynvik(oliceridine)上市,用于需要使用静脉注射阿片类药物的成人中度至重度急性疼痛。该药物的中国权益归恩华药业。
美国每年大约有4500万住院患者需要静脉注射阿片类药物来治疗急性疼痛,这些患者大多情况比较复杂且难以治疗,如老年、肥胖或肾功能不全患者。Olynvik是一种阿片类激动剂,该药能够在注射后2-5分钟内起效,此外,还不需要对肾功能不全患者调整剂量。
50. viltolarsen
商品名:Viltepso
公司:Nippon Shinyaku
8月12日,FDA批准Nippon Shinyaku公司的Viltepso(viltolarsen)上市,用于治疗外显子53跳跃突变的杜氏肌营养不良(DMD)患者。
Viltepso是一款反义寡核苷酸药物,此前已经在日本获批上市。这也是FDA批准的第2款针对外显子53跳跃突变的DMD药物,该突变大约占到DMD患者人群的8%。临床试验结果显示,接受Viltepso治疗25周,患者抗肌萎缩蛋白水平从基线0.6%提高到5.9%。
51. satralizumab
商品名:Enspryng
公司:罗氏
8月14日,FDA批准罗氏Enspryng(satralizumab)上市,用于治疗视神经脊髓炎谱系疾病(NMOSD)成人和儿童患者。该药此前已经在日本获批,并在欧盟和中国提交了上市申请。
NMOSD是一种高复发、高致残的中枢神经系统自身免疫性疾病,据估计全球大约有20万人受到该疾病影响,其中欧洲大约为1万例,美国大约为1.5万例。NMOSD通常与致病抗体(AQP4-IgG)有关,AQP4-IgG针对并破坏星形胶质细胞,导致视神经、脊髓和大脑的炎性损害。大约70-80%的NMOSD患者的血清中可以检测到AQP4-IgG抗体。
Satralizumab是一种IL-6R单抗,通过阻断IL-6信号转导,调节NMOSD疾病发生的多个环节,如抑制NMOSD特异性抗体AQP4-IgG的产生及中枢神经系统内外的炎症反应等。
52.Klisyri(tirbanibulin)上市用于局部治疗光化性角化病(AK)
化学名:tirbanibulin
商品名:Klisyri
适应症:局部治疗光化性角化病(AK)
Klisyri(tirbanibulin)是一种微管抑制剂,通过抑制微管的聚合,它可以促进增生细胞发生细胞凋亡,适用于面部或头皮光化性角化病的局部治疗。据悉,Athenex与Almirall在2017年达成研发和推广合作,共同在美国和欧洲开发tirbanibulin。
FDA的批准是基于两项随机双盲、含赋形剂对照的关键性3期临床试验的数据,这两项研究评估了Klisyri(tirbanibulin)1%软膏在702名面部或头皮光化性角化病成人患者中的疗效和安全性。与赋形剂相比,在第57天,接受tirbanibulin治疗患者中的面部或头皮病灶完全清除的患者数量显著提高。
53. Viberon
Viberon用于膀胱过度活动症
批准时间:2020年12月
下面是医药魔方整理的图:
上述内容来自:梅斯医学,医药魔方,找药宝典等
作者:MedSci整理
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#FDA批准#
52
好,赚积分
63
很好
68
#新药上市#
60
#肿瘤药#
41