Cell:逆转肿瘤组织中的调节性T细胞对于促进免疫疗法至关重要
2017-05-31 MedSci MedSci原创
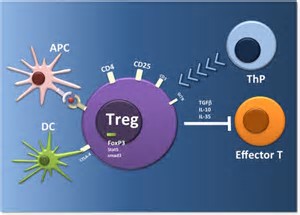
这一研究表明,如何有效的靶向改变肿瘤内部调节型T细胞,使之转变为抑制肿瘤的T细胞,对于抗癌的免疫疗法至关重要。通过降低文章描述的Nrp1基因的表达也许能够成为未来有效的新目标。
作者:MedSci
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






#CEL#
22
#Cell#
35
再次学习调节性T细胞,谢谢
79
学习一下很不错
65
认真学习,不断进步,把经验分享给同好。点赞了!
62