Genes Dev:施一公研究组报道剪接体SF3b复合物结合小分子药物的电镜结构
2018-03-09 佚名 中国生物技术网
2018年3月2日,来自施一公研究组的博士后Lorenzo Finci与来自美国的制药公司H3 Biomedicine合作在(Genes & Development)杂志在线发表了题为“The cryo-EM structure of the SF3b spliceosome complex bound to a splicing modulator reveals a pre-mRNA subs
2018年3月2日,来自施一公研究组的博士后Lorenzo Finci杂志在线发表了题为“The cryo-EM structure of the SF3b spliceosome complex bound to a splicing modulator reveals a pre-mRNA substrate competitive mechanism of action ”的研究长文,首次报道了人源剪接体组分SF3b复合物结合小分子药物的近原子分辨率结构。该结构为理解这些药物的作用机理提供了重要的结构信息,并为使用冷冻电镜技术寻找剪接体靶向药物提供了思路。
RNA剪接异常与癌症具有密切联系。在骨髓癌、淋巴癌、皮肤癌以及乳腺癌等多种常见癌症中均发现了剪接体蛋白组分的体细胞突变。这些癌症相关的突变大多数都分布在剪接体SF3b复合物的组分SF3b1这个蛋白上,因此SF3b1一直是治疗癌症的重要靶向之一。第一个进入临床实验的剪接体靶向药物是E7107,体外的生化实验表明E7107可以特异性结合SF3b1,并抑制剪接反应,但其作用机理尚不明确。
在该研究中,Finci等人使用冷冻电镜技术获得了SF3b复合物结合小分子药物E7107的高分辨结构(图 1A)。该结构显示E7107与SF3b1的一段保守序列相互作用(图 1B)。而在该组此前的剪接体结构中,这段序列结合的是pre-mRNA的分支序列(branch sequence)。这样的结果暗示了一种竞争性的结合机制。为了验证这种作用机理,他们突变了这段序列中的部分氨基酸,发现改造后细胞对E7107具有了抗性;他们还设计了E7107及其衍生物与pre-mRNA的体外竞争性实验 。最终他们根据结构和生化数据提出了E7107与pre-mRNA竞争结合SF3b1,从而调控剪接反应的猜想。此外,这还是第一个结合了小分子抑制剂的剪接体相关复合物的结构,对于理解药物作用机理以及 RNA剪接调控具有重要的意义。
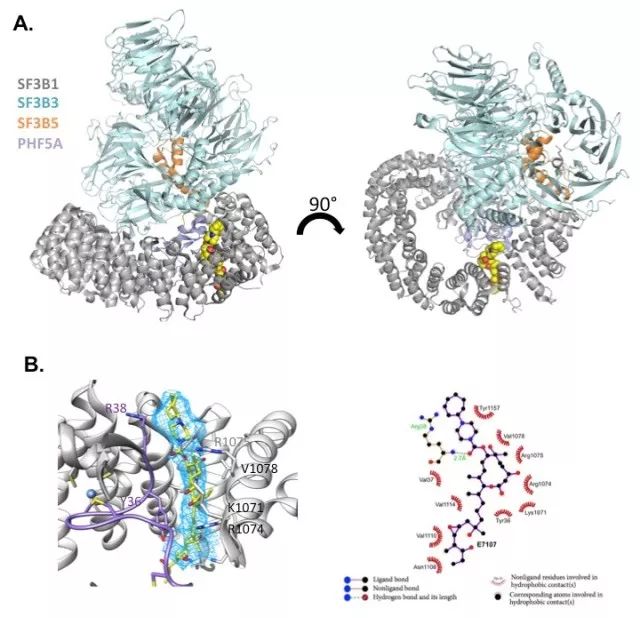
图1. SF3b复合物结合小分子药物E7107
Lorenzo Finci为本文第一作者及通讯作者。来自清华大学的张晓峰、黄修良、周强对课题做出了重要贡献。来自H3 Biomedicine公司的Nicholas Larsen为本文共同通讯作者,Jennifer Tsai, Teng Teng, Anant Agrawal, Betty Chan, Sean Irwin, Craig Karr, Andrew Cook, Ping Zhu, Dominic Reynolds, Peter G Smith, Peter Fekkes, Silvia Buonamici同样做出了重要贡献。本课题得到了清华大学冷冻电镜平台,高性能计算平台、国家蛋白质设施实验技术中心(北京)的大力支持;本工作主要获得北京市结构生物学高精尖创新中心的经费支持,并获得了国家自然科学基金委以及科技部的资助。施一公教授指导了该课题,并提供了诸多建议和帮助。
原始出处:
Finci LI, Zhang X, Huang X, et al.The cryo-EM structure of the SF3b spliceosome complex bound to a splicing modulator reveals a pre-mRNA substrate competitive mechanism of action.Genes Dev. 2018 Feb 1;32(3-4):309-320. doi: 10.1101/gad.311043.117.
作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言





#小分子#
46
#Gene#
43
#剪接体#
44
#复合物#
36
#Dev#
36