癌症生物学系列:细胞永生化与肿瘤形成
2024-06-17 小药说药 小药说药
为了形成肿瘤,初期的癌细胞必须突变在正常情况下会限制它们增殖潜能的屏障。它们必须通过某种方式获得异常大量的生长分裂周期循环,只有这样才能成功完成肿瘤的多步骤致瘤过程。
1 前言
在常常人体细胞朝着肿瘤性生长状态进化的漫长时间内,它们经历了长期连续的生长分裂周期循环。然而,如此激烈的增殖方式与正常人类细胞的基本特征相冲突:正常人类细胞只被赋予了有限增殖的能力。一旦正常人类细胞耗尽了所允许的细胞倍增次数的配额,这些细胞群体里的细胞将会停止增殖,甚至会进入细胞凋亡。
这些事实告诉我们一个简单又不可避免的结论:为了形成肿瘤,初期的癌细胞必须突变在正常情况下会限制它们增殖潜能的屏障。它们必须通过某种方式获得异常大量的生长分裂周期循环,只有这样才能成功完成肿瘤的多步骤致瘤过程。
2 细胞的永生化
在20世纪60年代中期科学家首次证明,体外培养的啮齿动物或人类胚胎细胞的连续增殖能力是有限的。研究发现,体外培养的细胞在经过特定的分裂次数后,将会停止生长并进入复制衰老期。通常衰老的细胞会继续保持代谢活性,但不可逆地失去了重新进入细胞周期进行复制的能力。
虽然大多数细胞在体外复制次数有限,但胚胎干细胞(ES)则显示出相反的生物学特性。这类细胞来源于早期胚胎组织,在适当条件下,ES细胞可以分化为人体内所有的已分化的细胞谱系。在体外培养时,如果提供合适的营养,这些细胞会展现无限增殖的潜能,即永生化。
由于体外培养细胞经常失败,癌细胞永生化的结论是基于人类肿瘤中的一小部分细胞能够容易地适应体外环境的事实。而且,那些适应体外培养后进行生长的癌细胞通常具有永生化特性,这一事实强烈提示永生化是癌细胞进入恶性生长状态的必要条件,即癌细胞的永生化是形成肿瘤的先决条件。
3 衰老和危象是抑制肿瘤发展的重要屏障
然而,为什么正常细胞谱系无法永生化生长呢?或许,机体赋予正常细胞有限的增殖能力是一种抗癌防御机制。人们提出了两种调控体外生长细胞增殖能力的机制,第一种是测量细胞谱系在很长一段时间内所遭受的累积性生理应激,一旦细胞遭受伤害超过一定阈值变会停止增殖,这会使细胞进入衰老状态。
第二种调节机制是测量一个细胞谱系经历了多少代复制,一旦预定的细胞增殖次数消耗完,细胞会发出一种更强烈的信号,使细胞进入“细胞危象”,这将导致细胞群体中的多数细胞发生凋亡。
衰老的开启伴随着两个重要的CDK抑制分子p16INK4A和p21Cip1表达的升高。这些CDK抑制分子能够停止细胞周期的进展,使细胞进入非生长状态。此外,高氧、内源性活性氧物质、X射线、化疗药物及功能受损端粒所导致的DNA损伤,以及某些癌蛋白的异常信号转导都可能引起细胞衰老。
衰老细胞虽然停止了增殖,但在相当长一段时间内保存了细胞的生存能力,而细胞危象则是细胞凋亡产生的细胞死亡。衰老细胞似乎仍然具有相对稳定的核型,但是危象状态的细胞出现了广泛的核型紊乱。

与导致细胞衰老的机制不同,启动细胞危象的分子装置实际上是一种功能性的计数设备,它能够记录细胞谱系自早期胚胎开始经历了多少次连续生长分裂循环。这就是位于染色体末端的端粒,端粒扮演着阻止染色体末端融合的角色,它就像鞋带末端的带扣一样,在染色体末端形成一道保护屏障。细胞中每个端粒DNA由5’-TTAGGG-3’六核苷酸重复系列构成,它们会串联重复数千次。这些重复序列和相关蛋白一起形成了功能性端粒。
4 端粒的结构
19世纪80年代中期,人们逐步揭示了端粒及其DNA的分子结构。除了早期认为的六核苷酸重复序列外,哺乳动物细胞乃至所有真核细胞的端粒DNA都含有一种附加的特殊结构:富G链多出一百至数百个核苷酸,导致该链3’单链端外悬。通常发现这种凸出的链会形成一种最不寻常的分子构型——t环。
它发现与20世纪90年代后期,当时通过电子显微镜分析端粒DNA时发现了一种环形结构,实际上是套索结构。这种构型的形成依赖于三链DNA复合体的形成。T环有助于保护线性DNA分子末端,因为单链末端的外悬区被巧妙地塞进双链区域,以保护其免受损伤。
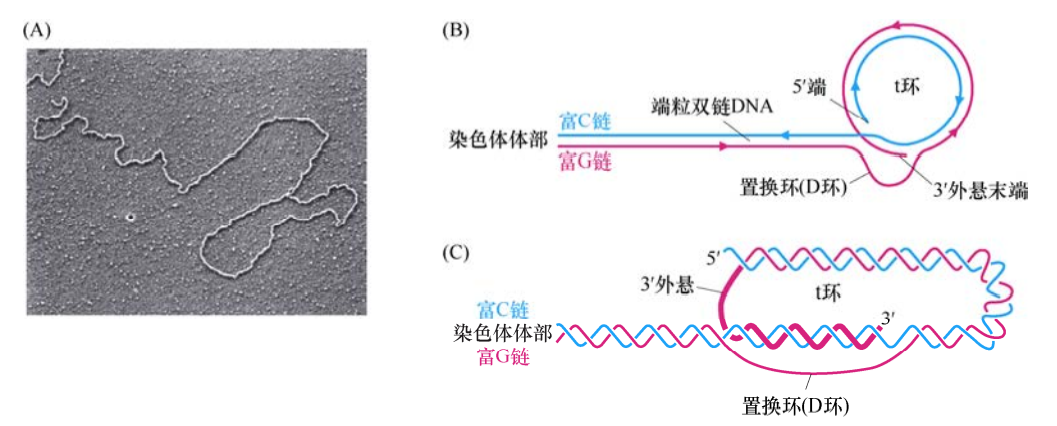
相对较长的双链端粒DNA和相对较短的外悬单链末端都与特定蛋白质相结合。一些蛋白质中含有能够特异识别并结合该六核苷酸序列的结构域,它们能够与端粒DNA的双链和单链区结合。端粒结合蛋白、尚未被发现的相关蛋白及端粒DNA一起构成的核蛋白复合体被称为端粒。
5 端粒的作用机制
在细胞周期的S期,复制机制能高效地复制线性DNA分子中间的序列,但复制染色体末端序列是极其困难的。困难之处在于所有的DNA链的合成必须从已有DNA的3’羟基端开始,DNA3’羟基端以与引物相似的方式来延伸核DNA链。如果没有可用的DNA引物,则以RNA分子的3’端作为DNA合成的引物。
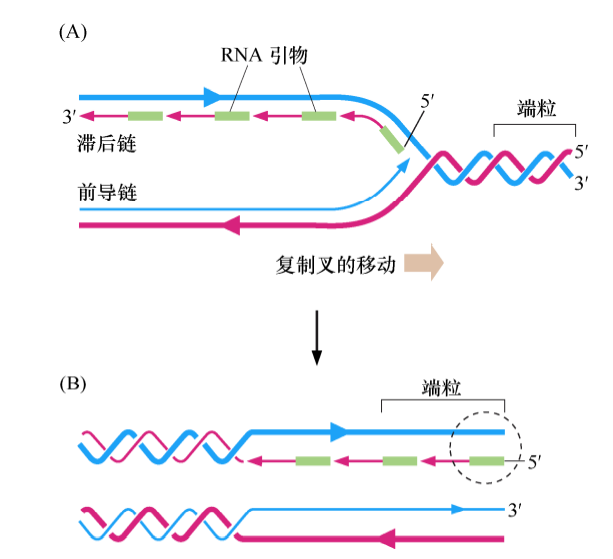
如果引物酶恰巧在距模板链3’端的一定距离放置了一个RNA引物,那么DNA聚合酶新合成的DNA链的3’端将缺少一定数量与模板链互补的碱基。最后的结果是DNA两条模板链的其中一条末端的核苷酸序列不能被恰当复制。
末端复制的问题可以解释正常细胞每一次分裂后端粒DNA的缩短。除了端粒DNA末端的复制不足,细胞中核酸外切酶也会对端粒DNA的末端造成损坏,其最终所导致的端粒末端侵蚀也许会更大。无论何种原因,在许多类型的正常人类细胞中,细胞所分裂增殖一代端粒将会丢失50-100bp的DNA。这种对端粒DNA的持续性破坏是限制细胞传代能力的分子机制。
6 肿瘤细胞的端粒变化
一般而言,端粒衰竭和细胞危象似乎是细胞无法逃避的不可逆过程。然而进一步分析发现细胞永生化途径简单而明确,细胞能够通过重建端粒来渡过危象期,从而消除之前限制细胞增殖、使其进入危象的分子记忆。
端粒重建通过端粒酶的作用完成,端粒酶能特异地延长端粒DNA。通过端粒重复序列扩增试验(TRAP)进行检测发现,在85%-90%的人肿瘤细胞样品中都能检测到端粒酶活性,而其在正常细胞中水平很低。低水平的端粒酶活性,虽然能最低限度地维持端粒DNA的稳定,但不能阻止每一次正常细胞周期复制分裂过程中端粒的进行性损耗。
哺乳动物细胞端粒酶全酶的核心由两个亚基组成。其中一个亚基为DNA聚合酶,更确切地说是逆转录酶,能以RNA为模板合成DNA。但是与其他逆转录酶不同,端粒酶巧妙地组装自身RNA模板即第二个必需亚单元、由415个核苷酸长度的RNA分子的一小部分作为模板来指导全酶的逆转录活性。
在人类细胞中,人端粒酶逆转录酶(hTERT)的催化亚单位能够合成与端粒酶相关RNA分子中六核苷酸序列互补的DNA分子,使这些核苷酸结合到端粒DNA的3’端富G链外悬区域。一旦在危象细胞群体中出现一个永生化细胞变异体,其后代通常表达高水平的hTERT mRNA,并变现出高水平的端粒酶活性。这说明解除hTERT的表达抑制可以使细胞规避危象状态。
在肿瘤进展过程中,调控解除hTERT转录抑制的机制非常复杂,目前还并不清楚。有许多转录因子可作用于hTERT启动子。Myc蛋白作为转录因子,其可以控制细胞周期时钟,也可以促进hTERT转录。除了Myc之外,HPV中的E6癌蛋白,以及由Ras-MAPK信号通路激活的ER81转录因子也可以刺激hTERT的转录。
2013年发现在黑色素瘤基因组中71%的hTERT基因启动子都发生了高频突变,而在非黑色素瘤肿瘤细胞DNA中这一比例为16%,这些体细胞突变使启动子活性增强了2-4倍。
参考文献:
1. 《The biology of CANCER》second edition. Robert.A Weinberg
作者:小药说药
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#肿瘤# #细胞永生#
5