NEJM重磅:K药一线治疗三阴乳腺癌OS结果终现!
2022-07-22 MedSci原创 MedSci原创
N Engl J Med:帕博利珠单抗联合化疗治疗晚期三阴性乳腺癌
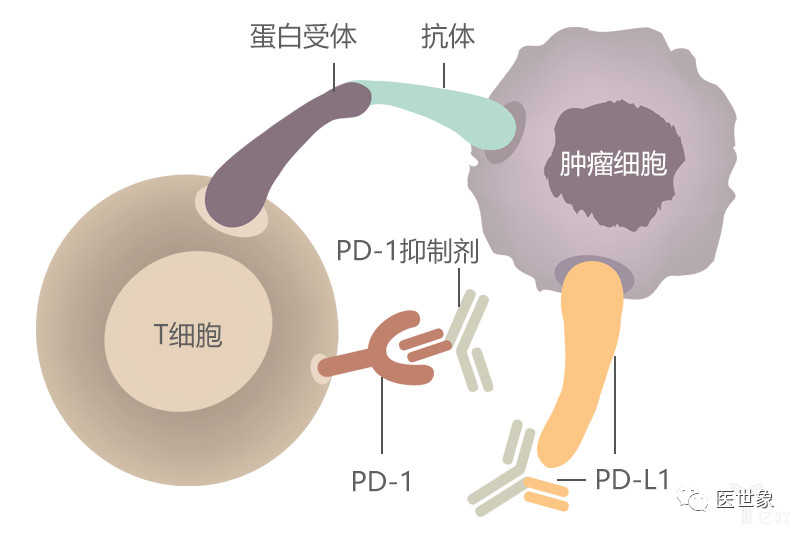
此前,在这项3期临床试验的中期分析中,在化疗中加入帕博利珠单抗(pembrolizumab,K药)比单独化疗治疗晚期三阴性乳腺癌患具有更长的无进展生存期,这些患者的肿瘤表达程序性死亡配体1(PD-L1)且联合阳性分数(CPS)为10或以上。

研究人员以2:1的比例随机分配了既往未治疗的局部复发性无法手术或转移性三阴性乳腺癌的患者,每3周接受一次帕博利珠单抗(200mg)加研究者选择的化疗(白蛋白结合紫杉醇,紫杉醇或吉西他滨-卡铂)或安慰剂加化疗。主要终点为PD-L1高表达(CPS≥10,CPS-10亚组)、PD-L1阳性(CPS≥1,CPS-1亚组)和意向治疗(ITT)人群的无进展生存期(PFS,此前已披露)和OS,次要终点包括客观缓解率(ORR)、缓解持续时间(DoR)、疾病控制率(DCR)、生活质量评估和安全性。
共有847名患者纳入本次研究,其中566名被分配到帕博利珠单抗组,281名被分配到安慰剂组。中位随访时间为44.1个月。在CPS-10亚组中,帕博利珠单抗组的中位OS为23.0个月,安慰剂组为16.1个月(死亡HR为0.73;95% CI,0.55-0.95;双侧P=0.0185 [符合显著性标准]);在CPS-1亚组中,两组的中位OS分别为17.6个月和16.0个月(HR,0.86;95%CI,0.72-1.04;双侧P=0.1125 [无显著]);在意向治疗人群中,中位总生存期分别为17.2个月和15.5个月(HR为0.89;95%CI,0.76-1.05 [未测试显著性])。
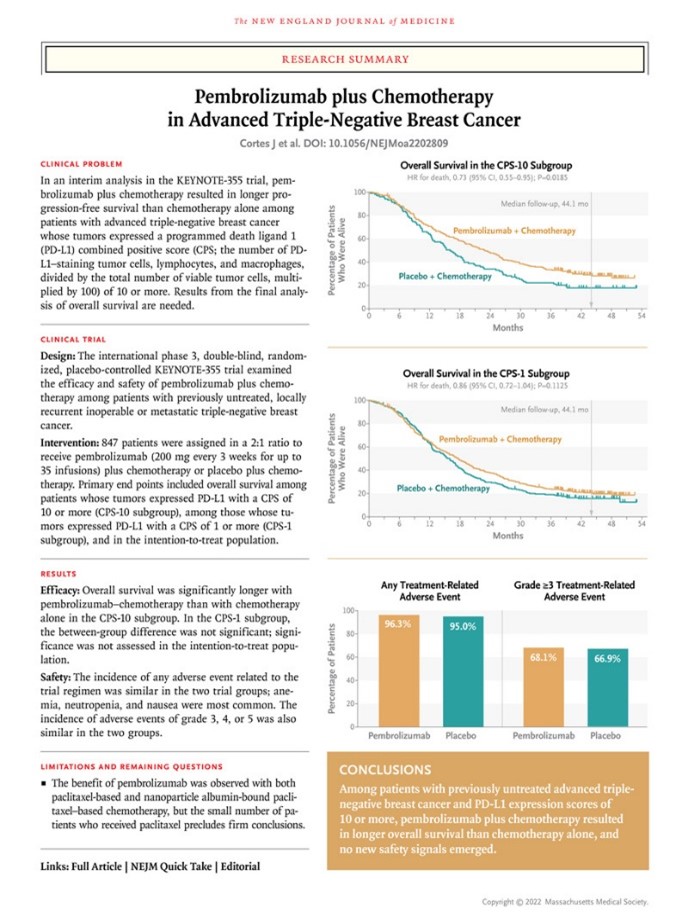
在安全性方面,与治疗相关的3级、4级或5级不良事件发生在68.1%的帕博利珠单抗组患者和66.9%的安慰剂组中,包括帕博利珠单抗组0.4%的患者死亡,安慰剂-化疗组中没有患者死亡。
总的来说,在肿瘤表达PD-L1且CPS为10或更高的晚期三阴性乳腺癌患者中,相比单独化疗,在化疗中加入帕博利珠单抗带来了总生存期的明显延长。
原文来源:
Cortes J, Rugo HS, Cescon DW, Im SA, Yusof MM, Gallardo C, Lipatov O, Barrios CH, Perez-Garcia J, Iwata H, Masuda N, Torregroza Otero M, Gokmen E, Loi S, Guo Z, Zhou X, Karantza V, Pan W, Schmid P; KEYNOTE-355 Investigators. Pembrolizumab plus Chemotherapy in Advanced Triple-Negative Breast Cancer. N Engl J Med. 2022 Jul 21;387(3):217-226. doi: 10.1056/NEJMoa2202809. PMID: 35857659.
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#重磅#
44
#K药#
56
#肿瘤免疫治疗##OS##三阴乳腺癌##帕博利珠单抗#
92
NEJM上果然牛,感谢梅斯更新及时
43