I期临床研究显示,iNKT细胞安全性优异,临床疗效超预期!
2024-01-01 公众号:基因启明 公众号:基因启明
研究人员设计了一项自体iNKT细胞移植的I期临床试验。该试验的目的是评估自体iNKT细胞治疗肝细胞癌的剂量、安全性、生存期和抗肿瘤效应。
亮点
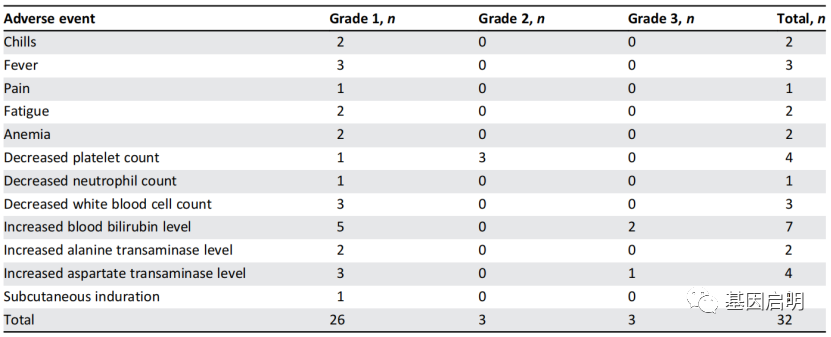
1.iNKT细胞治疗对肝细胞癌患者是安全且耐受性良好的。在任何入选患者中均未观察到严重不良事件,包括一名接受3×1010个iNKT细胞单次输注的患者
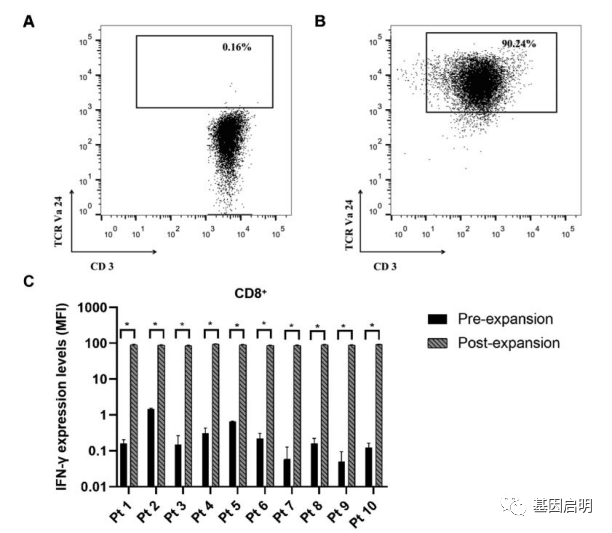
2.iNKT细胞产生Th1样反应,具有抗肿瘤活性
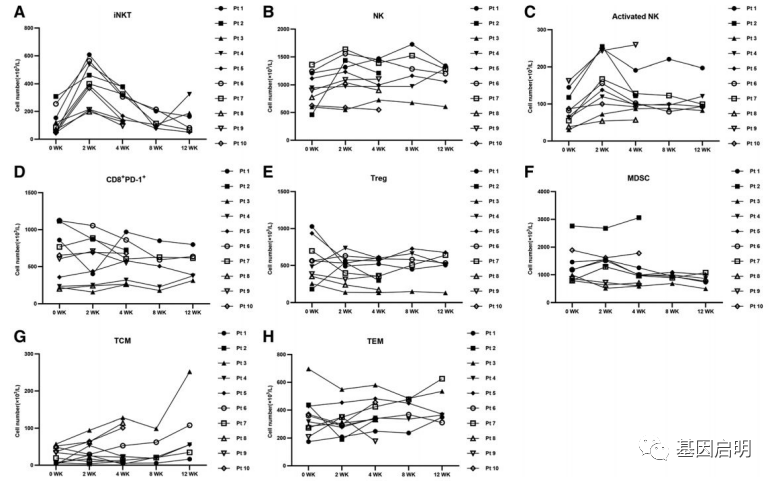
3.iNKT细胞能激活其它免疫细胞,如激活NK细胞,并且抑制肿瘤微环境中的抑制因素,如抑制髓源抑制性细胞(MDSC)

来源:
微信公众号:基因启明
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#肿瘤# #肝癌# #iNKT细胞#
9