Nature Rev Cardio:心血管衰老的八大标志
2023-12-11 网络 网络
人体的心血管系统包括多种不同类型的细胞,比如内皮细胞、平滑肌细胞、心肌细胞、成纤维细胞和免疫细胞。它们相互协作,确保身体内的每个细胞都能得到足够的血液供应,并且代谢废物得到合理处理。
关键要点
● 年龄是心血管健康的最强风险因素之一。
● 心血管系统在持续的机械和代谢压力下运行,随着年龄的增长,在分子、细胞和器官水平上发生功能障碍的风险逐渐增加。
● 自噬功能失效、蛋白稳态丧失、基因组不稳定、表观遗传学改变、线粒体功能障碍、细胞衰老、神经激素信号失调和炎症是心血管衰老的常见分子标志。
● 心血管衰老的标志是紧密交织在一起的,个别标志的加强或减弱会影响到大多数(可能不是所有)的其他标志特征。
● 靶向心血管衰老的标志有望治疗主要的心血管疾病,并在常规风险因素范围之外减少其余的心血管风险

人体的心血管系统包括多种不同类型的细胞,比如内皮细胞、平滑肌细胞、心肌细胞、成纤维细胞和免疫细胞。它们相互协作,确保身体内的每个细胞都能得到足够的血液供应,并且代谢废物得到合理处理。大多数心血管细胞都经历了高度的特化,需要在恶劣的环境下工作,承受持续的机械压力和剪切应力。不过,为了获得独特的功能(比如心肌细胞是心脏中唯一可以收缩的细胞),这些细胞失去了增殖能力,被线粒体和肌节密集包裹,因此在个体生命周期中的增殖能力有限,并且必须适应心血管系统的高压工作条件。虽然人体所有细胞类型的功能随着年龄增长会受到影响,但心肌细胞和其他心血管细胞可能更容易出现与年龄相关的功能障碍和衰竭。随着年龄增长,心血管系统的细胞组成发生改变,导致心脏、血管和微循环经历大量的结构和功能重塑。因此,年龄成为心血管健康的一个重要预测因子。尽管医学在防控心血管危险因素方面取得了进展,但心血管疾病仍然是全球范围内疾病发生、致残和死亡的主要原因。文章指出了“残余心血管风险”这一现象,认为这可能是由于缺乏有效干预衰老过程的措施。同时,性别差异也被认为与心血管风险相关,而用于延缓心血管衰老的干预措施已在动物实验中取得了一定成功。这些例子支持了心血管系统机能恶化在整体衰老中的核心作用观点,表明心血管系统是促进健康衰老的一个重要靶标。
事实上,心血管风险的性别二态性也越来越多地被归因于男女衰老速度的差异。并且用于延缓心血管衰老的干预实验足以延缓模式生物的衰老,比如,对心肌细胞的胰岛素样生长因子(Insulin-like growth factor 1,IGF1)信号通路进行遗传学操作已经实现了对小鼠健康寿命和生命周期的延长。类似还有,靶向血管内皮生长因子(Vascular endothelial growth factor,VEGF)信号通路可以阻止与年龄相关的微血管丢失,并有效延缓多器官系统的年龄相关病变,从而延长小鼠的寿命。这些例子支持了心血管系统机能恶化在系统性衰老中具有核心作用的观点,表明在促进机体健康衰老方面,循环系统是可行的切入靶标。
延缓衰老的干预措施依赖于靶向衰老的分子机制。然而许多经典的“衰老标志”最初是在无脊椎动物模型生物中发现的。尽管这些标志在2023年根据哺乳动物的衰老进行了更新,但其在心血管细胞衰老过程中的具体作用还有待评估。这篇综述中,作者严格基于以下3个标准,列出了8个分子特征作为心血管系统衰老的共同标志(图2):
● 这种现象必须出现在衰老的心脏、血管中或两者皆有。
● 增强该标志的基因操作必然会加速心血管衰老的表征。
● 对标志物进行实验性或治疗性的抑制应延缓、停止或逆转心血管衰老。
这些标志包括主要的衰老机制,即巨自噬功能受损、蛋白质稳态丧失、基因组不稳定、表观遗传改变以及其他下游调控紊乱,包括线粒体功能障碍、神经激素信号失调、细胞衰老和炎症。除了机械论和探索性的思考,作者还强调了如何将这些标志作为治疗目标,以减少残余心血管风险并延长健康寿命。
标志1:巨自噬功能受损
自噬,即巨自噬,是一项至关重要的细胞质量控制机制,致力于清除(并随后替换)功能失调的细胞质组分。在自噬过程中,潜在有害的蛋白质聚集体和老化细胞器被隔离到囊泡中,然后与溶酶体融合,酶解其内容物,提供生物能量和合成代谢所需的物质。因此,自噬不仅有助于维持蛋白质稳态,还通过高度专业化的下游通路,针对细胞质中的异位DNA、脂滴(脂噬)、部分内质网(网噬)、整个细胞器(如线粒体和过氧化物酶体的自噬)以及入侵的病原体(异噬)等大分子进行调节。此外,自噬机制有助于促进“异噬”,即心肌细胞将功能失调的线粒体封装到所谓的外泌囊泡中,将废物排出细胞外,并通过心脏巨噬细胞在胞外进行降解。鉴于其重要的稳态作用,自噬被广泛认为调控着各种真核细胞的健康寿命和寿命,特别是构成心血管系统的细胞。
自噬功能失调与多种心血管疾病有关,包括动脉粥样硬化、冠心病、糖尿病性心肌病、化疗引发的心脏毒性、心律失常和心力衰竭。一些常用的心脏保护药物,例如阿司匹林、β-肾上腺素受体阻滞剂和钙通道阻滞剂,已被证明可以调节自噬活性。越来越多的证据支持随着机体衰老,自噬逐渐衰减,并加速与年龄相关的慢性疾病的发生。在心血管系统中,有报道称老年小鼠和人类脉管系统中的自噬活性逐渐减少。衰老如何影响心脏自噬一直存在争议。事实上,组织中自噬体的丰度并不能反映自噬通量(因为自噬体由自噬物的隔离和溶酶体水解酶的清除失败产生),需要特定的定量方案来捕捉这一过程的动态变化。因此,在果蝇、小鼠和大鼠中使用优化的自噬通量评估方法的研究已清晰地证明自噬在衰老的心脏和衰老的血管系统中逐渐减弱。
一些导致自噬减退的年龄相关机制包括自噬蛋白的抑制性超乙酰化,与老年心血管系统中Sirtuin去乙酰化酶及其必需底物NAD+活性的降低有关。自噬抑制也可能因营养物质供应增加,导致乙酰辅酶A的过量,进而引发蛋白乙酰化和胰岛素-IGF1-丝氨酸/苏氨酸蛋白激酶 mTOR 信号通路的过度激活,尤其是在(内脏)肥胖和代谢综合征的情况下。改变的钙信号也被认为能调节心血管衰老过程中的自噬,至少在内皮细胞和心肌细胞中存在这种作用。另外,与年龄相关的多胺亚精胺水平下降可能会损害自噬蛋白的鸟嘌呤依赖性翻译过程。实际上,人类心脏中亚精胺含量随年龄递减(见图3),而在老年小鼠中,其外源性补充可重新激活心脏和血管中的自噬。
值得关注的是,心肌细胞、血管平滑肌细胞或内皮细胞中自噬基因的抑制会影响心血管衰老的表型(见表1)。例如,心肌细胞特异性的自噬基因Atg5缺失会导致肌节结构破坏、兴奋-收缩耦合受损、线粒体功能失调和氧化应激增加。这些变化与左心室功能不全、心脏加速肥厚、耐受能力降低和心肺功能早期损害有关。在血管平滑肌细胞中,Atg7的敲除会损害钙离子动员和心肌收缩,加速衰老,并加剧饮食诱导的动脉粥样硬化。即使内皮细胞有较高的增殖潜力,自噬缺陷也可能影响其功能。例如,血管内皮特异性Atg5和Atg7清除小鼠在静息状态下没有明显异常,但由于凝血功能障碍,血管性血友病因子的合成和分泌受损。同样,内皮细胞特异性敲除编码自噬转录激活因子Krüppel样因子4 (Krüppel-like factor 4,Klf4)的基因会导致早发性内皮功能障碍,表现为体内乙酰胆碱诱导的血管舒张能力下降。总之,自噬损伤影响心血管系统各种细胞类型,导致结构和功能异常,与心血管衰老紧密相关。
相反地,导致自噬激活的遗传、饮食或药物干预可有效延缓心血管衰老并延长寿命(详见表2)。例如,Beclin1基因(Becn1F121A/F121A)突变小鼠中,广泛的自噬激活减缓了与年龄相关的心脏异常,包括心肌纤维化、肥大和细胞凋亡,并伴有寿命的延长。同样,在内皮细胞中通过Klp4转基因介导的自噬激活减轻了与年龄相关的血管功能障碍。热量限制是最有效的自噬诱导干预措施,也可以延缓心血管衰老的典型特征,如舒张功能障碍、心脏纤维化和肥厚、高血压、血管僵硬和全身炎症。同样,在小鼠和大鼠中,天然多胺和自噬诱导剂亚精胺可在心脏和血管的衰老过程中发挥保护作用,如减轻心肌增厚、僵硬和舒张功能障碍、改善血管内皮功能障碍、调节血压、减缓动脉硬化、改善心室-血管耦合并减少慢性低度炎症。鉴于补充亚精胺对Atg5缺陷小鼠未能发挥心脏保护作用,亚精胺的保护作用很大程度上可能依赖于自噬。其他促进自噬的化合物,例如雷帕霉素和海藻糖,也对心脏和血管系统起到抗衰老作用,这一点支持了自噬功能受损是心血管衰老的一个可靠标志的观点(详见表2)。
框1 与年龄相关的心血管系统结构和功能衰退
衰老与左心室壁增厚、纤维化以及心肌僵硬增加相关联,导致舒张功能显著下降。年龄相关的心血管功能下降表现在其他方面,包括 β-肾上腺素能反应性和心脏储备能力降低(即最大射血分数、心率和心输出量降低)。衰老还引起了血管系统的结构和功能变化,导致导管动脉壁增厚、管腔增大,伴随着内膜增厚、内侧胶原沉积和弹性蛋白破裂。这些变化导致了血管硬化和血流受损,同时伴随着年龄相关的内皮功能障碍和微循环异常(例如血管生成和毛细血管密度的减少,即微血管稀疏),这些因素加剧了血管硬化和血流损害。值得注意的是,老年人血管系统中的这些结构和功能变化加速了心脏的重构,最终破坏了维持最佳心血管功能所需的心脏和血管系统之间的协调性,从而大幅增加了老年人心血管疾病的风险。心血管衰老和微血管结构与功能的衰退也会加剧其他器官(例如脑、肾、骨骼肌和眼睛)与年龄相关的衰退,进而增加了因生理活动受到干扰(例如组织氧合、代谢废物处理、营养物质、激素、生长因子和代谢物的输送等)而导致全身慢性疾病的风险。

图1 衰老对心血管系统细胞组成的影响
a,1-3个月、18-21个月和24-30个月的小鼠心脏和主动脉中各种细胞类型的比例。上述数值是使用Tabula Muris Senis(小鼠衰老细胞图谱)中公布的单细胞流式分析法得出的。b,人类心脏的细胞组成随着年龄的增长而变化。数值为每组的7-10个供体心脏在11-39岁、44-60岁或61-75岁时接受单核RNA测序分析的平均值。值得注意的是,这些数值只显示了每个物种的年龄变化,由于年龄、组织(小鼠的心脏和主动脉与人类的心脏)和应用技术(小鼠和人类分别为单细胞和单核RNA测序)的不同,无法在小鼠和人类之间直接比较。如果用不同的技术(如荧光激活细胞分选)测量,同一物种内特定细胞类型的确切比例也可能不同。对这些技术的发现和局限性的讨论见框2。
标志2:蛋白稳态的丧失
蛋白质稳态是维持机体健康和抗压能力的主要支柱。分子伴侣和蛋白质分解酶网络细致地调节着蛋白质合成、折叠和降解之间微妙的平衡。蛋白质组的完整性通过重新折叠变性蛋白质或有选择性地降解蛋白质来维持。因此,当热休克蛋白(Heat shock proteins, HSPs)和其他分子伴侣无法将蛋白质正确地重新折叠时,功能失调的蛋白质必须经由泛素-蛋白酶体系统(UPS)或伴侣介导的自噬(Chaperone-mediated autophagy, CMA)清除。CMA是一种选择性的蛋白质降解方式,其中热休克同源的71 kDa蛋白与指定要降解的特定蛋白质的KFERQ序列结合,促进它们通过溶酶体相关的膜糖蛋白2A(Lysosome-associated membrane glycoprotein 2A,LAMP2A)受体进入溶酶体。随着年龄的增长,蛋白质稳态网络的效率下降,导致错误折叠和损坏的蛋白质的积累,这些蛋白质会聚集形成无功能的蛋白质聚集物。虽然有毒蛋白质聚集在神经退行性疾病中表现最为明显,但在与年龄有关的广泛心血管疾病中也显著存在,包括动脉粥样硬化、心房颤动和心力衰竭,以及肥大性、缺血性和扩张性心肌病。
与年龄有关的蛋白稳定的丧失对心肌细胞存在健康威胁,因为它们的功能单位肌节依靠蛋白稳定来维持。然而,具有蛋白毒性的活性氧(ROS)往往会影响心肌细胞,这些活性氧是强烈氧化磷酸化的副产品。老年大鼠的心脏已被证明积累了氧化和泛素化的蛋白质,这与蛋白酶体活性降低和几种HSPs的表达水平相关。同样,老年小鼠心脏的蛋白质泛素化水平升高,与蛋白质聚集的积累相吻合。在血管中,CMA显然随着年龄的增长而下降,这表现在编码CMA相关蛋白的基因表达量低,以及高龄健康人的主动脉中CMA活性低。单细胞人类转录组图谱(Tabula Sapiens)表明,CMA相关基因的表达主要在主动脉巨噬细胞和平滑肌细胞中随年龄增长而减少。老年人(平均年龄72岁)的颈动脉斑块中泛素水平的增加和蛋白酶体活性的减弱进一步表明了与年龄有关的蛋白稳定的丧失。同样,老年大鼠主动脉的HSP70的基础表达水平和应激诱导的激活减少,有报道表明来自老年小鼠和年龄大于50岁的人类的主动脉组织大多数都积累了medin淀粉样蛋白的聚集物。值得注意的是,血管medin聚集物与老年小鼠的脑血管功能障碍和血管性痴呆或阿尔茨海默病患者的认知能力下降有关。
研究揭示了蛋白质不稳定与心血管衰老中的因果关系,在这些研究中,通过诱导(或防止)心血管系统中蛋白稳态的失调来加重(或延迟)心血管的衰老(表1)。例如,能够与错误折叠的蛋白质结合以防止其聚集的分子伴侣和小型HSP αB-结晶素(CryAB)发生错义突变,导致年轻小鼠的肌腱线蛋白错误定位、蛋白质聚集,心脏重塑和心脏衰竭,再现了人类肌腱线蛋白相关的心肌病。根据这些发现,心脏肌腱线蛋白的积累发生在早衰的Lmna-/-小鼠身上,从而损害了心脏传导,导致进行性扩张型心肌病,这可以通过心脏特异性过表达Cryab或在体外通过SUMO结合酶UBC9诱导激活UPS而得到治疗。另一个心脏蛋白毒性的例子是小鼠表达心脏特异性基因,其编码具有83个谷氨酰胺重复序列的易聚集蛋白(PQ83),导致心脏功能障碍和扩张,随后导致死亡。同样,敲除E2泛素结合酶会损害UPS,导致果蝇的心脏过早老化和功能障碍。相比之下,使用替普瑞酮对HSP70进行药物诱导,可以减少心肌蛋白的聚集,改善Cryab突变型小鼠的心脏功能和生存能力。替普瑞酮还能改善野生型大鼠心脏缺血再灌注损伤的功能恢复。同样,在主要影响男性的晚发性淀粉样心肌病患者中,使用模拟分子伴侣的药物Tafamidis可以提高生活质量,减少主要影响男性的迟发型淀粉样心肌病患者的心血管住院率和死亡率。在血管中,阻断LAMP2A缺陷小鼠的CMA会促进动脉粥样硬化斑块的形成,因为它促进血脂异常、血管平滑肌细胞去分化和促炎性巨噬细胞表型的表达。相反,在过量表达人LAMP2A的小鼠中,CMA的系统性激活减轻了动脉粥样硬化的严重程度。在老年小鼠中,淀粉样蛋白的前体Lactadherin(也叫乳脂球-Egf因子8,由Mfge8编码)表达水平降低可以逆转与年龄有关的脑血管功能障碍。值得注意的是,卡路里限制对减缓心血管衰老的有利影响也与改善蛋白质稳定有关,这一点在啮齿动物和人类的心脏和骨骼肌中已被报道,与HSP70和几个参与蛋白质折叠基因的上调有关。综上所述,蛋白稳态失调与年龄相关的心血管衰退有关,并表明维持蛋白稳态的遗传、饮食或药物策略可以延缓心血管的衰老(表2)。
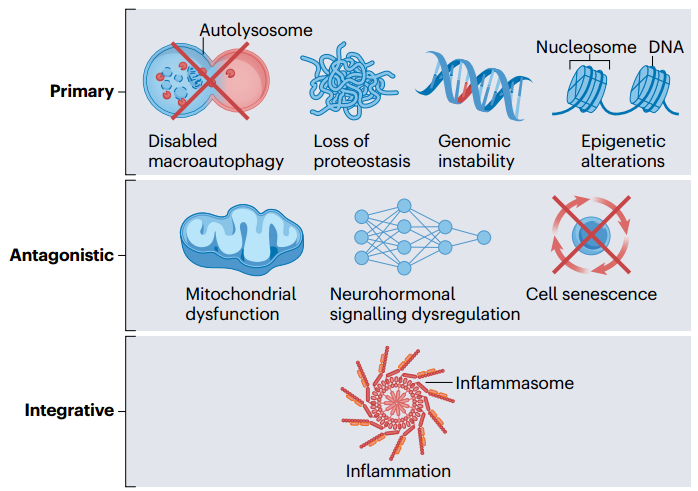
图2 心血管衰老的标志
心血管系统衰老的8个拟议标志及其假定的层次结构。主要的“标志”"随着年龄的增长而逐步推进,是基因组、表观基因组、蛋白质组和细胞器退化的基础。“对抗性"标志反映了对损害的(不良)适应性反应,而综合标志最终导致了心血管疾病的表现。
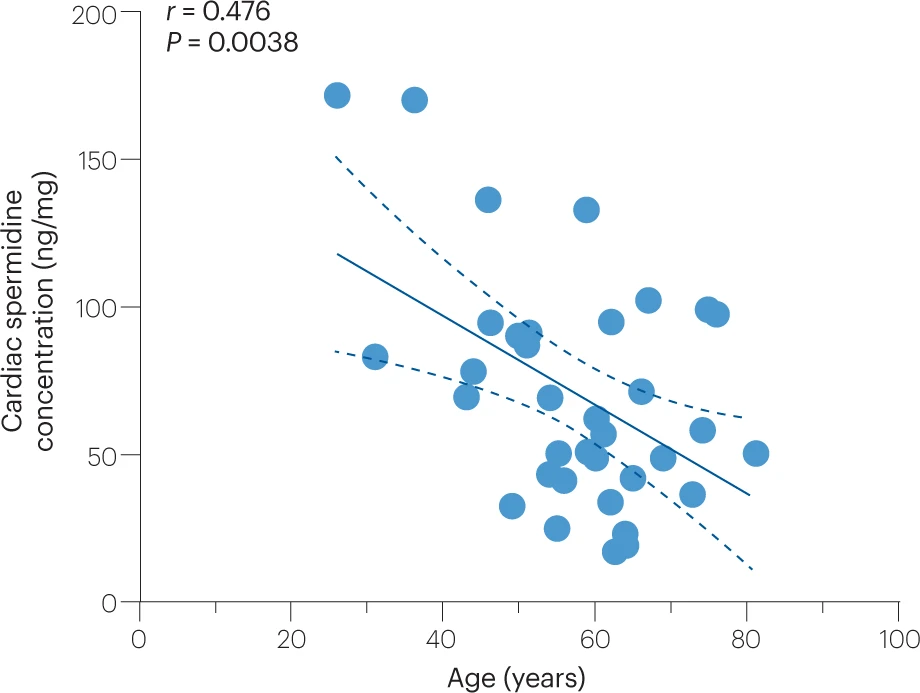
图 3 人类心脏亚精胺水平随年龄下降的情况
调节许多细胞过程的心脏亚精胺的浓度随着年龄的增长而下降。在人类捐献者的左心室样本和切除的男性和女性的衰竭心脏(n = 35)中测量了亚精胺的浓度。标明了皮尔逊相关系数(r)和P值,以及相应的线性回归线(实线)和95%置信区间(虚线)。涉及这些样本的程序得到了格拉茨医科大学伦理委员会的批准,并按照《赫尔辛基宣言》中概述的原则进行。
标志3:基因组不稳定性
当基因组不稳定性成为不同器官和物种衰老的共同特征时,不同组织之间突变积累的速度显著不同。在心血管系统中,与年龄有关的突变似乎主要受组织和环境的影响。在小鼠心脏中,基因组和转录组在2岁之前保持稳定,但在此后,心脏功能和结构的衰退在细胞(框2)和整个器官(框1)层面变得显著。转基因(LacZ)小鼠,尤其是在老龄小鼠(33个月),显示出以基因组重排为形式的心脏突变,但这种基因组重排可能并非心脏基因组突变的原因,而是心脏衰老的其他特征的结果。因此,与其他具有增殖能力的器官(如肝脏和小肠)不同,心脏或许具有更高的容忍度来处理与年龄有关的DNA突变。在相同的背景下,人类和小鼠心脏是否在出生后的早期生命阶段经历染色体端粒的缩短引发了争议。尽管遗传诱导的端粒缩短会加速小鼠心脏衰老(见表1),而端粒延长则可降低小鼠心血管疾病风险,但与年龄相关的端粒缩短似乎不是人类心脏疾病的关键因素。
表 1 遗传增强的啮齿类动物的心血管衰老标志

ACE8/8,心脏特异性Ace过表达小鼠;TGR(mREN2)27,表达小鼠Ren2的转基因大鼠;VSMC,血管平滑肌细胞。
DNA稳定性和血管衰老之间的关系争议较少,衰老似乎在血管内皮细胞中比在平滑肌细胞中造成更大的DNA损伤和端粒功能障碍。人类动脉粥样硬化斑块中也有DNA损伤的报道。此外,血管平滑肌细胞DNA损伤的小鼠显示出较低的动脉粥样硬化斑块稳定性,但这对斑块大小的影响可忽略不计。此外,在人类和小鼠的研究中,DNA损伤与颈动脉和脑动脉加速衰老有关,端粒损耗和细胞衰老是这一现象的潜在机制。在突变体小鼠中对DNA完整性的破坏也诱发了血管衰老相关的表型。例如,Ercc1Δ/-小鼠的核苷酸切除修复缺陷导致内皮功能障碍,血管僵硬度增加,年轻小鼠(8-16周)血压升高。当Ercc1的突变局限于血管内皮细胞或平滑肌细胞时,这种表型被部分重现。同样,纺锤体组装检查点蛋白BUBR1(也称为有丝分裂检查点丝氨酸/苏氨酸蛋白激酶BUB1β)表达水平低的突变小鼠在3-5个月大时,动脉僵硬度增加,动脉弹性降低,血管舒缩功能受损。值得注意的是,野生型老年小鼠的主动脉BUBR1表达量很低。目前仍需要进行全面和系统的基因组分析,以评估自然衰老小鼠和人类生命过程中的血管DNA损伤,以证实这些发现的相关性。这些研究也将有助于确定基因组不稳定在血管衰老中的确切作用,因为辐射诱导的DNA损伤的遗传模型既显示了系统性的异常,也显示了可能促进血管功能障碍的其他机制,而与DNA完整性无关。
值得注意的是,对心血管系统影响最大的年龄相关突变并不发生在心脏或血管中,而是在血液和骨髓中。根据检测阈值的不同,估计有10-40%的70-79岁的人的外周血细胞中携带体细胞突变。这些人的外周血细胞中有相当大的比例(平均约20%)可能来自一个单一的突变干细胞。这些突变的携带者有患血液学恶性肿瘤的风险,但他们大多数是老年人,其他一部分是健康人。因此,人们创造了"不确定潜能的克隆性造血"(Clonal haematopoiesis of indeterminate potential, CHIP;即在没有重大血液学异常的人的血液中存在体细胞突变)一词来描述这种情况。CHIP体细胞突变中的关键是那些影响编码转录调节器DNA(胞嘧啶-5)-甲基转移酶3A(DNMT3A)、甲基胞嘧啶二氧酶TET2(TET2)、多瘤组蛋白ASXL1(ASXL1)和酪氨酸-蛋白激酶JAK2(JAK2)的基因。流行病学研究显示,这些突变的携带者患冠心病、冠状动脉钙化、心肌梗塞和缺血性心力衰竭的风险增加。事实上,与CHIP相关的心血管疾病的风险与传统的危险因素,包括高血压、吸烟和血浆总胆固醇水平升高所带来的风险相似。此外,越来越多的证据表明,中心性肥胖和代谢综合征相关的心血管风险与骨髓造血功能增强和循环白细胞数量高,可能会加剧CHIP以及免疫细胞在心脏和血管中的积聚,从而助长慢性炎症。
实验研究表明,CHIP体细胞突变在小鼠模型中促进动脉粥样硬化、病理性心脏重塑和功能障碍以及心力衰竭。从机制上讲,CHIP对心血管的不利影响与炎症有关,因为CHIP体细胞突变的人类和小鼠携带者的免疫细胞都有促炎症的表型。相比之下,在没有IL-6信号的情况下,CHIP患者几乎没有心血管风险,而抑制NACHT、LRR和含PYD结构域蛋白3(NLRP3)炎性体-IL-1β轴可防止骨髓Tet2缺陷的小鼠出现动脉粥样硬化和心脏功能障碍。值得注意的是,TET2在老年小鼠和人类骨髓细胞中的水平下降,加剧了促炎性肿瘤坏死因子(TNF)的信号传导,但Tet2-/-小鼠没有显示出心脏加速衰老的迹象。这些小鼠在7-10个月时自发地出现一种和人类的肺动脉高压相似的表型,在用针对IL-1β的抗体进行抗炎治疗后,这种表型会消退。
综上所述,CHIP的体细胞突变可能导致了与年龄相关的心血管健康恶化。靶向这些突变的克隆或其下游的促炎症信号以减弱老年人残留的心血管风险,可能是一个有效的策略(在标志8进一步讨论)。然而,心血管细胞的基因组不稳定性是否能构成延缓衰老的干预靶标尚未明确。
表 2 延长心血管健康寿命的靶向衰老标志的干预措施
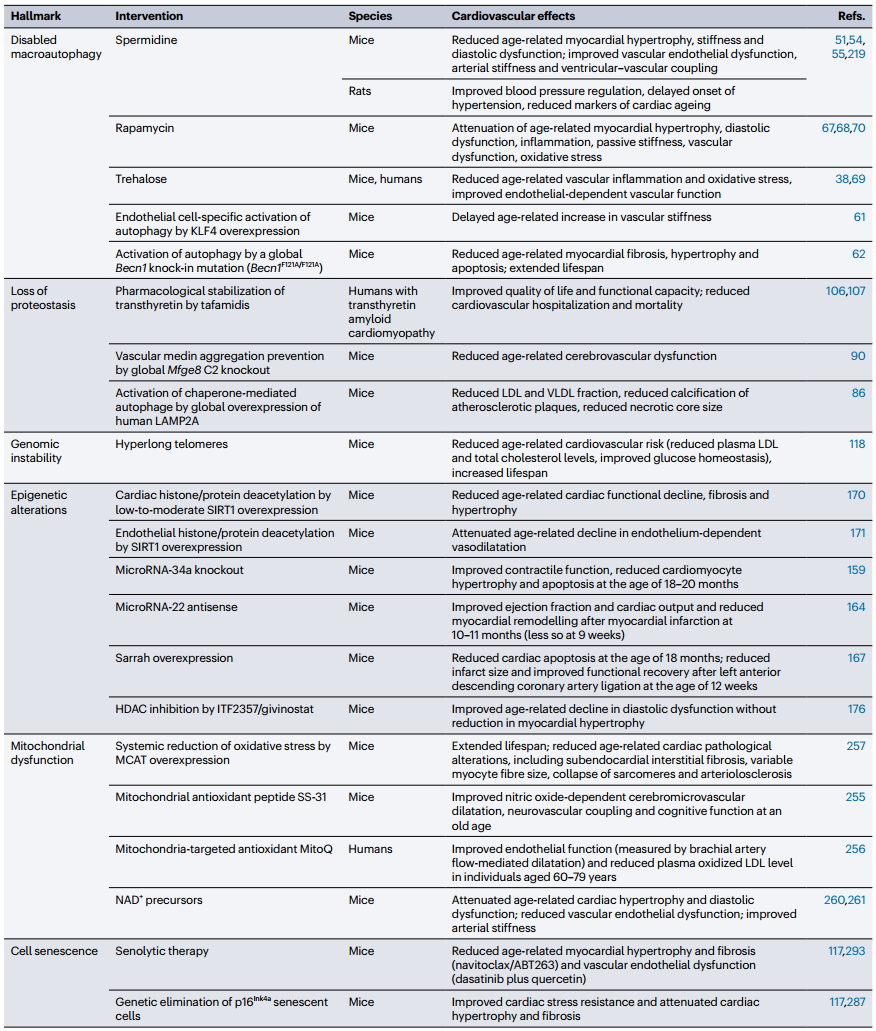
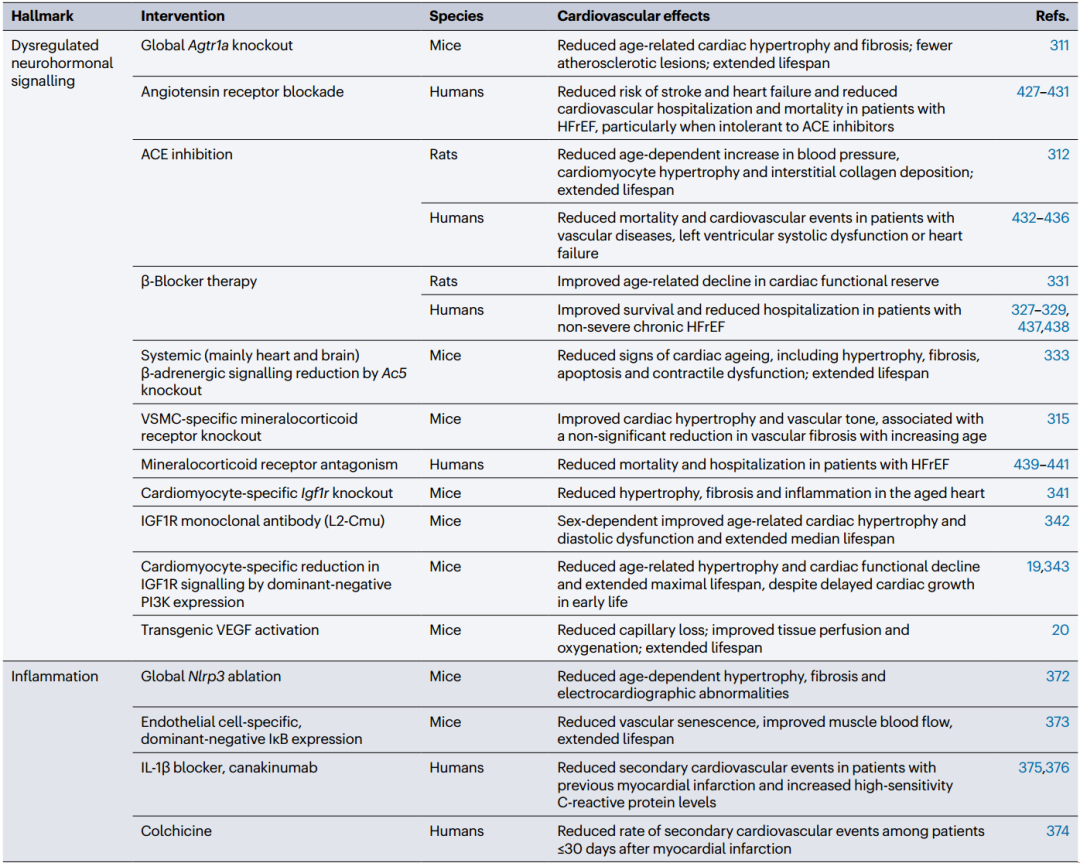
ACE,血管紧张素转换酶;HDAC,组蛋白去乙酰化酶;HFrEF,射血分数降低的心力衰竭;IGF1R,胰岛素样生长因子1受体;KLF4, Krüppel-like因子4;LAMP2A,溶酶体相关膜糖蛋白2A;MCAT,线粒体靶向过氧化氢酶;Mfge8 C2, Mfge8的C2结构域;PI3K,磷脂酰肌醇3-激酶;SIRT1, sirtuin 1;VEGF,血管内皮生长因子;VSMC,血管平滑肌细胞。
框2 心血管系统细胞组成中与年龄有关的改变
已有多种技术被应用来辨识不同器官和组织在年龄增长过程中细胞组成的变化(见图1)。单细胞转录组学作为最先进的技术之一,已经成功揭示了衰老心血管系统细胞组成的变化。例如,针对不同年龄阶段的心脏样本进行的单核RNA测序分析显示,在老年人心脏中,髓系细胞数量增多,而心肌细胞数量则相应减少。在小鼠的心脏和主动脉中进行的单细胞RNA测序显示,随着年龄的增长,心肌细胞的数量也有相似的下降趋势,同时白细胞总数也在增加。
令人意外的是,尽管老年心血管系统出现了更严重的纤维化和硬化(见框1),但人类心脏中成纤维细胞的比例并未随着年龄增长而上升,而小鼠心血管系统的成纤维细胞比例则随年龄减少。这一发现表明,衰老可能不仅会损害正常成纤维细胞的功能,还可能降低它们的再生能力,这或许有助于解释清除老化成纤维细胞的负面影响。然而,需谨记,单细胞数据受到技术限制,包括细胞分离、检测和鉴定策略的限制,这些因素需要慎重考虑。进一步的研究需要更大规模的样本和未来概念与技术的进步,以提升我们对心血管系统细胞组成和年龄相关变化的理解。
标志4:表观遗传的改变
除了DNA突变的影响,心血管系统中的基因表达水平还受到多种表观遗传因素的影响,包括DNA甲基化、组蛋白修饰和非编码RNA(ncRNAs)。这些表观遗传改变集中在与衰老相关的基因转录变化上,这些变化与病理过程有关,如蛋白稳态的丧失、线粒体功能障碍和炎症。即使基因组不稳定性导致心血管衰老存在争议(参见标志 3),年龄增长也会导致基因表达出现明显异质性,这表明表观遗传改变可能与心血管衰老有关。
非编码RNA(ncRNAs)
ncRNAs已成为心血管医学中高度相关的表观遗传因子。事实上,各种各样的ncRNAs亚家族,包括环状RNAs、微RNAs(miRNAs)和长链非编码RNAs(lncRNAs),都与衰老和自噬功能障碍有关,这些都是心血管衰老的标志。例如,circFOXO3,一种由编码叉头蛋白O3转录因子(Foxo3或FOXO3)的基因生成的环状RNA,在老年小鼠和人类的心脏中高表达。在阿霉素诱导的心肌病小鼠模型中,编码circFOXO3的质粒会加速心脏衰老并加剧心肌收缩功能的恶化,而靶向内源性circFOXO3的小干扰RNA具有类似选择性消除衰老细胞药物功能,对心脏起到保护作用。
一些miRNAs的心脏表达谱随年龄的变化而改变。miRNA-34a在老龄小鼠和人类的心肌中高度表达,加剧了衰老和DNA损伤。相比之下,miRNA-34a敲除的小鼠心脏衰老相关表型恢复,其特征是心肌细胞肥大和凋亡减少以及心脏功能改善。值得注意的是,miRNA-34a在老年小鼠主动脉中也上调了,在体外抑制miRNA-34a可以延缓血管平滑肌细胞的衰老,同时在活体中改善冠状动脉阻塞的心脏恢复能力。miRNA-34a基因敲除小鼠也减少了毒性剂量维生素D诱导的血管钙化。小鼠和人类的miRNA-22心脏表达水平也有年龄依赖性的增加,这是一种具有促肥厚和自噬抑制作用的ncRNA。与此相一致的是在体外抑制miRNA-22能够促进心肌细胞自噬,而在体内能够减少心肌梗死后结构和功能的衰退,特别是在老年小鼠中。
尽管lncRNAs是重要的转录调节因子还是转录噪声仍存在争议,但lncRNA Sarrah在老年小鼠心脏和缺血性心肌病及射血分数保留性心衰(Heart failure with preserved ejection fraction, HFpEF)的啮齿动物模型中下调。相反,在年轻小鼠中Sarrah过表达可改善心肌细胞存活、内皮细胞增殖和心肌缺血后功能恢复。Sarrah过表达也能减少老龄小鼠的心肌细胞凋亡;然而,这种效果是否对老年心脏或血管系统提供保护仍有待确定。
组蛋白修饰
组蛋白后修饰在表观遗传调控中扮演着重要角色。举例来说,组蛋白的赖氨酸乙酰化能够改变染色质结构,从而调控基因的转录活性。在心血管系统中,NAD+依赖的蛋白去乙酰化酶Sirtuin1(SIRT1)在小鼠和人类心脏衰竭中的表达水平下降。值得注意的是,适度恢复SIRT1的表达能够延缓心脏衰老,通过增强心脏的应激抵抗力、减少衰老标志物以及抑制年龄相关的不良心肌结构来实现。类似地,在内皮细胞中过表达Sirt1的转基因小鼠能够减缓衰老导致的血管舒张反应下降。
相反地,全身或内皮细胞特异性敲除另一种核组蛋白去乙酰化酶Sirtuin6(SIRT6)会导致早期血管功能障碍,而血管平滑肌细胞中SIRT6表达的减少与小鼠慢性肾病和人类血管钙化风险增加有关。SIRT6缺陷小鼠还显示出早衰型心脏表型,表现为心肌肥厚和退行性改变,但SIRT6过表达可以预防横主动脉狭窄或异丙肾上腺素注射导致的心肌肥厚。
组蛋白去乙酰化酶(HDAC)家族成员,如HDAC1、HDAC2、HDAC3、HDAC5、HDAC7或HDAC9,在心肌细胞的发育、成熟和生长中扮演重要角色。通过药物抑制HDACs可以改善老年小鼠和猫科动物早期舒张功能不全(心脏衰老的关键标志)。但需要进一步确定组蛋白乙酰化变化是否以及在何种程度上介导了泛HDAC抑制剂对心脏的益处。这个问题尤为重要,因为在心血管稳态和病理中观察到各种HDAC亚型表达增加或减少的作用,有时呈相反的趋势。举例来说,HDAC6缺陷小鼠对肺动脉高压和应激性收缩功能障碍的易感性降低,展现出早期舒张功能障碍,并随着年龄增长而逐步加剧。同样,敲除Hdac9的相关小鼠可以预防血管钙化,但会加重病理性肥大。因此,以细胞类型特异性的方式选择性靶向HDAC亚型可能是降低不良和脱靶效应的有效策略。
大量研究表明,至少在幼儿时期,组蛋白甲基化在心脏稳态中起着重要作用。在临床前实验的基础上,靶向组蛋白甲基化已经被认为是治疗动脉粥样硬化和肥厚性心肌病的潜在治疗方法。尽管如此,还需要进一步的研究来确定心血管系统在衰老中是否存在发生变化的且可靶向的组蛋白甲基化。
DNA甲基化
尽管DNA甲基化模式被越来越多地用于评估心血管衰老的速率,但DNA甲基化改变对心血管疾病的影响仍存在争议。例如,尽管衰老后心脏DNA甲基化发生了改变,但与血液和其它组织相比,人类心脏样本DNA甲基化的测量结果将实际年龄低估了10岁。这一发现表明,人类心脏可能对与衰老相关的DNA甲基化改变具有抵抗力。相比之下,参与DNA甲基化维持的DNA(胞嘧啶-5)-甲基转移酶1 (DNMT1)在心脏中的表达水平呈年龄依赖性下降。然而,在12月龄之前,成年小鼠心脏中敲除Dnmt1并没有导致任何明显的不良后果,并且在心脏毒性模型中意外地产生了心脏保护作用。其他DNA甲基转移酶的作用,如DNMT3A和DNMT3B,它们是DNA从头甲基化所必需的,也仍然存在争议。尽管DNMT3A和DNMT3B的水平在心力衰竭的人群中上调,但来自条件型心肌细胞缺失DNMT3A和/或DNMT3B小鼠的研究显示,DNMT3A和/或DNMT3B既没有有害表型,也没有诱导严重的心肌病。尽管已知胚胎期DNA甲基转移酶的敲除会导致心脏异常和其他发育缺陷引起的过早死亡,但在成年期调节心脏DNA甲基化的作用目前尚不清楚,更何况在衰老之后的作用。
在血管DNA甲基化方面,在衰老和动脉粥样硬化血管中也有相反的观察结果。尽管衰老与动脉粥样硬化密切相关,但衰老与整体血管DNA低甲基化相关,而动脉粥样硬化血管似乎表现为局部DNA高甲基化,动脉粥样硬化病变甚至可以通过药物抑制DNMT1来减轻。因此,需要进一步的研究来阐明血管DNA甲基化减少在自然衰老中的重要性和机制。
标志5:线粒体功能障碍
线粒体功能障碍是衰老和与衰老相关的慢性疾病的一个关键特征,特别是在严重依赖线粒体代谢和信号传导的心血管系统中。它们除了在心肌能量学中的功能外,线粒体还在细胞钙稳态、氧化还原平衡、合成代谢和分解代谢反应中起着作用,在心血管系统中几乎所有细胞类型的炎症和致死信号的启动中也起到至关重要的作用。因此,与衰老相关的线粒体功能障碍首先影响心血管系统。事实上,线粒体功能障碍可以说是广泛的心血管疾病中最关键的病因之一。
在心脏中,衰老与线粒体含量的大幅下降有关。此外,衰老的心脏线粒体结构和功能受损,表现为直径增加(肿胀)、基质变形、嵴丢失和氧化磷酸化降低,这是由于线粒体呼吸链复合物(特别是复合物IV)活性和稳定性降低。虽然这些异常可能主要影响纤维间线粒体(即位于肌原纤维之间的线粒体),但心脏也会代谢严重受损。因此,衰老的人类和小鼠心脏的特点是代谢调节能力有限,更多地依赖于糖酵解而不是脂肪酸氧化。
考虑到血管内皮细胞和平滑肌细胞的线粒体生物发生受损,加上线粒体质量降低和呼吸的减少,年老的血管中线粒体缺陷也很明显。血管衰老还与线粒体活性氧产生的增加有关,降低一氧化氮的生物利用度,从而损害内皮依赖性血管舒张。此外,转录调节核因子红细胞2相关因子2 (Nuclear factor erythroid 2-related factor 2,NRF2)抗氧化活性的抑制使衰老的血管细胞特别容易受到ROS诱导的损伤。事实上,NRF2缺陷小鼠具有血管衰老加速的表型,同时对血管衰老和脑血管功能异常的易感性增加。线粒体ROS的过度产生可能会增加线粒体DNA (mtDNA)的突变和缺失率,甚至导致mtDNA的释放,从而激活促炎信号通路。因此,ROS导致NF-κB的激活,而胞质mtDNA触发DNA传感器循环GMP-AMP合成酶(cyclic GMP–AMP synthase,cGAS)和随后的循环GMP-AMP干扰素基因受体刺激蛋白(STING)启动I型干扰素应答。这些促炎途径驱动衰老相关的内皮功能障碍。支持这一假设的是,衰老的血管显示出线粒体功能障碍和IL-6之间的正反馈回路,IL-6加剧了小鼠高脂血症诱导的动脉粥样硬化。另一个解释线粒体功能障碍的相关特征是关键代谢辅助因子水平的下降,特别是NAD+,这可能会导致心脏和血管衰老。
衰老伴随的线粒体自噬缺失能够引起的线粒体质量控制降低,而这一现象可能解释功能失调的细胞器积累和心血管稳态的下降。支持这一观点的是,线粒体丝氨酸/苏氨酸蛋白激酶PINK1(也被称为PTEN诱导假定激酶1)缺失的小鼠,由于线粒体自噬受损,功能障碍的线粒体随衰老不断积累,从而在早期出现心肌肥厚和收缩功能障碍等症状。同样,心肌细胞中过氧化物酶体增殖物激活受体-γ共激活因子-α(PGC1A)的过表达增加了线粒体的生物合成,尽管在初期能够改善心脏健康,但加速了心脏衰老和缩短了寿命。这些转基因小鼠心脏衰老表型的加重,至少部分归因于受损线粒体的积累,这是由于过载的线粒体吞噬机制对新产生的细胞器质量控制能力下降。类似地,心肌细胞线粒体动力学(即融合和分裂)的消除显著地损害了线粒体吞噬功能,这与Mfn1-Mfn2-Drp1三敲除小鼠线粒体加速衰老和心脏衰老的早期迹象相一致。类似地,Prkaa敲除小鼠的内皮细胞自噬缺陷与线粒体碎片和血管内皮功能障碍相关,可以通过Atg7过表达或体内给予mTOR依赖性自噬诱导物雷帕霉素来干预。相比之下,亚精胺对老年小鼠和大鼠心脏的保护作用与诱导线粒体吞噬从而改善线粒体结构和功能有关。
在小鼠模型中,线粒体稳态的系统性破坏会导致心血管衰老。例如,在核编码的聚合酶-γ催化亚基(Polga)敲入突变,会导致mtDNA聚合酶校对缺陷,并产生更多的mtDNA点突变和缺失,以及增加ROS的产生。这些mtDNA突变小鼠的寿命缩短,心肌衰老、纤维化、肥厚和扩张加速,左心室收缩和舒张功能障碍。此外,这些小鼠表现出血管早期硬化、血管顺应性降低和动脉粥样硬化增加。值得注意的是,在mtDNA突变小鼠中过表达过氧化氢酶或补充线粒体靶向抗氧化剂SkQ1可延缓部分心血管衰老表型。线粒体缺陷导致心脏衰老的另一个例子是心肌细胞中缺乏丙酮酸载体亚基1或亚基2的小鼠会产生心脏肥大、异常收缩和过早死亡等现象。即使是在很大程度上依赖糖酵解而不是氧化磷酸化来产生能量的血管内皮细胞,在呼吸链复合物或线粒体丙酮酸载体被药物抑制后,也失去了对血管张力的体外控制。此外,条件性缺失线粒体肉碱O-棕榈酰转移酶2,会在体内破坏内皮脂肪酸氧化,从而促进瓣膜疾病并增加器官的血管通透性。因此,诱导线粒体功能障碍会加速心血管衰老,增加年轻时心血管疾病的易感性。
重要的是,避免与衰老相关的线粒体功能障碍的干预措施已显示出心血管保护和延缓衰老的作用。例如,通过E3泛素蛋白连接酶 parkin 的转基因过表达在心肌细胞中诱导的线粒体自噬不仅维持了线粒体完整性和心脏功能,还减轻了老年小鼠的衰老和炎症迹象。线粒体靶向抗氧化剂,如甲磺酸米醌 (MitoQ) 和SS-31 (Elamipretide)可使衰老小鼠和人的血管氧化应激减轻,恢复内皮细胞的血管舒张功能。与此类似,线粒体中抗氧化过氧化氢酶的过表达可以延缓心脏衰老,延长小鼠的寿命。此外,过表达Twinkle mtDNA解旋酶能够降低Apoe−/−小鼠mtDNA损伤,通过增加纤维帽厚度和减少坏死病灶的形成,改善线粒体功能和动脉粥样硬化斑块的稳定性。同样,通过补充NAD+前体促进线粒体氧化代谢,在体外对小鼠和人类细胞发挥细胞保护作用,并在体内延缓心脏和血管衰老。因此,烟酰胺可抑制老年小鼠心肌肥厚和舒张功能不全。此外,在老年小鼠中,烟酰胺单核苷酸给药可减少衰老诱发的血管和(大脑)微血管内皮功能障碍,通过保持弹性蛋白含量和减少胶原积累避免动脉硬化,并增加大脑和骨骼肌血流量,从而改善神经血管耦合、认知表现和运动耐力能力。通过抑制NAD+的酶消耗来恢复NAD+的水平,同时也恢复了一些心血管功能。总而言之,这些发现表明线粒体是在临床前水平上预防或延缓心血管衰老的可行性措施,并尝试将这些发现实现临床转化。
标志6:细胞衰老
细胞衰老通常指细胞周期永久停滞,导致复制能力不可逆丧失和特定细胞功能降低,同时产生促炎特征。衰老不仅仅局限于增殖细胞类型,比如内皮细胞和成纤维细胞,还能影响心肌细胞。衰老是多种内外部应激源诱导的,包括端粒缩短、致癌信号、DNA持续损伤、氧化和机械应力、营养不平衡、线粒体功能障碍和病原感染。衰老细胞通过分泌一系列促炎和趋化因子、生长因子和基质蛋白酶,即衰老相关分泌表型(SASP),可引发其他非衰老细胞经历“继发性”(也称为“传染性”或“旁分泌”)衰老。但是,鉴别衰老细胞因缺乏特定生物标志物,尤其是在体内,依赖于多种参数,包括溶酶体衰老相关β-半乳糖苷酶活性和周期依赖性激酶抑制剂(如CDKN2A(p16)和CDKN1A(p21))的表达。尽管细胞衰老对于正常发育、伤口愈合和抑制肿瘤转化是必要的,但越来越多的证据表明,不受控制的衰老细胞积累,若未被充分免疫细胞清除,可能导致机体衰老和相关慢性疾病。
实际上,细胞衰老与多种心血管疾病相关,包括动脉粥样硬化、缺血性心肌病和HFpEF(心衰伴随保留收缩功能)。衰老细胞的积累已被证明在老年骨骼肌中降低再生潜能,但其在心肌中的作用尚待确认。由于其在血管内的位置,内皮细胞(包括大脑微循环中的细胞)直接暴露于诱导衰老的刺激下(包括生化和血液动力学因素)。与正常内皮细胞相比,衰老的内皮细胞在形态和附着基底膜能力上表现异常,以及与血流方向对齐的能力下降。功能上,衰老的内皮细胞与衰老相关的血管舒张功能障碍和血脑屏障完整性丧失有关。同样,衰老的心肌细胞具有不良适应的表型,包括肥大和促纤维化信号传导,可能导致心脏衰老的典型特征,如心肌壁增厚和僵硬。虽然端粒长度缩短不能解释心肌细胞衰老,但线粒体功能障碍和氧化应激可诱导不缩短的端粒损伤。成纤维细胞在伤口愈合中起作用,老化的成纤维细胞限制了小鼠横向主动脉缩窄模型中心肌纤维化。然而,这种现象是否与衰老引起的心肌纤维化有关,以及不同细胞的衰老对心血管生理功能的影响是有背景依赖性的尚不清楚。
实际上,特定类型的衰老细胞可能在不同情况下发挥不同的生理作用,如伤口愈合、抑制无菌炎症和维持肝脏血液组织屏障。消除这些细胞可能导致意料之外的结果。然而,在自然老化的小鼠中,清除衰老细胞可以延缓衰老并延长寿命。在这些动物的心血管系统中,消除衰老细胞通过遗传或药理手段减轻了心肌肥大和纤维化,并保持了心脏功能。在β-肾上腺素刺激下,清除表达p16Ink4a的细胞可改善心脏应激抵抗并减弱心肌重构。类似地,通过改善内皮依赖性血管舒张,长期清除衰老细胞治疗可以延缓血管衰老,并改善神经血管耦合和认知功能。相反,端粒脱帽或端粒缩短导致的加速衰老引发早发性心血管衰老表型,其特征为心肌过早肥大、纤维化、舒张功能障碍,以及血管氧化应激、内皮功能障碍和血压升高。这一发现可能与人群相关,因为在久坐的老年人中,衰老生物标志物的血管表达增加与血管内皮功能障碍相关性较高。此外,心糖苷的作用可能部分归因于其清除衰老细胞的能力。
总的来说,这些研究表明,心血管系统中衰老细胞的分泌和代谢活性可能影响心血管衰老的多个方面。因此,针对衰老细胞可能是减缓年龄相关心血管健康下滑的有效手段。
标志7:失调的神经激素信号
全身和局部神经激素信号传导的主要组成部分,包括肾素-血管紧张素-醛固酮系统 (Renin–angiotensin–aldosterone system,RAAS)、β-肾上腺素能信号传导和胰岛素-IGF1 信号传导,在衰老过程中长期激活,从而导致心血管系统失调。
肾素-血管紧张素-醛固酮系统
RAAS的激活与衰老伴随的心血管疾病密切相关,包括高血压、动脉粥样硬化、冠心病、房颤和心力衰竭。因此,血管紧张素转换酶(ACE)抑制剂、血管紧张素受体阻滞剂和盐皮质激素受体拮抗剂对RAAS的阻断被广泛应用于心血管疾病的治疗(表2)。饮食限制对心血管和肾脏风险的有益影响也与RAAS活性的抑制和血清血管紧张素II(经典RAAS的主要效应肽)水平降低有关。
尽管心肌在最初能够适应RAAS,但RAAS的激活会逐渐通过各种机制对心血管产生不良影响,包括钠稳态受损、血管张力和血容量调节失调、细胞生长和增殖异常、氧化应激、心血管系统的炎症和纤维化。在衰老但仍健康的小鼠中,已检测到肾素和血管紧张素II水平随年龄而增加。血管紧张素II mRNA和蛋白水平的表达也在老龄小鼠的心脏和血管系统中局部增加。血管紧张素II水平的升高伴随着血管中ACE、IV型胶原、纤维连接蛋白和转化生长因子-β (TGFβ)表达的增加,以及低剂量血管紧张素II引起的高血压风险。
这些研究表明RAAS过度激活与衰老相关,与其他心血管疾病不同,血管紧张素II对机体衰老相关途径(包括mTOR、sirtuin、klotho和5'-Amp激活的蛋白激酶信号)的影响,进一步支持了这一观点,表明RAAS激活可能促进心血管衰老。因此,在小鼠模型中,编码血管紧张素II受体1A型(AT1A; Agtr1a)的功能获得性突变会引起心肌纤维化和舒张功能不全,并伴有中度高血压。当RAAS主要在肾外组织被激活时,也会引起年轻大鼠高血压、心肌肥厚、心肌纤维化和舒张功能障碍等现象产生。此外,在小鼠中,盐皮质激素受体阻滞可以改善舒张功能障碍,并不会引起外周收缩压变化。进一步支持RAAS局部效应的是,在小鼠中,特别是在心脏中,ACE或血管紧张素II过表达后,尽管血压和肾功能接近正常,但仍可触发心房扩张、心律失常和心源性猝死。相反,通过药理或遗传学抑制RAAS信号可干预衰老引起的心血管改变。例如,血管紧张素II的抑制和AT1A失活可以延缓心血管衰退的发生,提高小鼠和大鼠的存活率。长期服用血管紧张素转换酶抑制剂依那普利可减轻老年正常血压小鼠的心血管重构、炎症和心衰。同样,血管平滑肌细胞中缺乏盐皮质激素受体的衰老小鼠没有发生心肌增厚,并改善了血管张力的调节。值得注意的是,由血管紧张素II介导的经典RAAS信号转导被非典型RAAS多肽(包括血管紧张素(1-7)、血管紧张素(1-9)和Alamandine及其受体)所抵消,这些多肽对心血管疾病具有保护作用。因此,尽管临床广泛使用RAAS抑制剂,但RAAS对心血管衰老的确切作用尚未完全阐明。
β-肾上腺素信号传导
衰老与血液中儿茶酚胺水平的增加有关,这会导致心脏β-肾上腺素受体的慢性刺激和随后的失活,心脏神经元的年龄依赖性磨损加剧了这种情况。事实上,人类和啮齿类动物中的老年个体都有心脏自主调节受损的情况,即β-肾上腺素脱敏,同时伴有心力储备减少和心力不耐受。同样,血液中的高浓度儿茶酚胺,β-肾上腺素反应性降低,以及对肾上腺素响应的普遍敏感性降低,都是人心力衰竭的典型症状。在这种情况下,β-肾上腺素信号的抑制可能被视为一种代偿机制,通过这种机制,心脏避免对高水平儿茶酚胺的过度反应。为了支持这一观点,在小鼠中过表达β-肾上腺素受体来激活β-肾上腺素信号可以在最初阶段改善心脏收缩力,但最终会加速心脏肥大和纤维化,导致致命的心脏代偿失调。相比之下,一些临床研究已经证明β受体阻滞剂可以改善心力衰竭患者的预后,降低射血分数(表2),它们还可以减缓动脉粥样硬化的进展。
有趣的是,β受体阻滞剂会改善而不是加剧机体内受损的β-肾上腺素信号,进而改善健康年老大鼠的心脏肌力储备。用各种β受体阻滞剂治疗也延长了小鼠的寿命中位数。同样,通过在小鼠中敲除Adcy5基因(AC5; 一种催化ATP合成cAMP的关键酶)使β-肾上腺素信号失活,可以防止与衰老相关的心脏肥大、收缩功能障碍、细胞凋亡和纤维化,从而延长寿命。Adcy5基因敲除的有益作用部分归因于超氧化物歧化酶的上调,超氧化物歧化酶通过减少线粒体ROS的产生来防止氧化应激。新出现的证据还表明,myc盒依赖相互作用蛋白1(也称为桥接整合子1 (BIN1)或Amphiphysin II)的上调可能导致心脏Ca2+通道的再循环和运输受损,进一步导致衰老过程中β-肾上腺素信号紊乱。与之对应的是,通过测量离体心肌细胞的钙通量发现Bin1的敲低改善了老年小鼠中心脏β-肾上腺素反应性。然而,抑制BIN1是否能恢复体内的肌力储备,并能否进一步靶向改善在不耐受β-阻断剂或β-阻断剂没有疗效的患者中与年龄相关的β-肾上腺素能信号紊乱尚不清楚。从本质上讲,β-肾上腺素信号调控仍然是老年人心血管风险管理的主要目标。
生长信号
尽管生长激素和IGF1水平随着年龄的增长而自然下降,但导致IGF1信号减少的突变与物种寿命延长有关。在这方面,IGF1信号对心脏健康的影响似乎是具有双重效应并且具有年龄依赖性。在心肌细胞中过表达IGF1受体(IGF1R)的年轻小鼠可以改善心脏功能和结构,而过表达心脏IGF1或IGF1R的老年小鼠则会加剧心脏衰老、过早心力衰竭和寿命缩短。在机制上,Igf1r过表达小鼠的心脏健康跨度缩短可归因于线粒体功能障碍相关的自噬功能障碍、氧化代谢减少和心肌生物能量受损。相比之下,心脏IGF1R的表达随着年龄的增长而自发增加,在小鼠中,IGF1R的基因敲除降低了与年龄相关的心脏肥大、纤维化和促炎细胞因子的水平。用IGF1R单克隆抗体治疗野生型小鼠可改善年龄依赖性心功能障碍并延长寿命,尽管仅适用于雌性动物。也就是说,在表达磷脂酰肌醇3-激酶(PI3K;也被称为磷酸肌肽3-激酶)的显性阴性p110α亚型的雄性小鼠中抑制心脏IGF1R信号传导可以延长最大寿命,减轻年龄相关的心脏衰退,尽管这会在生命早期延缓心脏生长。同样,用Alpelisib(一种PI3K的小分子抑制剂)处理的小鼠,尽管这对骨密度和血糖控制有不利影响,但在雄性动物中延长了寿命中位数和最长寿命,在雌性动物中则延长得更多。Alpelisib是否也能延缓心血管衰老还有待检验,因为研究中的小鼠没有在老年(即年龄超过18个月)时进行评估。
与年老小鼠的心脏一样,人类移植的衰竭心脏IGF1R表达升高。此外,心脏IGF1R mRNA在缺血性心脏病或HFpEF患者中高表达。然而,IGF1信号靶向减缓人类心脏衰老的结果目前尚不确定,因为在血液中IGF1的低和高水平都与心力衰竭和死亡风险增加有关。因此,需要进一步的人体研究来探索血液IGF1水平与心脏和其他组织中IGF1R信号激活之间的关系,以设计针对特定器官中IGF1-IGF1R系统的新型干预措施。
在血管系统中,健康老年人(平均年龄67.9岁)循环IGF1水平下降与脑血流量减少和神经血管耦合相关。患有类风湿关节炎的中年妇女(平均年龄52岁)血清IGF1的低水平与高血压和心血管事件风险增加有关。此外,在Ames侏儒和小鼠中,尽管寿命延长,但是IGF1水平的降低与年轻时血管僵硬和内皮功能障碍的增加有关。尽管这些观察结果表明,IGF1缺乏实际上促进了小鼠血管系统的过早衰老,但在人类中,IGF1的高低水平都与血管事件(心肌梗死和中风的组合)的风险升高有关。此外,在小鼠中,Igf1r的全身和内皮细胞特异性敲低至少在年轻时可以改善血管功能。尽管这些有益的作用有待在老年小鼠中得到证实,但在Apoe−/−小鼠中,内皮细胞Igf1r的下调会加剧动脉粥样硬化病变。因此,需要长期的研究——最好关注特定血管细胞类型中的IGF1R调控——来阐明IGF1信号传导不足和过度的潜在致病意义。值得注意的是,另一种营养因子,即VEGF,已被证明是健康的血管衰老所必需的。转基因过表达VEGF,可避免VEGF信号随年龄自然下降,减少内皮细胞衰老、炎症和线粒体功能障碍,促进各组织血液灌注,延长健康寿命。
标志8:炎症
衰老与慢性低度无菌性炎症(即衰老相关的炎症)相关。这种现象在动脉粥样硬化等心血管疾病中尤为明显。事实上,动脉粥样硬化是一种持续的炎性病变,涉及多种免疫细胞亚型和细胞因子,与血脂异常等危险因素相结合,这会造成血管重塑、斑块形成和血管破裂。炎症血液生物标志物可预测动脉粥样硬化及其心血管并发症的进展,而炎症过程显然会进一步推动指示疾病进展的次要事件。在衰老的心脏中,炎症和免疫细胞表型的改变也很明显。心肌浸润性免疫细胞的丰度、亚型组成、功能和激活状态随时间的变化而变化。例如,老年小鼠和人类心脏髓系细胞数量的增加超过了淋系细胞,这在女性中尤其明显。心肌T细胞亚群也随着年龄的增长而变化,转向更促炎的表型,如CD4+FOXP3-IFNγ+细胞的增加。分化的人CD4+ T细胞转移到年轻小鼠体内会引起心脏炎症转移,这种转移通常在老年小鼠身上观察到。同样,老年小鼠体内的T细胞转移到幼鼠体内,显示出心向性并诱导轻度功能障碍,而转移到新生小鼠体内的成年T细胞则会促进局部炎症并损害心脏再生能力。更显著的是,T细胞特异性缺乏线粒体转录因子A会促进慢性炎症并加速包括心血管系统在内的机体衰老,而这可以通过TNF中和来减轻。因此,影响T淋巴细胞的免疫衰老可加速心血管衰老。
通过在编码IκB激酶的基因中引入功能增强突变体,该基因激活NF-κΒ,会导致小鼠自发性心肌肥厚,同时伴随早发性心力衰竭和过早死亡。在心脏中过表达TNF的转基因小鼠也在年轻时期有肥厚型心肌病发病的迹象。相反,缺乏炎症小体成分NLRP3的小鼠则表现出寿命延长,心脏衰老延迟的现象,这与IGF1信号减少、自噬增加以及SIRT1和NAD+辅助酶烟酰胺磷酸核糖转移酶的上调相吻合。同样,在内皮细胞中表达IκB的显性失活形式也可以减少血管衰老并延长寿命。在心血管疾病患者中,通过使用秋水仙碱抑制NLPR3炎症小体或使用抗IL-1β抗体清除其主要细胞因子产物IL-1β来靶向炎症已被证明对心血管事件的二级预防(对已经发生冠心病和其它动脉粥样硬化性血管疾病的患者早发现、早诊断、早治疗)有效。在患有动脉粥样硬化的患者中,接受Canakinumab治疗的肺癌死亡率也有降低,尽管代价是发生致命感染的比率会增加。
除了动脉粥样硬化和相关冠状动脉疾病外,HFpEF(老年人中主要的心力衰竭形式)也被认为是一种炎症性的多器官综合征,主要由加速衰老驱动。支持这一观点的是,年龄较大的个体(平均年龄73.6岁)具有炎症生物标志物水平升高的风险显著高于那些具有正常炎症生物标志物水平的个体。值得注意的是,钠-葡萄糖协同转运体2(SGLT2)抑制剂的心脏保护作用——第一个对HFpEF具有治疗效果的药物类别——与减少炎症等其他抗衰老效应有关。在高脂饮食和去氧皮质酮喂养的老年小鼠中,β-羟基丁酸的给药可以通过直接作用于NLPR3炎症小体来抑制IL-1β成熟和促炎细胞因子诱导的线粒体功能障碍,从而预防HFpEF的发展。
从机制上讲,心血管“炎性衰老”与其他衰老标志密切相关,包括巨自噬功能受损(通过有害废物积累)、蛋白质稳态丧失(通过促炎和抗炎蛋白质之间的失衡)、基因组不稳定性(通过CHIP)、表观遗传改变(通过促进促炎基因转录)、线粒体功能障碍(通过过度ROS)和细胞衰老(通过SASP)。值得注意的是,天然cGAS-STING免疫途径感知细胞核DNA并促进下游干扰素依赖性炎性途径的作用对于细胞衰老和SASP发生至关重要。因此,在成纤维细胞、血管平滑肌细胞和心肌细胞中明显表现出转录共激活因子YAP-TAZ机械信号下降的衰老小鼠主动脉中,cGAS-STING诱导促进了细胞衰老。cGAS-STING信号在与年龄相关的内皮功能障碍、早衰小儿或青少年期发生心血管衰老时也增加。值得注意的是,在小鼠中,遗传或药物抑制cGAS-STING可以改善动脉粥样硬化、心肌梗死和中风表型。
虽然传统上认为先天免疫是心血管衰老和疾病中炎症的主要驱动力,但适应性免疫也与这些过程有关。随着年龄的增长,免疫衰老、T细胞耗竭和其他适应性免疫功能障碍的加剧不仅解释了对外部或内部病原体不足的免疫反应,而且还促进了全身性的炎症增加,从而促进了感染、癌症和心血管疾病。
尽管有广泛的证据表明,在临床前模型中,炎症和免疫机制参与了与年龄相关的心血管疾病的发病机制,但抗炎药物是否在人类中介导心血管事件的初级预防仍未充分证明。例如,低剂量阿司匹林是一种非胆固醇抗炎药物,也能抑制血小板聚集并诱导自噬,但在大型临床试验中未证明其能预防初发心血管事件。这是由于低依从性还是未将阿司匹林与其他药物联合使用仍有争议。事实上,在2022年,包括阿司匹林在内的多种药物的联合使用被证明可以提高二级预防心血管疾病的依从性和效果,但这些效果在初级预防环境中仍需进一步检验。此外,是否所有超过一定年龄的个体都应该接受抗炎药物治疗以预防心血管衰老,或者只有那些具有亚临床特征的个体应该成为治疗目标还不确定。例如,携带CHIP突变的老年个体可能对Canakinumab中和IL-1β特别敏感,正如CANTOS试验后续分析所建议的那样。Canakinumab治疗对于存在全身性炎症迹象(高敏感CRP≥2 mg/L)的患者特别有效,导致早期和强有力的炎性标志物减少。
正如讨论所述,有大量证据支持这样一个观点:炎性过程促使心脏和血管衰老。然而,哪些患者人群将从抗炎干预中受益,以及同时针对几种细胞类型(如巨噬细胞和T淋巴细胞)、细胞内通路(如cGAS-STING、NF-κB和NLRP3通路)或促炎效应分子(如I型干扰素、TNF和IL-1β)可能构成延缓或抑制心血管衰老的有效组合策略仍需确定。
框3 衰老和心血管疾病的标志
以下列出了可能受益于针对心血管衰老8个标志中的一个或多个的治疗干预措施的心血管疾病。
-
动脉粥样硬化
-
心房颤动
-
糖尿病性心肌病
-
扩张型心肌病
-
缺血性心肌病和心肌梗死
-
射血分数保留的心力衰竭
-
高血压
-
肥厚性心肌病
总结
心血管衰老的标志之间密切相关,这意味着改变单个标志的实验性干预可能影响其他多个标志。比如,自噬紊乱可导致蛋白质平衡失调、线粒体功能受损、神经激素信号不稳和炎症增加。相反地,实验性促进自噬可能改善线粒体功能、保护蛋白质平衡、减缓细胞老化并减少炎症反应。基因组不稳定性是细胞老化的主要驱动力,随后通过SASP(老年细胞分泌的炎性因子)加剧炎症。遗传不稳定性也可通过CHIP(蛋白质质量控制的调节蛋白)直接促进炎症反应。ncRNA和组蛋白的表观遗传改变抑制自噬,在心血管系统衰老中诱导细胞老化,并损害多种神经激素信号通路。
作者强调心血管衰老标志之间的区别:前4个标志(自噬障碍、蛋白质平衡失调、基因组不稳定性和表观遗传改变)随年龄逐渐加重,并在心血管系统衰老中起到先导作用。而线粒体功能障碍、神经激素信号失调和细胞老化属于对损伤的抵抗性反应,对心血管系统衰老具有微妙影响。当主导标志和抵抗标志造成的损伤积累到一定程度时,长期低度炎症作为心血管衰老的综合标志最终导致疾病发生。持续暴露于外部因素(如营养不良、久坐生活、心理压力、吸烟和污染)可能通过影响这些标志来促进心血管疾病的发展。
对此,肥胖是个例子,其中自噬阻滞、基因组失稳、表观遗传改变、线粒体功能障碍、细胞老化、神经激素信号失调和慢性炎症与心血管衰老加速现象相关。而饮食限制显示出延缓心血管衰老的益处,不仅在肥胖者中,也在非肥胖小鼠和人类中有效果。尽管传统风险因素的管理取得了成效,如控制血脂和高血压,但潜在的心血管风险依然存在,表明目前常规管理存在局限。目前的降脂治疗方法,例如PCSK9抑制剂,几乎消除了血浆中的LDL胆固醇,但并未完全消除心血管风险,这表明需要新的针对一个或多个衰老标志的治疗策略。事实上,每个心血管衰老标志都有望成为开发新药以延缓心血管健康衰老的潜在靶点。标志之间的相互关系将影响针对心血管衰老特征的药物干预效果,可能呈现加成或协同作用。因此,必要时需要综合评估对不同衰老特征的干预效果,并衡量其与心血管和整体健康相关的结果。虽然有大量临床前证据,但仍需进一步研究加强衰老标志在医疗实践中的可靠性和针对性。动物模型虽然模拟了人类许多衰老方面,但仍无法完全模拟其复杂性。尤其对于与年龄相关的动脉粥样硬化疾病,它在人类中几乎是不可避免的,但必须通过特殊干预措施(如敲除Apoe或Ldlr基因,或富含胆固醇的饮食)来在啮齿动物中模拟。
除了药物治疗,对于生活方式干预(如饮食和运动)如何优化心血管系统适应环境压力和减缓衰老过程,还需要进一步了解。对于健康饮食、定期运动和充分的心理社会应激反应的分子基础研究将继续扩展。因此,随着未来研究的推进,应将生物标志导向的健康生活方式方案与特定药物预防策略结合,以建立更可靠的心血管健康防线。
原始出处:
Mahmoud Abdellatif,et al.Hallmarks of cardiovascular ageing,Nat Rev Cardiol . 2023 Nov;20(11):754-777. doi: 10.1038/s41569-023-00881-3
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#心血管# #心血管事件# #衰老# #细胞衰老# #抗衰老#
40