导读
抗体偶联药物(Antibody-drug conjugates,ADCs)被描述为癌症治疗的“灵丹妙药”,药物的作用机制是将抗体部分的肿瘤靶向特性与细胞毒性药物的效力结合起来;它是一种复杂的治疗药物,由抗体、连接体和有效载荷三个关键成分组成。
尽管目前应用最广泛的ADCs以HER2为靶点,但在过去十年中,无论是在血液系统肿瘤还是实体肿瘤中,ADCs靶向的抗原已经多样化。目前许多其他的抗原靶向结合物或融合蛋白也已经被开发出来,例如免疫毒素和免疫细胞因子,替代有效载荷的药物等等。
在过去的二十年中,偶联技术取得长足进步,导致ADC设计在化学均匀性和药物抗体比(DAR)方面有了相当大的改进。ADC中使用的细胞毒性部分的成分也已经多样化,包括各种类型的DNA靶向剂、微管蛋白结合剂以及拓扑异构酶1抑制剂等。
ADC的适应症越来越广泛,包括单药方案、联合方案、辅助或新辅助治疗。
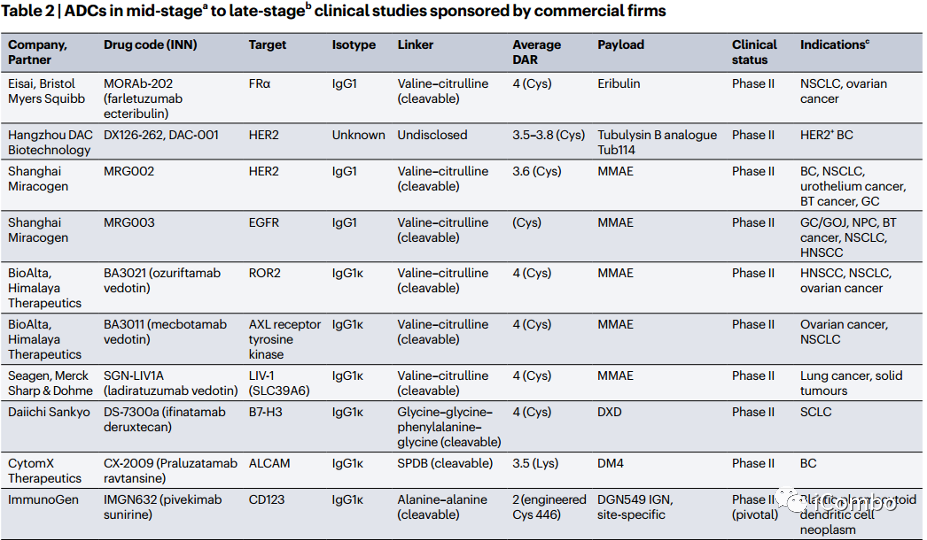
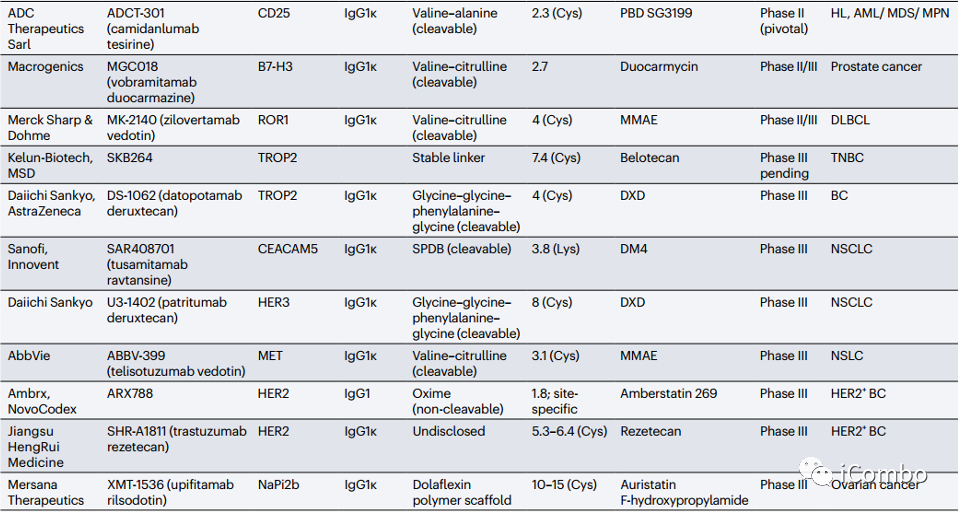
目前超过140种ADC药物正在临床试验中,其中11种处于中-后期研究中。
本篇综述主要讲述与ADC药物开发相关的最新进展和障碍的概述(Nat Rev Drug Discov.2023 Aug;22(8):641-661. doi: 10.1038/s41573- 023-00709-2)。
研究背景
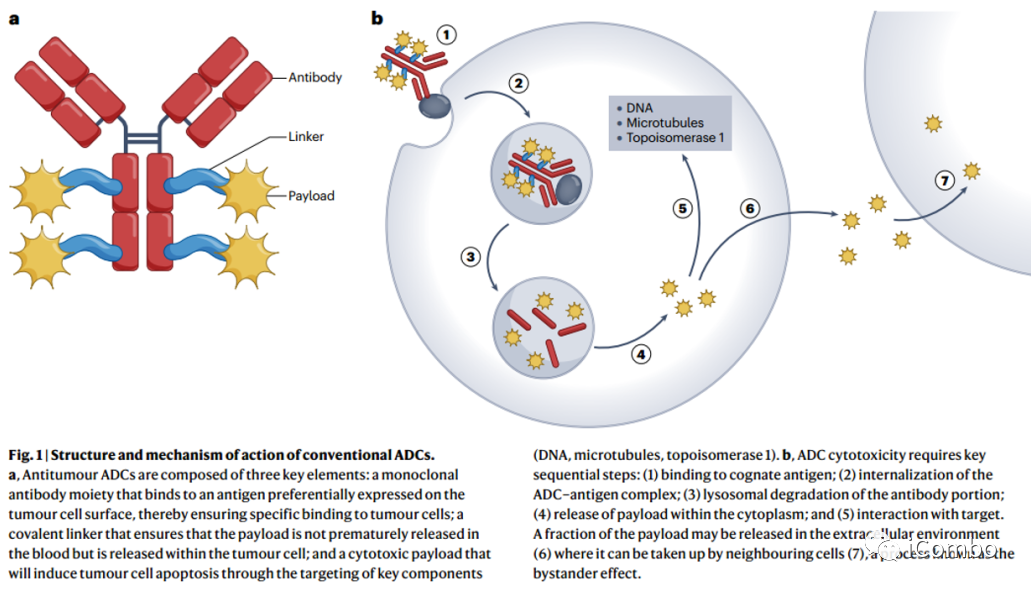
抗体偶联药物(ADCs)被描述为癌症治疗的“灵丹妙药”,药物的作用机制是将抗体部分的肿瘤靶向特性与细胞毒性药物的效力结合起来;它是一种复杂的治疗药物,由抗体、连接体和有效载荷三个关键成分组成(Fig. 1)。
本篇综述中,将“ADC”限制为指含有全长免疫球蛋白(IgGs)的分子,通过化学共轭键偶联到细胞毒性药物载荷上;目前许多其他的抗原靶向结合物或融合蛋白也已经被开发出来,例如免疫毒素和免疫细胞因子,替代有效载荷的药物等等。
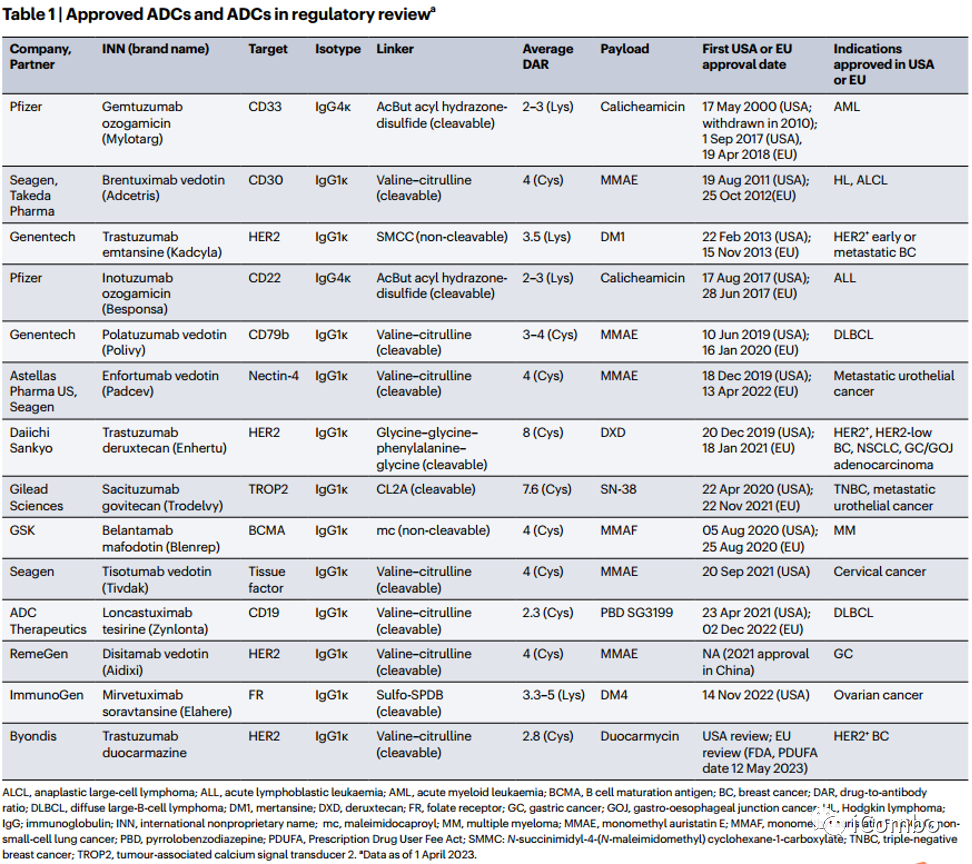
尽管目前应用最广泛的ADCs以HER2为靶点,使用非偶联抗体曲妥珠单抗(1998年首次批准用于治疗HER2阳性乳腺癌)作为主要药物,但需要强调的是,在过去十年中,无论是在血液系统肿瘤还是实体肿瘤中,ADCs靶向的抗原已经多样化(Table 1 and Fig. 2)。
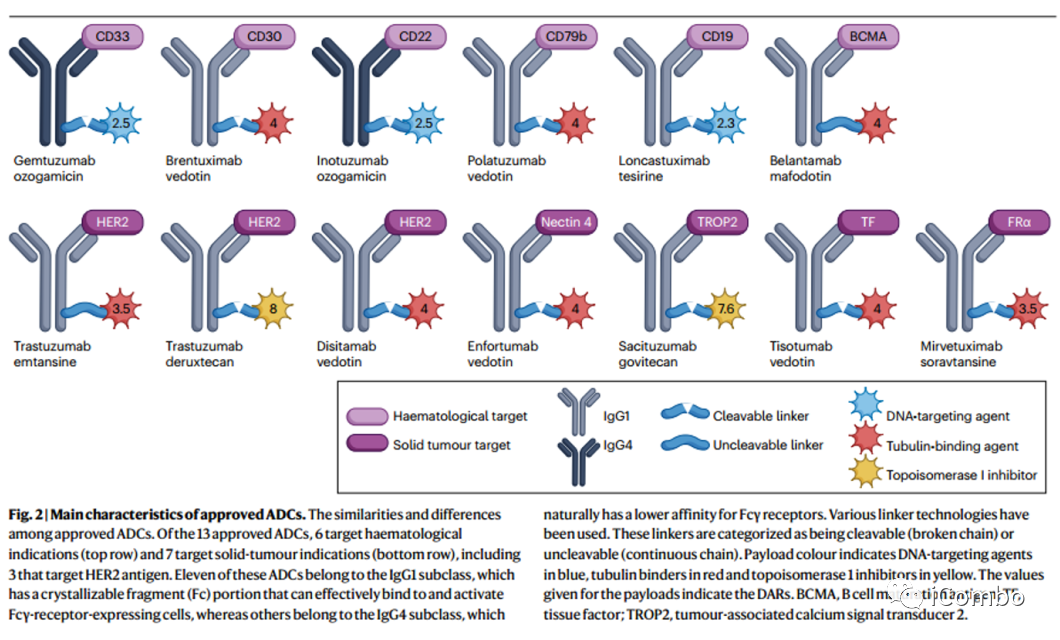
(Fig. 2)
在过去的二十年中,偶联技术取得长足进步,导致ADC设计在化学均匀性和药物抗体比(DAR)方面有了相当大的改进。ADC中使用的细胞毒性部分的成分也已经多样化,包括各种类型的DNA靶向剂、微管蛋白结合剂以及拓扑异构酶1抑制剂等。目前ADC的适应症越来越广泛,包括单药方案、联合方案、辅助或新辅助治疗。
目前超过140种ADC药物正在临床试验中,其中11种处于中-后期研究中(Table 2,见下页PPT) 。
然而,预料之外的毒性、ADC所携带的药物的有限毒性改善、以及对治疗耐药性的发展,意味着在未来开发和使用中需要付出相当大的努力来优化这些药物。
本篇综述中,主要是讲述与ADC开发相关的最新进展和阻碍的概述。

正文部分
1、Approved ADCs
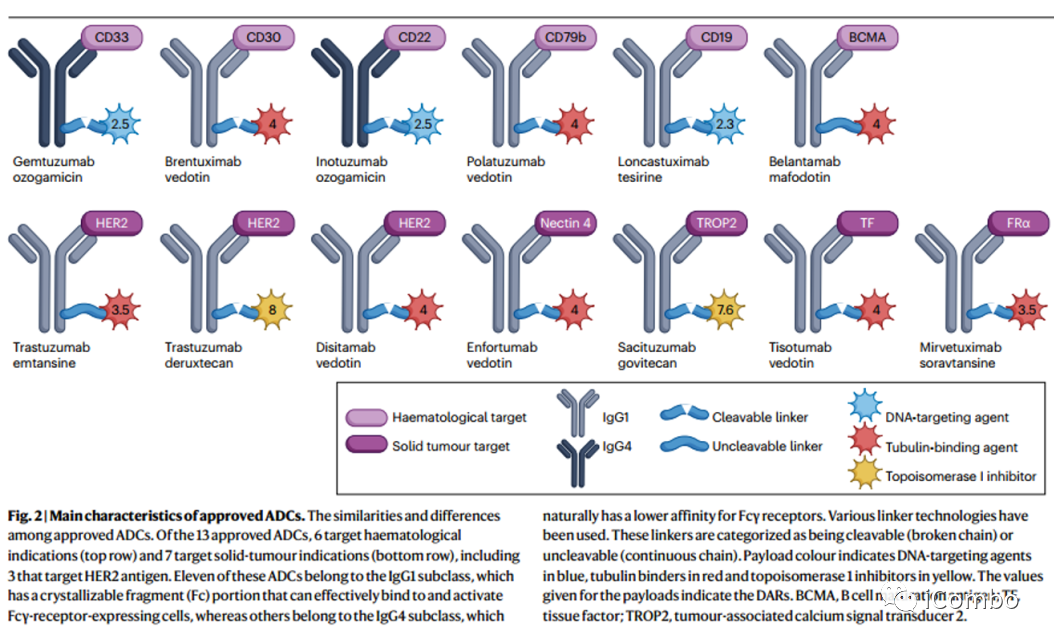
(Fig. 2)
目前全球有13种批准上市的ADCs,包括靶向6种不同抗原(CD33, CD30, CD22,CD79b、 BCMA,也称为TNFRSF17和CD19)血液系统肿瘤,以及7种靶向5种不同抗原(HER2、nectin-4、TACSTD2,也称为TROP2和 FRα)的实体肿瘤。
2、ADCs in haematological malignancies
目前有6种ADCs被批准用于血液系统恶性肿瘤,1种用于治疗急性髓性白血病(AML),5种用于治疗B系恶性肿瘤,包括淋巴瘤、慢性淋巴细胞白血病(CLL)和多发性骨髓瘤。Gemtuzumab ozogamicin(GO)结合抗CD33抗体和DNA靶向药物calicheamicin,为不适合标准治疗的老年复发性AML患者带来一种新的治疗方案,由于它克服了许多技术和临床障碍,一度认为是治疗先驱代表。第一次使用GO治疗的患者是高度异质性的,平均DAR为2,范围在0到7之间。在2000年获得FDA加速批准一年后,GO由于发生严重的静脉闭塞性疾病(一种潜在致命的肝脏疾病)而收到了警告。在III期试验中显示接受GO治疗的患者死亡率更高后,除日本外,该药物已从大多数主要市场撤出。2012年,法国ALFA小组的一项研究表明,剂量分次(用3次3mg m-2代替一次9mg m-2剂量)足以控制肝毒性,同时保持抗白血病活性。GO于2017年再次获得FDA批准,用于一线治疗以及成人和儿童复发或难治性CD33阳性AML。
淋巴细胞恶性肿瘤是在ADC的开发和批准方面取得重大进展的另一类疾病。B细胞恶性肿瘤的靶点CD20(利妥昔单抗的靶点)在与抗体结合后不会内化,尚未用于ADC。CD30、CD22、CD79b、CD19和BCMA已被证实是ADCs在各种适应症中的靶点。
Brentuximab vedotin(BV)被批准用于治疗霍奇金淋巴瘤和CD30阳性T细胞淋巴瘤(CD30+ T细胞恶性肿瘤较少)。霍奇金淋巴瘤因其特殊的发病率分布而引人注目,在青少年和年轻人以及60岁或以上的患者中发病率最高。在未经治疗的霍奇金淋巴瘤中,BV替代经典的ABVD方案,显示出更高的有效率(NCT01712490, NCT02292979);临床试验发现(NCT01578499),与医生的选择治疗方案相比,BV在先前治疗过的皮肤T细胞淋巴瘤患者中显示更高的应答率;在周围T细胞淋巴瘤患者中(NCT01777152) ,与经典CHOP方案相比,BV可延长的生存期。
目前有45项使用BV的研究,探索针对特定人群(如HIV患者)的几种联合或单药治疗。BV被 ESMO、NCCN,以及各种共识研讨会推荐,包括高剂量化疗前的挽救治疗或后的巩固治疗。它也被UK National Institute和 UK National Institute (NICE)推荐用于治疗皮肤T细胞淋巴瘤。BV近年处方量显著增加,是2021年销量第二高的ADCs。
3、ADCs in solid tumours
Her-2阳性肿瘤,包括乳腺癌和其他实体肿瘤类型,目前占据所有接受ADCs的患者中占绝大比例。由于HER2在与抗体结合后被内化,第一个抗HER2 ADCs是使用已经批准并广泛使用的“裸”抗体曲妥珠单抗开发的。
在乳腺癌患者的EMILIA III期试验中,与小分子抗HER2药物拉帕替尼和化疗药物卡培他滨联合使用相比,抗Her-2 ADCs 药物T-DM1获得更高的缓解率、更长PFS和OS,3/4级不良事件发生率更低。成为首个被批准用于治疗实体肿瘤的ADC。T-DM1目前被批准用于HER2阳性晚期乳腺癌以及HER2阳性早期乳腺癌患者的辅助治疗。
T-DXd是一种含有强效拓扑异构酶I抑制剂的ADC,在HER2阳性复发性转移性乳腺癌患者中获得比T-DM1更长的PFS。此外,在HER2低表达的乳腺癌患者中,T-DXd显示出比医生选择的化疗方案更好的抗肿瘤活性。在指南更新中,ASCO确定将T-DXd作为HER2阳性转移性乳腺癌标准的二线治疗,取代T-DM1。该药物也已被批准用于晚期或转移性HER2阳性胃或胃食管交界处腺癌患者。
实体肿瘤为ADC的发展提供更广阔的机会,因为它们比血液系统恶性肿瘤更常见,在晚期或转移性疾病中治疗选择相对较少。2019年批准针对Nectin-4的Enfortumab vedotin用于治疗局部晚期或转移性尿路上皮癌,以及针对TROP2的sacituzumab govitecan用于治疗三阴性乳腺癌,这对于临床更有意义,因为它们为治疗选择有限的肿瘤提供了新的治疗选择。
2022年11月14日,FDA加速批准mirvetuximab soravtansine用于治疗FRα阳性、铂耐药上皮性卵巢癌,输卵管癌或原发性腹膜癌患者,这些患者先前接受过1至3种全身治疗方案。FDA还批准了罗氏公司开发的伴随诊断,VENTANA FOLR1(FOLR1-2.1)RxDx检测,以选择接受治疗的患者。FRα是一种糖基磷脂酰肌醇锚定膜蛋白,在卵巢、乳腺和肺部肿瘤中经常过表达,在正常组织中低表达或不表达。FRα已被研究作为预后标志物、影像学靶点和治疗靶点。
4、Addressing the limitations of ADCs
自2000年开始,进入临床试验并结束的97种ADCs中,大多数(81; 84%)在I期或I/II期终止。只有12个和4个分别在II期和III期终止。这些药物中的大多数(67%)含有微管蛋白结合有效载荷,24%含有DNA靶向剂, 3%含有拓扑异构酶1抑制剂。这些药物中有18种靶向有效靶点,包括HER2(6种化合物)、TROP2(3种化合物)和各种血液学靶点(13种化合物)。32种药物因疗效不足而停药,32种药物因安全性问题而停药,29种药物因组合优先级问题而停药。
在最大耐受剂量下抗肿瘤活性不足似乎是临床试验的主要终止原因,不可接受的毒性仍然是开发新型药物的主要障碍。更好地预测预期的严重不良事件将是减少过早终止药物治疗的另一种方法。例如,针对钙粘蛋白-6的ADC HTK288与意想不到的中枢神经系统毒性相关,而针对酪氨酸激酶受体KIT的ADC LOP628与意想不到的严重超敏反应相关,而针对ephrin-a型受体2(EPHA2)的ADC MEDI-547与异常出血相关。
总体来说,这些试验结果强调要选择合适的靶抗原、活性连接物有效载荷、合适的DAR值和正确的肿瘤适应症。
5、Payload diversification
直到T-DXd在2019年获批,上市ADC的有效载荷主要分为两大类:微管蛋白结合剂和DNA靶向剂。目前已经评估大量其他药物可以作为潜在的有效载荷。
干扰微管蛋白聚合动力学的Auristatin衍生物通过破坏有丝分裂纺锤体形成发挥强大的作用,导致有丝分裂阻滞导致细胞死亡,此外,auristatins 诱导免疫原性细胞死亡。Auristatin的药物是目前最大的ADC家族(Fig. 3)。
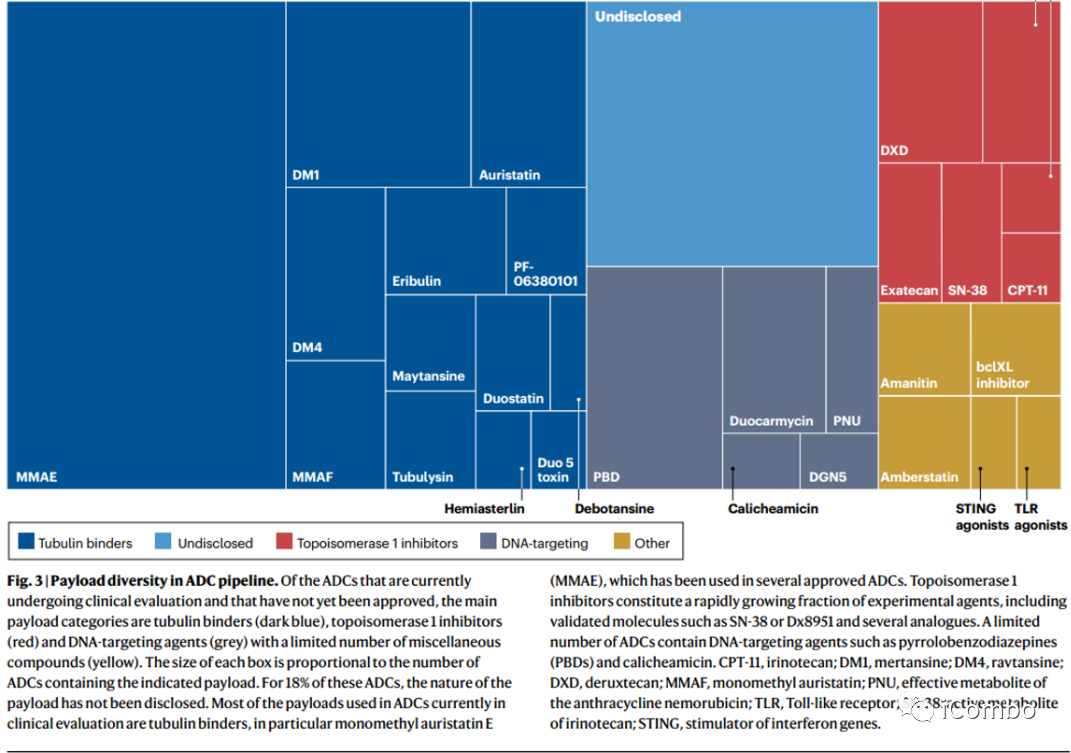
第二个最具代表性的有效载荷家族是DNA靶向剂,其化学修饰DNA,从而阻止细胞复制。Calicheamicin,是一种强大的DNA损伤剂,通过自由基机制导致双链DNA(dsDNA)断裂,是两种已批准的ADC的有效载荷。PBD二聚体是一种烷基化剂,可以交联dsDNA,是目前发现的最有效的细胞毒性剂之一。PBDs与严重的髓系毒性和周围水肿有关,目前是一种被批准ADC的有效载荷。
鉴于并非所有肿瘤类型都对特定类型的有效载荷敏感,多样化的有效载荷对于扩大ADC适应症至关重要。
关于有效载荷的发展,总结以下3条:
-
首先,并非所有常用的细胞毒性药物家族都能成功地成为为ADC的有效载荷。开发核苷类似物和抗代谢物作为有效载荷的尝试失败了。
-
其次,目前还没有批准的ADC含有与传统化疗完全不同的细胞毒性机制的有效载荷。
-
最后,在临床试验中评估的大量具有原始作用机制的新型药物中,包括激酶抑制剂和靶向肿瘤细胞内各种过程的分子,由于安全性差,大量药物以失败而告终。其中一些可能是潜在的ADC候选的有效载荷。
鉴于ADC的复杂性,有效载荷多样化可能被认为是一项冒险的努力。
6、ADC toxicities
与ADC相关的毒性可分为“预期”和“意外”,通常所考虑的都是基于有效载荷类型相关的副作用。
预期毒性作用:
-
MMAE诱导周围神经病变,这是微管蛋白结合剂的典型副作用,这种副作用可能严重影响一些患者的生活质量,可逆性是一个关键问题;
-
髓系毒性是大多数细胞毒性化疗药物的常见并发症,尤其是DNA靶向药物。在calicheamicin的病例中,接受GO治疗的AML患者中观察到的主要毒性是血小板减少;Loncastixumab tesirine诱导高级别中性粒细胞减少和血小板减少,而rovalpituzumab tesirine与血小板减少以及迟发性周围性水肿相关,其毒性水平与PBD二聚体类药物相关。
预料之外的毒性作用:在ADC的发展过程中观察到一些意想不到的和潜在的严重或使人衰弱的毒性。
-
如上所述,calicheamicin与肝毒性有关。在一组119例AML或骨髓增生异常综合征患者中,12%的患者发展为静脉闭塞性疾病。
-
Monomethyl auristatin F(MMAF)用于批准的ADC(如belantamab maodotin)与角膜毒性相关,例如belantamab maodotin,高达72%的患者出现上皮改变。
-
基于DM1和DM4-ADC也引起脱靶眼毒性,考虑眼毒性的倾向可能是一类以抗微管蛋白为基础的效应ADC,这种ADC介导的眼部毒性的根本原因尚不清楚。
-
已观察到几种ADC的肺毒性。Trastuzumab deruxtecan被发现与间质性肺疾病或肺炎相关,通常是低级别的,但在1%的患者中被证明是致命的。
-
随着ADC越来越多地被纳入联合用药方案,可能会观察到其他意想不到的毒性。在霍奇金淋巴瘤患者中,BV联合含有博来霉素的标准治疗方案导致44%的患者发生严重肺毒性。
这些不同毒性的潜在机制尚不完全清楚,可能涉及FC介导的ADC内化与正常组织内有效载荷的释放;靶抗原的肿瘤外表达,通过胞吞作用或类似细胞过程非特异性摄取ADC,系统或特定正常组织环境中有效载荷的酶释放,或在有效载荷介导的组织损伤背景下FC介导的炎症效应。
关于ADC毒性的一个关键概念是靶标与脱靶效应。ADC可与低水平表达靶抗原的健康组织结合并内化,但大部分毒性归因于脱靶结合。此外,尽管它们优先针对肿瘤,但给予的大部分ADC剂量将局限于健康组织。
在过去的十年中,由于连接剂和偶联化学的改进,避免有效载荷的快速全身释放,但有可能在血浆中释放的一些有效载荷与白蛋白或其他蛋白质结合。
Fc结构域上相对高比例的半乳糖化聚糖可能有利于对富含髓细胞、内皮细胞和肝细胞的组织产生脱靶ADC毒性,因为这些细胞表达高水平的甘露糖受体。
7、Resistance to ADCs
ADC的应答率在不同适应症和环境下差异很大。据报道,T-DM1在高达44%的先前接受过HER2阳性乳腺癌治疗的患者中诱导肿瘤反应,而在未接受过治疗的患者中,反应率可达60%。
大多数在晚期接受全剂量ADC治疗出现初始肿瘤反应,最终将经历肿瘤进展,产生耐药。
鉴于成功的ADC细胞毒性所需的一系列步骤,ADC耐药的机制可能也是复杂的。在抗原结合减少和/或抗体/抗原内化的情况下,可以观察到对ADC的耐药性;细胞内有效载荷浓度降低;有效载荷目标的改变;凋亡机制的改变;最后,在某些情况下,减少了FC介导的细胞杀伤机制。这些机制仍然描述不全面,大部分可用数据是在临床前模型中获得的,而不是在患者样本中获得的。
几种临床前耐药模型中观察到抗原表达减少。在T - DM1耐药细胞系中,HER2抗原表达降低可能是耐药的主要原因。
对其他耐药机制的研究有限,并且很少在临床前模型中探索有效载荷靶点的改变。负责诱导的细胞死亡机制通常包括细胞凋亡,这既需要功能性凋亡机制,也需要抗凋亡和促凋亡蛋白的良好平衡。BCL2和BCLXL的表达增加与对多种抗癌药物的耐药性相关。
此外,T-DM1耐药模型显示微管蛋白组成改变。对于具有功能性FC部分的ADC,也可能涉及对抗体依赖性细胞毒性或细胞吞噬和补体依赖性细胞毒性的抗性机制。由于这些是FC活性裸抗体细胞毒性的主要机制之一,因此可以获得一些可能与某些ADC相关的数据。CRISPR筛选发现了几个癌细胞吞噬的调节因子,包括脂肪质膜相关蛋白。CD47(一种“不要吃我”的信号)的表达与对利妥昔单抗的敏感性降低有关。补体抑制蛋白如CD55和CD59对诱导补体依赖性细胞毒性至关重要。这些潜在耐药机制在ADC中的作用仍有待探讨。
抗原表达异质性是基于抗体的治疗失败的典型机制。
ADC的给药方式预计也会对耐药的发生产生重大影响。
8、ADC combinations
除泊洛妥珠单抗(polatuzumab vedotin)外,大多数ADC首先被批准用于复发或难治性疾病的单药治疗,polatuzumab vedotin首次被批准用于与苯达莫司汀联合治疗DLBCL。
BV已经与80多种不同的疗法结合在一起,包括细胞毒性化疗和免疫检查点抑制剂。BV与免疫检查点抑制剂的联合治疗非常有前景。在复发/难治性霍奇金淋巴瘤患者中,BV联合纳武单抗可诱导82%的总缓解率,包括61%的完全缓解率。该组合也被批准为体弱或老年患者的一线治疗,安全性尚可,总有效率为64%。Pembrolizumab也可与BV联合,作为自体干细胞移植的准备方案。BV联合ipilimumab和nivolumab似乎也是可行的,目前正在进行I/II期研究(NCT01896999)。BV联合纳武单抗在复发/难治性原发性纵隔大B细胞淋巴瘤中也非常有效,总有效率为70%。
T-DM1也被用于联合用药。在一项评估T-DM1与阿霉素脂质体的Ib期研究中,未观察到对心功能的意外影响或任何药代动力学相互作用。在T-DM1中加入卡培他滨并没有提高总体缓解率,反而引起了更多的不良事件。T-DM1与紫杉烷联合用于晚期疾病患者,与周围神经病变或其他毒性的高发相关,导致剂量减少。T-DM1也与帕妥珠单抗联合使用。在MARIANNE研究中,接受T-DM1 +帕妥珠单抗治疗晚期乳腺癌的患者受益于相似的总生存期,但生活质量优于接受曲妥珠单抗和紫杉醇治疗的患者。
T-DM1也与免疫检查点抑制剂联合使用。临床和临床前数据支持T-DM1与这些药物的联合使用。在一项随机II期试验中(NCT02924883),晚期Her2阳性乳腺癌患者接受T-DM1和atezolizumab的严重不良事件发生率更高,但与接受T-DM1和安慰剂的患者相比,没有临床意义的改善。T-DM1与派姆单抗(NCT03032107)联合治疗正在临床研究中。
总体来说,这些研究表明,无论是在患者预后还是安全性方面,精心选择ADC与其他药物的组合可能优于基于非偶联抗体的治疗。安全性是组合设计中的一个关键问题,特别是对于身体虚弱或已有疾病的患者。需要仔细监测重叠或预料之外的毒性,并根据每个患者的情况进行调整。未来的研究将需要确定哪些患者亚群从这些组合中获益最多。
9、ADCs advance in the future
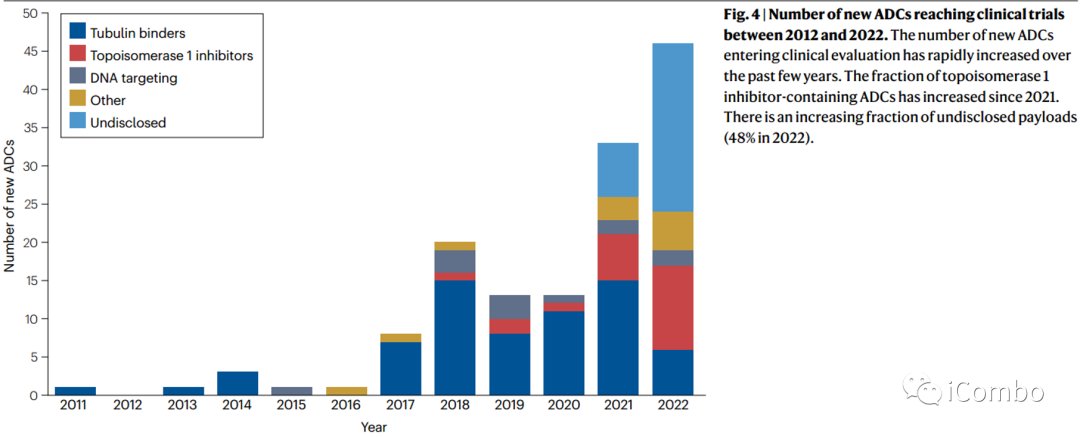
ADC现已在癌症药物中获得稳固地位。目前ADC临床研究超过1500项,越来越多的药物进入临床试验(Fig. 4),可以预期ADC的上市批准将大幅多样化,其在各种疾病中的适应症也将多样化。
越来越多的研究正在探讨ADC的免疫刺激特性。除了免疫刺激剂本身的偶联,如免疫刺激抗体偶联物(iADCs),ADC还可以诱导免疫原性细胞死亡(ICD),从而促进抗肿瘤免疫反应。ICD是一种垂死细胞发出辅助信号导致适应性免疫反应的过程,可由某些类型的细胞毒性化疗药物或靶向药物引起。诱发ICD可能是ADC与免疫联合使用有效的原因。
消除免疫抑制肿瘤微环境;
超越目前的ADC模式药物;双特异性抗体技术的快速发展为ADC的抗体形式提供更多选择。在双特异性抗体上偶联有效载荷以产生具有更高特异性和/或内化的双特异性ADC是一个新的研究领域,有望克服现有的局限性,如内吞作用、毒性和对ADC的耐药性。
作者:iCombo
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#肿瘤知识库#春节打卡第一天,刷到了传说中的ADCs
26
#癌症# #抗体药物耦合物#
29