Nat Commun :法国科学家发现新的癌症免疫疗法的耐药治疗策略
2020-09-20 BioImmunology Bio生物世界
使用免疫系统对抗疾病,至少要从300年前开始说起。据记载,在1718年,一名英国外交官的夫人在伊斯坦布尔观察到,“人痘接种”在当地非常流行。
使用免疫系统对抗疾病,至少要从300年前开始说起。据记载,在1718年,一名英国外交官的夫人在伊斯坦布尔观察到,“人痘接种”在当地非常流行。这是指将天花患者的痘疤磨成粉末,或是直接从患者身上获取脓汁,让其接触正常人。当时的人们还不知道免疫系统的工作机制,但他们知道,这样做能将天花高达30%的致死率降到1%-2%。
许多重要的科学突破,最初往往来自于幸运的发现。就拿牛痘疫苗来说,活性得到削减的病原体是疫苗研发的良好出发点,而当年詹纳博士用来接种的病原体,其活性已经得到了天然的“减活”,既能带来免疫反应又不至于感染,是一个极为幸运的事件。
PD-1的发现是人类科学史上又一个幸运的事件
PD-1的发现,就是在上世纪90年代初。这一个偶然的发现也为后世带来了深远的影响。然而,人类将PD-1与免疫系统挂起钩来,还是在1999年,本庶佑教授课题组决定在小鼠中敲除PD-1基因,探索它的功能。有趣的是,缺乏PD-1的小鼠,有一半出现了红斑狼疮般的症状,这是一种严重的自身免疫疾病。研究人员们据此推断,这些小鼠体内的免疫系统得到了异常激活。也就是说,PD-1在小鼠体内,起到了抑制免疫系统的作用。
本庶佑教授等学者很快就意识到,PD-1可能也是一个类似的“免疫刹车”,或可在肿瘤免疫中发挥特有的疗效。而华裔科学家陈列平教授的发现了PD-1在肿瘤细胞上的配体PD-L1(B7-H1),更是指明了一条可行的道路。
2002年,本庶佑教授发表论文阐明,在小鼠体内抑制PD-1通路可以极大地增强它们对肿瘤的抵抗力。在PD-L1抗体的作用下,黑色素瘤细胞的生长得到了显着的抑制。而在缺乏PD-1的小鼠体内,黑色素瘤细胞更是被彻底压制。“这些结果表明……抑制PD-1与PD-L1的结合,有希望带来针对特定肿瘤的免疫疗法。”研究人员们在论文摘要中这样写道。
无可避免的事件:PD-1抗体特异性治疗带来的耐药性发展
从PD-1基因功能的发现,到现如今大热的免疫检查点抑制剂疗法,这一切都似乎是水到渠成的发展。然而,无论是临床医生或科研人员,都要面临一个巨大的挑战:使用PD-1抗体阻断剂治疗,仍有一些患者出现肿瘤的复发与耐药。
这个事实似乎令人异常沮丧,免疫检查点抑制剂疗法(ICB)的出现,抵抗了传统癌症治疗方式(如放化疗)所带来的耐药发展,那谁能抵抗ICB带来的肿瘤复发呢?
这个答案,或许能从一个法国团队的研究中得出结论。
选择性抑制GARP+Tregs产生TGF-β1,可抵抗肿瘤对PD-1/ PD-L1阻断剂产生的耐药性
2020年9月11日,法国鲁汶天主教大学的Sophie Lucas教授团队在Nature Communications 杂志上发表了题为:Selective inhibition of TGF-β1 produced by GARP-expressing Tregs overcomes resistance to PD-1/PD-L1 blockade in cancer 研究论文。
在该研究中,作者发现抗GARP:TGF-β1mAb与PD-1阻断剂联合使用,能显着增强肿瘤T细胞的效应力,防止肿瘤的复发。GARP基因是Lucas教授于2009年发现的位于Treg细胞表面的分子,多年来一直在探索其功能。2018年,她发现该分子作为Treg细胞的信使,通过发送信号阻止免疫应答的发生。这一重要发现发表在2018年11月23日的Science期刊上(Science, 2018, doi: 10. 1126/science. aau2909)。
解除PD-1阻断剂治疗后产生耐药,关键在于Treg细胞
调节性T细胞(Tregs)的免疫抑制对于维持外周免疫耐受是必不可少的,但在慢性感染与癌症中却发挥着相反的作用。靶向抑制Treg细胞从而治疗癌症,是肿瘤免疫疗法一个趋之若鹜但仍然悬而未决的领域。目前已有研究证实,在小鼠体内对Treg细胞可通过多种机制介导免疫抑制作用,然而目前尚不清楚靶向这些作用机制能否增加癌症患者体内的抗肿瘤免疫;同时,当前已上市的癌症免疫疗法均不能在不伤害TEM中其他淋巴细胞的情况下,特异性阻断Treg。
已知,能被mAb特异性靶向的Treg细胞,会产生免疫抑制因子TGF-β1。Treg以无活性的形式产生TGF-β1,后者与其膜表面的潜伏相关肽(LAP)非共价结合形成多聚体环状结构。在TCR的信号刺激下,仅有GARP+Treg细胞可从LAP环中释放TGF-β1,这是由于GARP可与LAP形成二硫键,从而释放TGF-β1上与受体结合的位点。
而Sophie Lucas教授认为,GARP+Treg细胞可从LAP环中释放TGF-β1是肿瘤免疫疗法中,肿瘤细胞产生耐药的关键一环。
抗GARP:TGF-β1mAb与PD-1阻断剂联合使用,能显着增强肿瘤T细胞的效应力
为了解决这个问题,研究团队构建了抗鼠GARP:TGF-β1mAb以及鼠结肠癌模型。在鼠模型中,抗鼠GARP:TGF-β1mAb与PD-1阻断剂联合使用,可显着延长小鼠的生存期、减缓肿瘤生长速度,甚至有些个体达到了肿瘤的完全缓解。
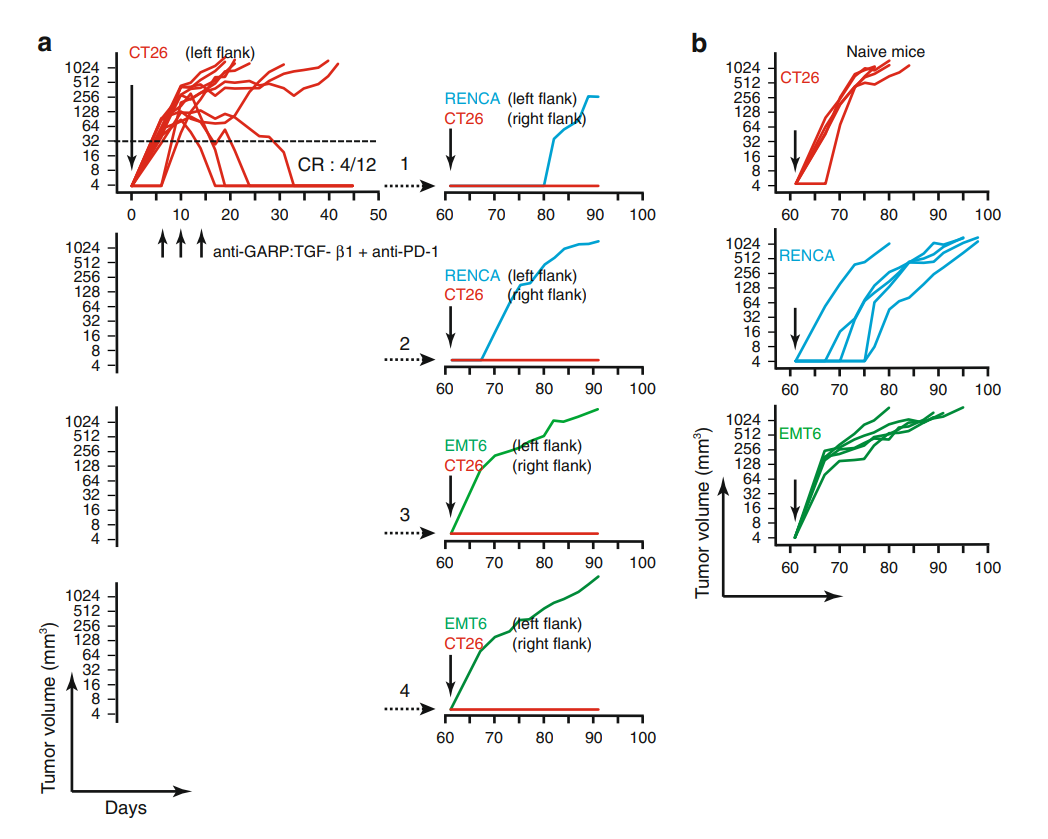
研究人员在完全缓解的小鼠肿瘤消失46天后,在此接种结肠癌细胞株,然而并为发现结肠癌的再次复发。
抗GARP:TGF-β1与抗PD-1组合可诱导小鼠对同种肿瘤抗原产生记忆性免疫应答,以防止肿瘤复发
而同样,研究人员也在进一步的实验中发现,这种联合疗法的增强作用,并不是依靠上升CD8+T细胞或者降低Treg细胞的数量实现的。仅通过放大T细胞本身的抗肿瘤免疫活性,而达到所需的疗效。同时,他们还在多种人类肿瘤中检测中GARP+Treg细胞的存在,尤以黑色素瘤为甚。
作者在文末写道,抗GARP:TGF-β1和抗PD-1的组合治疗,通过放大CD8+细胞的活性以及释放IFNγ信号;同时,通过抑制Treg细胞的功能发挥其疗效。然而,这并不一定意味着抗GARP:TGF-β1mAb在癌症患者中作为单一疗法没有抗肿瘤活性,只能表明它们能够克服机体对PD-1/ PD-L1的原发性或获得性耐药。
原始出处:
Grégoire de Streel, Charlotte Bertrand, Nicolas Chalon, et al.Selective inhibition of TGF-β1 produced by GARP-expressing Tregs overcomes resistance to PD-1/PD-L1 blockade in cancer.Nat Commun. 2020 Sep 11;11(1):4545. doi: 10.1038/s41467-020-17811-3.
作者:BioImmunology
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#Nat#
36
#COMMUN#
47
#科学家发现#
40
#法国#
47