Gastric Cancer:无论之前是否使用过曲妥珠单抗,nivolumab作为晚期G/GEJ癌患者的三线或后线治疗都是有效和安全的
2020-11-13 MedSci原创 MedSci原创
目前缺乏关于免疫检查点抑制剂在人表皮生长因子受体2阳性(HER2+)晚期胃/胃食管交界处(G/GEJ)癌患者中的疗效数据。由于ATTRACTION-2试验中未明确HER2的状态,因此,本研究中我们使用
目前缺乏关于免疫检查点抑制剂在人表皮生长因子受体2阳性(HER2+)晚期胃/胃食管交界处(G/GEJ)癌患者中的疗效数据。由于ATTRACTION-2试验中未明确HER2的状态,因此,本研究中我们使用既往使用过曲妥珠单抗(Tmab+)的患者作为HER2表达状态的代用品,以评估nivolumab作为这些患者的三线或晚期线治疗的有效性和安全性。
ATTRACTION-2是一项随机、双盲、安慰剂对照的3期多中心试验,患者随机(2:1)接受nivolumab(3mg/kg)或安慰剂,每2周一次,直到疾病进展或毒性需要停止研究。评估了总生存期(OS)、无进展生存期(PFS)、客观反应率(ORR)和安全性,研究结果已在线发表于Gastric Cancer。

在493名入组患者中,81名(nivolumab,n = 59;安慰剂,n = 22)接受Tmab+,412名(nivolumab,n = 271;安慰剂,n = 141)接受Tmab-。结果显示,与安慰剂组相比,nivolumab组患者的中位OS较长(Tmab+,8. 3 [95% CI,5.3-12.9] vs 3.1 [1.9-5.3] 个月,HR,0.38 [0.22-0.66];P = 0.0006;Tmab-,4.8 [4.1-6.0] vs 4.2 [3.6-4.9] 个月,0.71 [0.57-0.88];P = 0.0022)。此外,nivolumab 组的PFS也较安慰剂组长(Tmab+,1.6 [1.5-4.0] vs 1.5 [1.3-2.9] 个月,0.49 [0.29-0.85];P = 0.0111;Tmab-,1.6 [1.5-2.4] vs 1.5 [1.5-1.5] 个月,0.64 [0.51-0.80];P = 0.0001)。
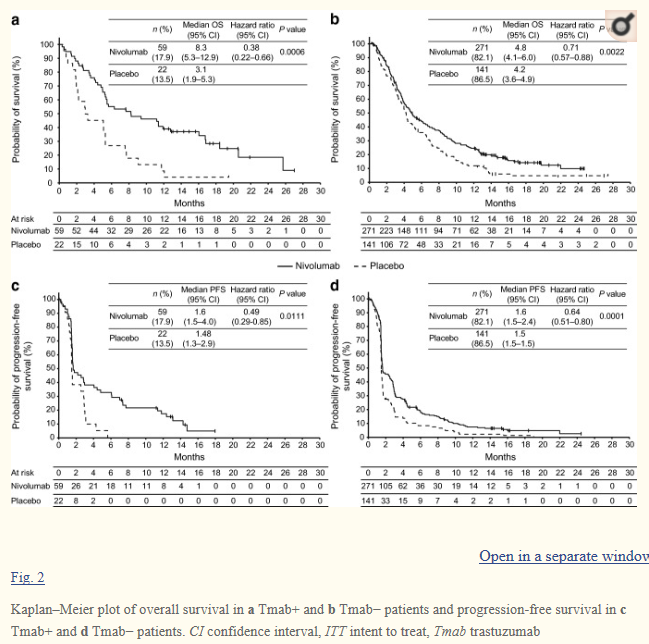
综上所述,该研究结果表明,无论之前是否使用过曲妥珠单抗,nivolumab作为晚期G/GEJ癌患者的三线或后线治疗都是有效和安全的。
原始出处:
Taroh Satoh, Yoon-Koo Kang, et al., Exploratory subgroup analysis of patients with prior trastuzumab use in the ATTRACTION-2 trial: a randomized phase III clinical trial investigating the efficacy and safety of nivolumab in patients with advanced gastric/gastroesophageal junction cancer. Gastric Cancer. 2020 Jan;23(1):143-153. doi: 10.1007/s10120-019-00970-8.
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#mAb#
44
#GAS#
43
#AST#
44
#曲妥珠#
49
#gastric#
42