Nat Immunol:阻断CD36,为癌症免疫治疗加油
2020-03-24 与癌共舞 与癌共舞
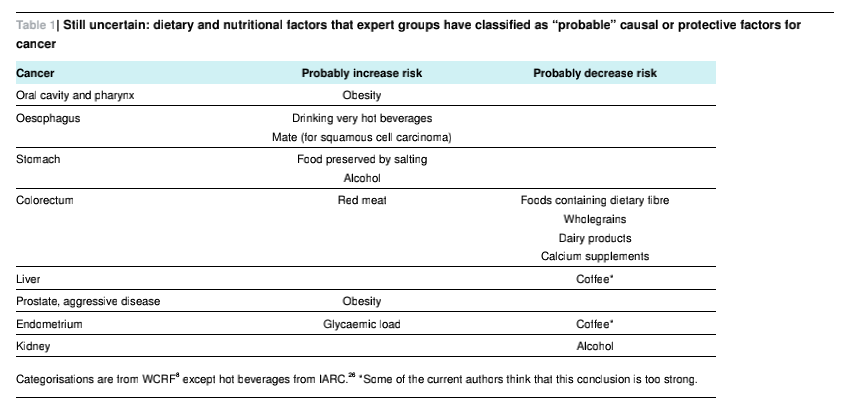
CD36属于B类清道夫受体家族,是分子量为88KD的单链跨膜蛋白。CD36蛋白的早期研究主要集中在脂肪的代谢以及与动脉粥样硬化的相关方面。近年来科研工作者们发现CD36是一个多配基受体蛋白,其生物学功
CD36属于B类清道夫受体家族,是分子量为88KD的单链跨膜蛋白。CD36蛋白的早期研究主要集中在脂肪的代谢以及与动脉粥样硬化的相关方面。近年来科研工作者们发现CD36是一个多配基受体蛋白,其生物学功能涉及炎症反应、噬菌、细胞凋亡吞噬、血管生成、能量代谢以及肿瘤等多个方面。CD36是一种脂肪酸受体,负责脂肪酸的识别和细胞跨膜转运,CD36能帮助肿瘤细胞从周围环境中摄取脂肪分子,这些脂肪分子成为这些细胞转移的能量来源。他们认为,肿瘤细胞转移需要大量额外能量,这些细胞能从环境中摄取脂肪使之具有了转移的能力。
2017年Nature的一项研究首次指出可CD36是影响癌细胞扩散的关键因子,研究人员证实CD36对口腔癌、黑色素瘤、乳腺癌都促进转移。类似地,对病人样品的统计学分析结果揭示出卵巢癌、膀胱癌和肺癌转移也是依赖于CD36。研究人员通过挖掘公共数据库,发现许多人类癌症如膀胱、肺癌、乳腺癌高表达CD36与恶劣预后存在相关关系,这提示这些癌症也存在类似的情况。
近日,瑞士洛桑大学的研究小组取得一项新成果。他们发现阻断CD36后,肿瘤内的浸润的调节性T细胞减少,杀伤性T细胞则明显增加,从而抑制肿瘤的生长,同时免疫稳态并没有被破坏。不但如此,阻断CD36还可以和免疫治疗联合使用,进一步增强对肿瘤的杀伤。相关研究发表在了《自然·免疫学》杂志上。

在免疫系统中,杀伤性T细胞和调节性T细胞是一对背靠背的好搭档,在杀伤性T细胞对病原体和异常细胞大开杀戒的同时,是调节性T细胞保障它不会伤害健康组织。
我们知道,在恶性肿瘤中,肿瘤免疫抑制是肿瘤微环境的最重要特征之一,通过免疫抑制微环境,肿瘤细胞可以逃避机体免疫系统的识别和攻击,产生免疫逃逸。既往研究发现,杀伤性T细胞在肿瘤中的浸润会激活一些免疫调节机制,把调节性T细胞也招募到肿瘤中。这些调节性T细胞就会产生“叛变”,抑制了杀伤性T细胞杀灭肿瘤细胞。
如果能靶向性地抑制肿瘤中的调节性T细胞,是不是能让杀伤性T细胞提高抗肿瘤免疫能力,同时又不影响正常的免疫调节功能?
为了探索这个问题,首先就要知道调节性T细胞是如何在肿瘤微环境中安定地生存的。瑞士洛桑大学研究人员首先分析了一些乳腺癌患者的调节性T细胞的基因表达特征,并且比较肿瘤中浸润的和外周循环中的调节性T细胞的差异。
他们发现,这两类调节性T细胞的参与脂质代谢的基因表达差异很明显,其中就包括CD36。CD36是一种脂肪酸受体,负责脂肪酸的识别和细胞跨膜转运,CD36能帮助肿瘤细胞从周围环境中摄取脂肪分子,这些脂肪分子成为这些细胞转移的能量来源。在肿瘤浸润的调节性T细胞中,CD36的表达水平更高。

肿瘤内调节性T细胞脂质积聚及CD36表达增加
不仅仅是乳腺癌患者,研究人员在人肺癌细胞和黑色素瘤细胞体外模型,以及黑色素瘤和肠癌小鼠模型中都发现了这一现象。
在多种肿瘤模型中都发现了这一现象,说明这并不是一个偶然的事件,而是普遍存在的。接下来,研究人员对CD36表达水平的影响进行了研究。
他们构建了调节性T细胞特异性CD36缺陷型小鼠,来观察缺乏CD36是否会对免疫系统产生破坏。结果发现,缺少CD36也不会影响T细胞激活标志物,以及调节性T细胞的标志性分子Foxp3的表达。CD36对免疫系统稳态的维持不是必需的。
而肿瘤内促炎细胞因子干扰素-γ(INF-γ)和肿瘤坏死因子(TNF)的水平明显增加,这意味着,CD36的存在阻碍了CD36抑制肿瘤内调节性T细胞产生促炎细胞因子的能力。
除此之外,CD36的缺失不但影响了肿瘤内调节性T细胞的功能,还减少了它们在肿瘤中的聚集。荧光染色实验结果显示,CD36缺失并没有影响肿瘤内调节性T细胞的增殖,但是促进了细胞的凋亡。既往研究发现,线粒体与调节性T细胞的抑制功能和生存密切相关。
研究人员推测,肿瘤内调节性T细胞的CD36表达增加可能是通过调节线粒体适应性来响应肿瘤微环境,改变了代谢途径,帮助调节性T细胞更好地生存。随后的实验证明了他们的推测。
那么CD36是通过谁来调节线粒体代谢适应性的改变的呢?这究竟是哪个基因进行调控的呢?通过对比发现,肿瘤内调节性T细胞的参与PARP通路的基因表达增加,而CD36可以通过线粒体激活因子PARP-β和PARP-γ依赖性的方式增强对线粒体活性的调节,来改变代谢。
经过逐一实验,研究人员将目标锁定在了PARP-β上。PARP-β途径的激活使得肿瘤内调节性T细胞线粒体膜电位增加,凋亡减少,在不缺失CD36的情况下,PARP-β的激活还增强了CD36的表达,进一步提高了肿瘤内调节性T细胞的代谢适应。

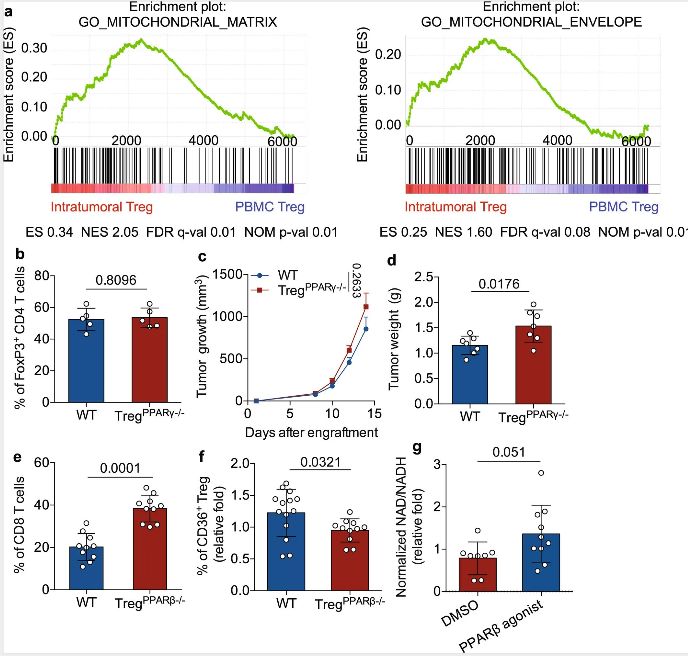
最后,为了验证抗癌效果,研究人员制作了靶向CD36的单克隆抗体,并对黑色素瘤小鼠进行了治疗。结果发现,肿瘤中调节性T细胞的水平降低,杀伤性T细胞的浸润增加,显著抑制了肿瘤的生长。
然而,肿瘤中杀伤性T细胞的耗竭也是常常出现的问题。单独抑制调节性T细胞可能是不够的,还需要一些额外的“助力”。研究人员尝试将CD36单克隆抗体和免疫治疗结合起来,同时使用阻断CD36和PD-1。
他们将小鼠分为四个小组:第一组是普通肿瘤小鼠(蓝),第二组是调节性T细胞CD36特异性缺失小鼠(红),第三组接受PD-1治疗的小鼠(黑),第四组为同时阻断CD36和PD-1治疗的小鼠(绿)。
结果发现,与其他三组相比,联合治疗对肿瘤细胞的杀伤力更为强劲,也延长了小鼠的生存期,超过50%的小鼠活过了28天。
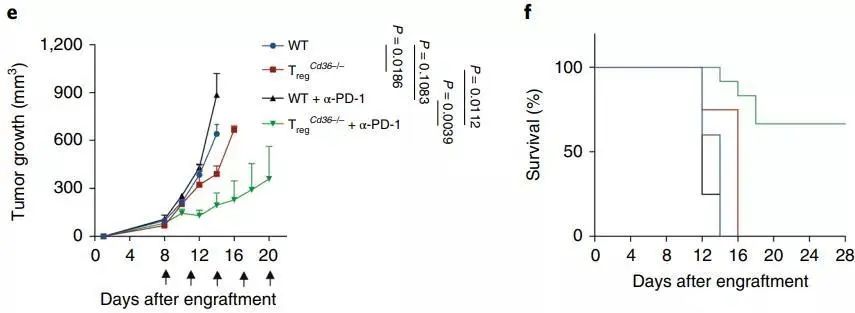
这项研究表明,CD36让肿瘤中的调节性T细胞在代谢方面异于其他调节性T细胞,使它们能更好地适应肿瘤微环境,抑制了杀伤性T细胞杀灭肿瘤细胞。靶向抑制CD36,则会令肿瘤中的调节性T细胞“弃暗投明”,这或许可以成为新的抗癌疗法或是辅助抗癌疗法。
作者:与癌共舞
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#阻断#
46
#Nat#
31
#CD36#
45