NGS检测胃癌HER2状态与IHC/FISH的一致性高达94.7%,且可预测抗HER2治疗反应
2024-08-24 苏州绘真医学 苏州绘真医学
本研究旨在阐明靶向肿瘤测序检测到的ERBB2 CNA与通过IHC和FISH评估的HER2状态之间的一致性,使用之前研究中的GC基因组图谱。
通过免疫组织化学(IHC)和荧光原位杂交(FISH)评估由ERBB2扩增(AMP)引起的HER2过度表达,对于治疗不可切除的转移性胃癌(GC)至关重要。靶向肿瘤测序检测可以全面评估癌症相关基因的变异,包括ERBB2。本研究旨在评估靶向肿瘤测序检测和IHC/FISH在检测HER2阳性GC方面的一致性,并阐明ERBB2 AMP和HER2下游通路(DP)中伴随的基因变异在不可切除的转移性GC患者的抗HER2治疗中的重要性。通过靶向肿瘤测序检测检查了152例福尔马林固定石蜡包埋(FFPE)GC组织中的ERBB2拷贝数变异(CNA)。将ERBB2 CNA与通过IHC/FISH评估的FFPE块切片中的HER2状态进行比较,这些切片与接受靶向肿瘤测序检测的切片相同。评估了11例不可切除转移性GC患者的抗HER2治疗结果。
15名患者(9.9%)通过靶向肿瘤测序检测到ERBB2 AMP(≥ 2.5倍变化),21名患者(13.8%)检测到HER2阳性(IHC 3 +或IHC 2+/FISH阳性)。ERBB2 CNA与HER2状态之间的总体一致性(OPA)、阳性一致性(PPA)、阴性一致性(NPA)和Cohen's kappa分别为94.7%、66.7%、99.2%和0.75。基于靶向肿瘤测序检测的ERBB2 AMP患者接受曲妥珠单抗治疗的无进展生存期明显长于未检测到ERBB2 AMP的患者(中位数为14个月 vs. 4个月,P = 0.007)。ERBB2 AMP和同时存在HER2 DPs中基因CNA的患者对曲妥珠单抗治疗的反应性降低。一名携带ERBB2 AMP和同时存在HER2 DPs中基因CNA的患者对作为四线疗法的德曲妥珠单抗获得了持久反应。
靶向肿瘤测序检测是识别HER2阳性胃癌的可靠方法。通过靶向肿瘤测序检测到的ERBB2 AMP和伴随的基因变异是曲妥珠单抗治疗反应的潜在指标。在胃癌精准医疗时代,靶向肿瘤测序检测已成为伴随诊断的合理候选方法,用于确定抗HER2治疗的适应症。
研究背景
尽管近年来诊断和治疗方法取得了进展,但胃癌(GC)仍然是全球第三大癌症死亡原因。内镜或手术切除疾病患者的预后相对可以接受。然而,无法切除的转移性疾病因其不良预后而臭名昭著,中位总生存期仅为17-18个月。目前已进行了许多大规模III期临床试验来开发分子靶向疗法。曲妥珠单抗是首个获批的分子靶向疗法,作为HER2阳性不可切除的转移性GC的一线治疗具有公认的疗效。因此,在治疗不可切除的转移性胃癌时,通过IHC评估HER2过表达和通过荧光原位杂交(FISH)评估ERBB2 AMP至关重要。
使用靶向肿瘤测序检测进行基因组分析在优化癌症治疗中起着重要作用。它可以在单次检测中全面评估基因变异,包括多个基因中的替换、插入和缺失(indel)、拷贝数变异(CNA)和基因重排,以及基因组特征,包括微卫星不稳定性(MSI)和肿瘤突变负荷(TMB)。因此,可以提供多种治疗选择,并且可以同时评估与治疗耐药性相关的基因变异。特别是GC是一种具有异质性分子背景的癌症,这被认为是迄今为止很少有分子靶向疗法在临床试验中有效的原因。总体而言,通过靶向肿瘤测序检测对个体患者进行基因组分析将有助于优化针对不可切除的转移性GC的分子靶向疗法。为此,需要阐明靶向肿瘤测序检测的ERBB2 CNA与曲妥珠单抗治疗的伴随诊断IHC和FISH确定的HER2状态之间的一致性。此外,阐明HER2下游通路(DP)中的基因变异与抗HER2治疗疗效之间的关联可能有利于优化GC的分子靶向治疗。
本研究旨在阐明靶向肿瘤测序检测到的ERBB2 CNA与通过IHC和FISH评估的HER2状态之间的一致性,使用之前研究中的GC基因组图谱。此外,研究者评估了ERBB2 AMP程度和HER2 DP中的基因变异与不可切除的转移性GC对抗HER2治疗反应之间的关联。
研究结果
根据HER2状态的ERBB2 CNA的倍数变化差异:
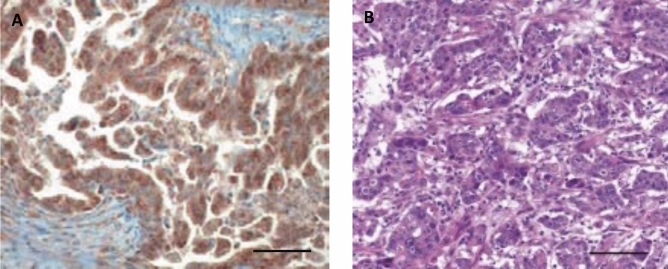
靶向肿瘤测序检测在152个肿瘤中检测到ERBB2 CNA,中位倍数变化(范围)为1.0(0.5-52.4),对应的log2倍数变化(范围)为0(-1.07-5.71)。研究者通过IHC和FISH评估了来自FFPE块的肿瘤组织切片中的HER2状态,这些切片与接受靶向肿瘤测序检测的切片相同(相同FFPE块分析,图1)。在21名患者 (13.8%) 的肿瘤中检测到HER2阳性 (IHC 3+或IHC 2+/FISH阳性),其中15名 (9.9%) 为IHC 3+,6名 (3.9%) 为IHC 2+/FISH阳性肿瘤。在其余131名患者 (86.2%) 的肿瘤中检测到HER2阴性 (IHC 2+/FISH阴性,IHC 1+或IHC 0),其中3名 (2.0%) 为IHC 2+/FISH阴性,37名 (24.3%) 为IHC 1+,91名 (59.9%) 为IHC 0肿瘤 (表1)。研究者根据HER2状态比较了ERBB2 CNA(图2A)。IHC 3+、IHC 2+/FISH阳性、IHC 2+/FISH阴性、IHC 1+和IHC 0肿瘤中ERBB2 CNA的log2倍数变化中位数(范围)分别为3.45(0.26-5.71)、0.85(0.77-2.43)、0(0-0.93)、0(0-2.05)和 0(-1.07-1.08)。根据HER2状态,ERBB2 CNA的倍数变化差异具有统计学意义(P < 0.001)。
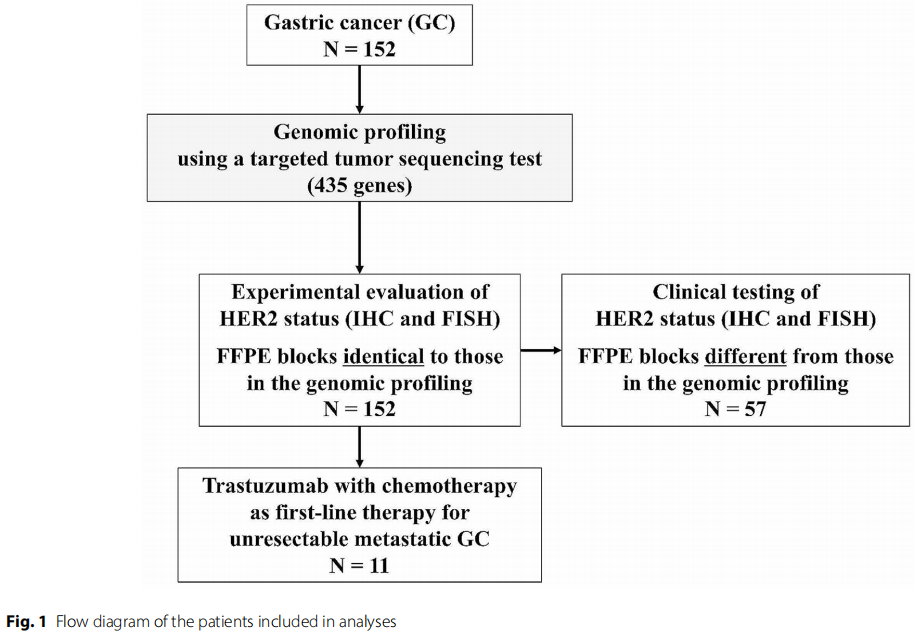
图1
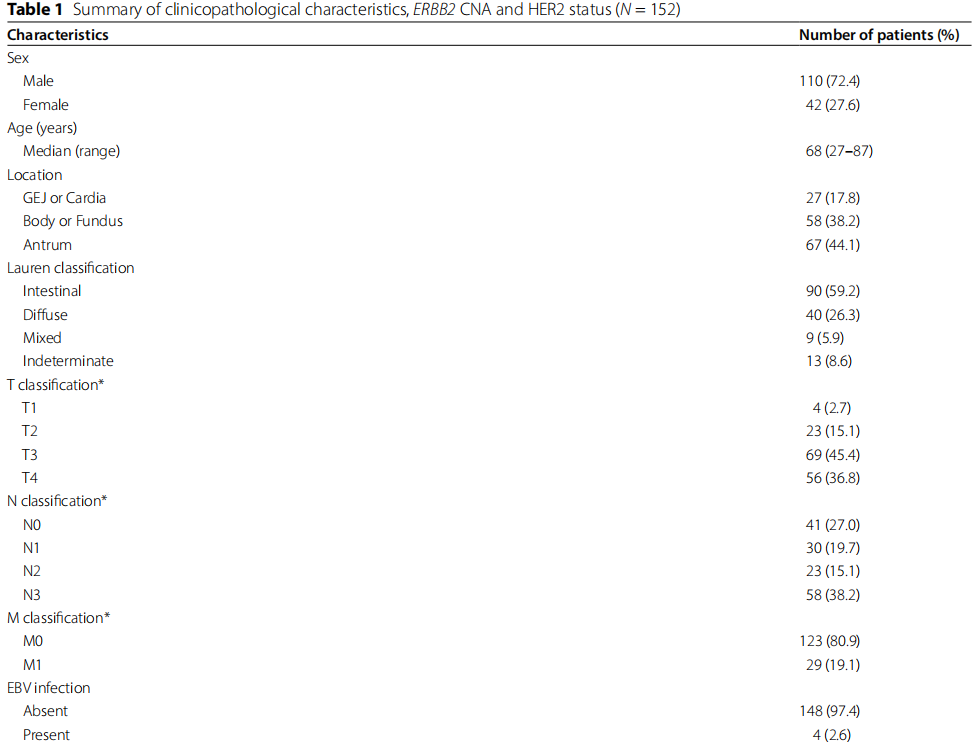


表1
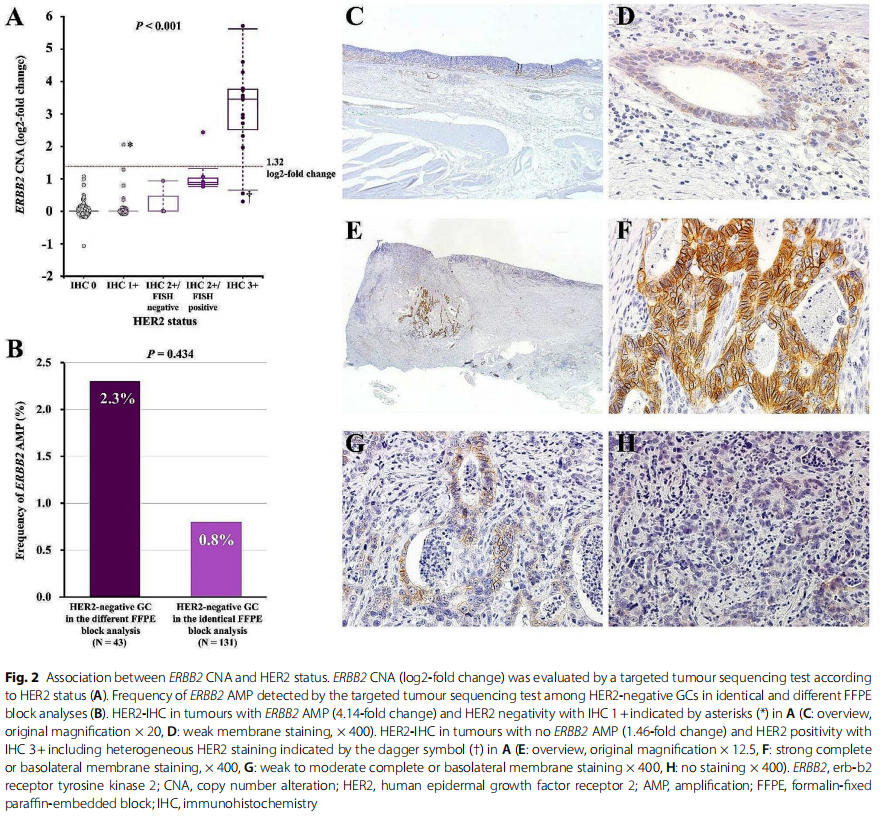
图2
通过靶向肿瘤测序检测评估ERBB2 CNA与HER2状态之间的一致性:
靶向肿瘤测序检测在15名患者(9.9%)的肿瘤中检测到ERBB2 AMP(> 2.5倍变化)。21名HER2阳性肿瘤患者中有14名有ERBB2 AMP,在相同的FFPE块分析中计算出PPA为66.7%(表2)。131例HER2阴性肿瘤患者中,130例未检测到ERBB2 AMP,在相同的FFPE块分析中计算出NPA为99.2%。在152例患者中,ERBB2 CNA和HER2状态之间获得一致和不一致结果的患者分别为144例(一致组)和8例(不一致组)。因此,计算出OPA为94.7%,与相同的FFPE块分析中的Cohen's kappa 0.75(95%CI,0.58-0.91)基本一致(表2)。在152名患者中,有57名患者的HER2状态信息通过临床试验评估,所用切片来自FFPE块,这与用于靶向肿瘤测序检测的切片不同(图1)。研究者评估了使用不同的FFPE块评估的ERBB2 CNA和HER2状态之间的一致性(不同的FFPE块分析,图1;表2)。57例患者中,14例(24.6%)为HER2阳性肿瘤,其中9例(15.8%)IHC 3+,5例(8.9%)IHC 2+/FISH阳性。其余43例(75.4%)为HER2阴性肿瘤,其中3例(5.3%)IHC 2+/FISH阴性,8例(14.0%)IHC 1+,32例(56.1%)IHC 0。不同FFPE块分析中的PPA和NPA分别为50.0%和97.7%。不同FFPE块分析中的OPA为86.0%,明显低于相同FFPE块分析(P =0.043)。在不同的FFPE块分析中,与Cohen's kappa值 0.56(95%CI,0.29-0.82)具有中等一致性。在相同的FFPE块分析中,HER2阴性GC中靶向肿瘤测序检测到的ERBB2 AMP频率为0.8%(131名患者中的1名),在不同的FFPE 块分析中为2.3%(43名患者中的1名)(P = 0.434,图2B)。
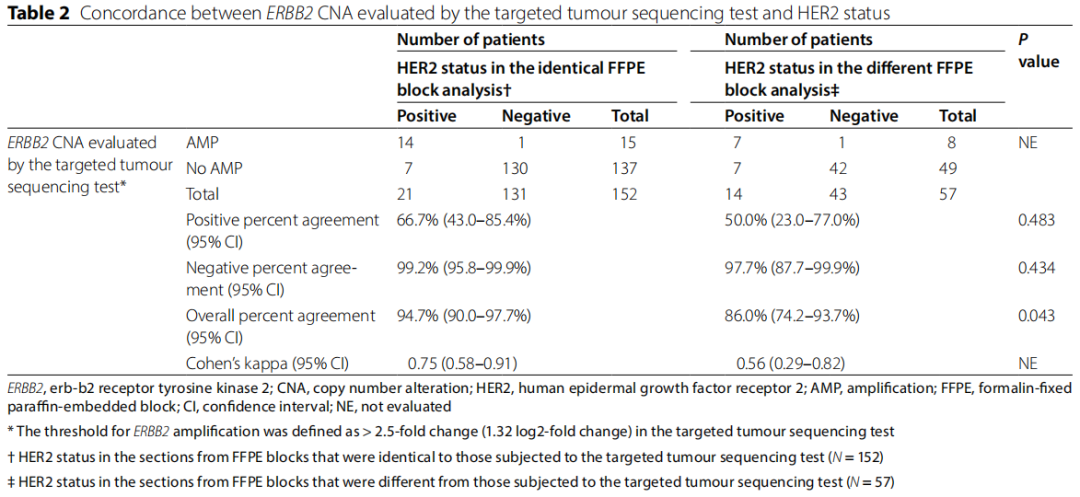
表2
与ERBB2 CNA和HER2状态不一致相关的临床病理特征:
通过相同的FFPE块分析,比较了ERBB2 CNA和HER2状态结果不一致的患者(不一致组,N=8)与结果一致的患者(一致组,N=144)的临床病理特征(表3)。关于HER2状态,不一致组中IHC 2+/FISH阳性肿瘤的比例明显高于一致组(62.5% vs. 0.7%,P < 0.001)。其他临床病理特征在两组之间无显著差异(表3)。不一致组中ERBB2 CNA和HER2状态的详细信息见表4。具有ERBB2 AMP(4.14倍变化)和HER2阴性的肿瘤为IHC 1+(图2C和D)。另一方面,没有ERBB2 AMP(1.46倍变化)和HER2阳性的肿瘤为IHC 3+,具有异质性HER2染色,包括弱至中度完全或基底侧膜染色和无染色(图2E和H)。
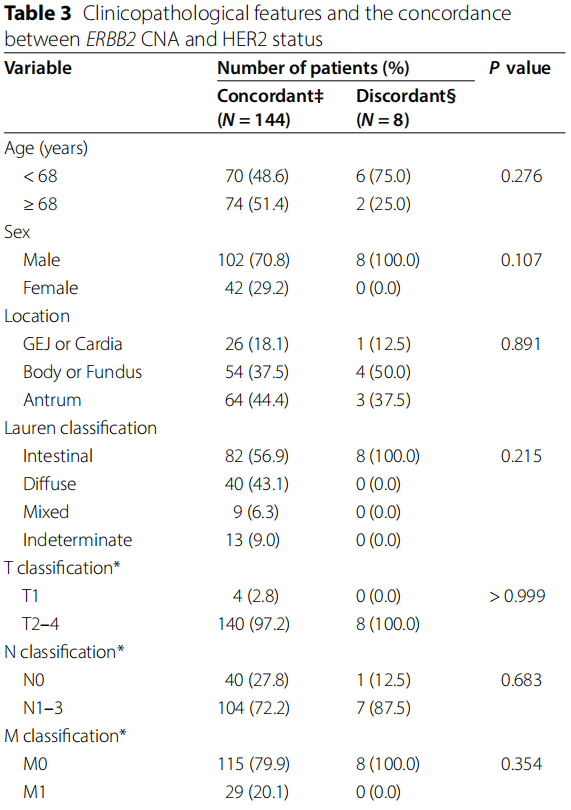
表3
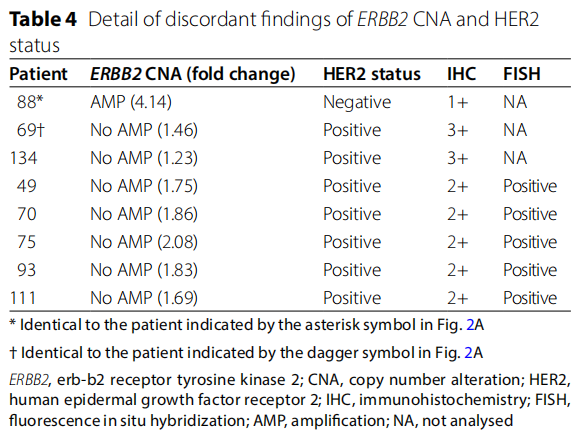
表4
抗HER2治疗的肿瘤反应与靶向肿瘤测序检测到的基因变异:
在152名患者中,11名患有不可切除的转移性GC患者接受了曲妥珠单抗联合化疗。分别从8名患者和3名患者中获取了曲妥珠单抗治疗前和治疗后接受靶向肿瘤测序检测的肿瘤样本。图3A显示了每位具有基因变异患者的最佳总体反应瀑布图。在7名肿瘤显示ERBB2 AMP和IHC 3+的患者(编号4-8、10和11)中,6名患者(编号5-8、10和11)在曲妥珠单抗治疗后获得PR。另一方面,2名肿瘤无ERBB2 AMP但IHC 3+或IHC 2+/FISH阳性(不一致)的患者(编号1和2)对曲妥珠单抗治疗无反应,这被定义为PD。ERBB2 AMP患者曲妥珠单抗治疗的ORR为85.7%,无ERBB2 AMP患者曲妥珠单抗治疗的ORR为0%(P = 0.015)。此外,ERBB2 AMP患者的PFS明显优于无ERBB2 AMP的患者(中位数14个月 vs. 4个月,P = 0.007;图3B)。在所有11名患者中均检测到了HER2 DP的基因变异,包括4名患者的突变(错义、同框或移码)、2名患者的CNA以及5名患者的突变和CNA(图3A)。3名患者(编号6-8)在接受曲妥珠单抗治疗前,肿瘤样本中存在ERBB2 AMP和无CNA,对治疗有显著反应。相反,两名患者(编号4和5)的治疗反应减弱,肿瘤中存在ERBB2 AMP且伴有HER2 DP的CNA。存在ERBB2 AMP但不伴有HER2 DP CNA的患者未达到中位PFS;ERBB2 AMP和CNA的患者为14个月,无ERBB2 AMP的患者为4个月(P = 0.019,图3B)。一名患者(图3A中编号4) 存在ERBB2 AMP且伴有HER2 DP的CNA,对德曲妥珠单抗(T-Dxd)取得了持续27个月的持久反应(图3C)。该患者根治性胃切除术后,根据手术标本中HER2阳性IHC 3+,一线治疗为曲妥珠单抗联合S-1加顺铂治疗主动脉旁淋巴结转移。曲妥珠单抗治疗总体反应最好为SD,随后雷莫芦单抗联合紫杉醇作为二线治疗,纳武利尤单抗作为三线治疗,四线治疗为T-Dxd治疗主动脉旁淋巴结转移及腹膜播散。治疗8个月后靶病灶获得PR,继续T-Dxd治疗直至27个月时病情进展包括腹膜播散(图3C)。曲妥珠单抗治疗前样本的靶向肿瘤测序检测显示ERBB2 AMP(52.4倍变化),同时存在CDK6和MYC AMP、CDKN2A和CDKN2B DEL、MAP2K4 DEL、MTOR和PTEN错义突变以及JAK2框内突变(图3A中的编号4)。
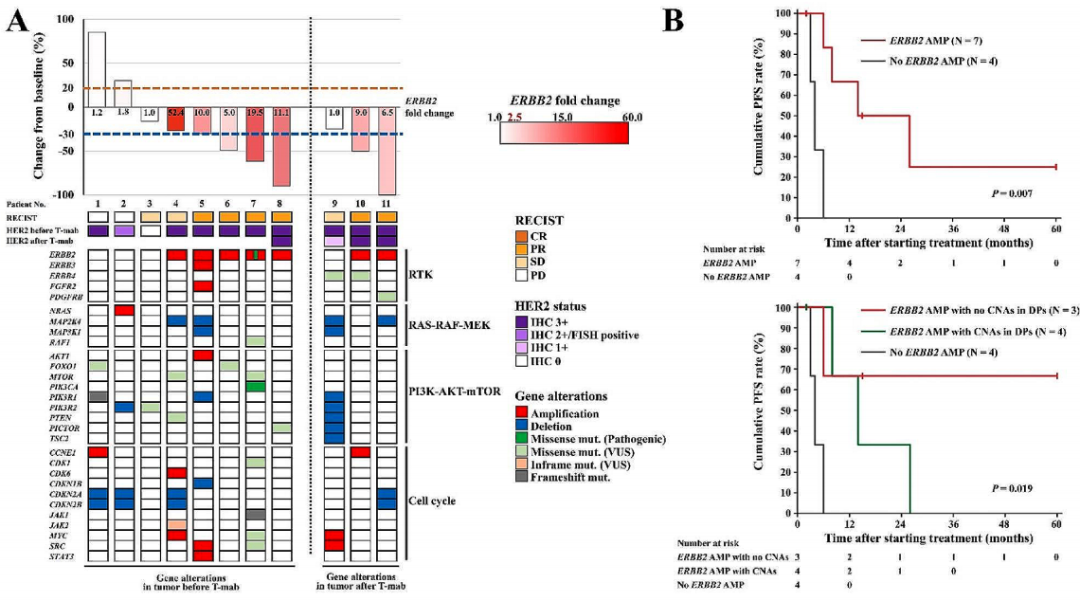

图3
讨 论
目前,胃癌的精准医疗尚处于起步阶段,针对HER2阳性胃癌(一种可进行分子靶向治疗的可干预亚型)的靶向肿瘤测序检测的临床意义尚不清楚。这项研究阐明了靶向肿瘤测序检测在确定胃癌的HER2状态方面的高准确性。此外,与相同的组织块分析相比,通过靶向肿瘤测序检测确定的ERBB2 CNA与通过IHC和FISH评估的HER2状态之间的一致性在不同的组织块分析中明显降低。此外,通过靶向肿瘤测序检测,ERBB2 CNA成为曲妥珠单抗治疗反应和无进展生存期的有希望的指标。HER2 DP中的CNA也可能在赋予曲妥珠单抗治疗耐药性方面发挥作用。总的来说,本研究结果表明,使用靶向肿瘤测序检测可以作为一种有价值的工具,用于表征胃癌的分子亚型,并优化分子靶向治疗不可切除转移性胃癌的主要治疗方法。
靶向肿瘤测序检测在确定HER2阳性GC方面的稳健性是GC精准医疗的关键方面。据报道,通过全球公认的靶向肿瘤测序检测Foundation One CDx确定的ERBB2 CNA与通过IHC或ISH评估的HER2状态(作为抗 HER2 治疗的伴随诊断工具)之间的OPA为87.5%。纪念斯隆凯特琳癌症中心设计的MSK-IMPACT在类似评估中的一致率为93.7%,阳性预测值为90%,阴性预测值为96.9%。这些调查主要涵盖美国的GC患者队列。在本次调查中,研究者证明了日本GC患者队列中ERBB2 CNA和HER2状态之间的高OPA和Cohen's kappa。用于识别ERBB2 CNA的靶向肿瘤测序检测可靠地证实了HER2阳性GC是抗HER2治疗的强有力指征,无论地理区域如何。
在本研究中,通过靶向肿瘤测序检测确定的ERBB2 CNA与通过IHC和FISH评估的HER2状态之间的NPA高达99.2%。同样,在使用Foundation One CDx的调查中,NPA报告为98.4%。这些发现表明,当panel检测确定ERBB2 AMP时,可以明确确认患者患有HER2阳性GC。相反,本研究中的PPA低于NPA,与使用Foundation One CDx的调查结果相似。较低的PPA表示假阴性比例较大。如表4所示,大多数ERBB2 CNA呈现假阴性的患者为HER2阳性GC,且IHC 2+/FISH阳性。对于HER2状态为IHC 3+但ERBB2 CNA呈假阴性的患者,发现肿瘤组织的IHC评分存在明显的异质性。对ToGA研究进行亚组分析后,未观察到曲妥珠单抗在IHC 2+/FISH阳性的HER2阳性GC中具有统计学上显著的附加效应。HER2 IHC评分的异质性与曲妥珠单抗治疗反应不佳有关。Foundation One CDx 假阴性结果的患者在一线曲妥珠单抗治疗后,治疗停止时间和总生存期更短。本研究中使用的靶向肿瘤测序检测的ERBB2 CNA阈值由分析流程的开发人员确定,并使用细胞系和未指明的临床样本验证了ERBB2 CNA的检测。尽管降低检测的阈值可能会识别出假阴性病例,但这种调整并不适用于选择曲妥珠单抗治疗的候选人。在本研究中,与无ERBB2 AMP相比,ERBB2 AMP与曲妥珠单抗治疗的更好PFS和更高的ORR相关。此外,一些报告证明,通过使用NGS的拷贝数分析确定的ERBB2 AMP与曲妥珠单抗治疗的更良好预后相关。通过靶向肿瘤测序检测评估ERBB2 CNA有利于识别可能对曲妥珠单抗治疗表现出良好反应的患者。然而,ERBB2 CNA用于预测接受曲妥珠单抗治疗的患者预后的最佳阈值仍未确定。先前的研究表明,ERBB2连续拷贝数升高与PFS延长显著相关,与本研究中使用的阈值相比,更高的ERBB2 CNA阈值已证明有利于接受曲妥珠单抗治疗的患者的预后分类。进一步探索旨在确定能够预测曲妥珠单抗治疗疗效的最佳阈值,特别是对于GC患者,这将促进针对不可切除的转移性疾病的抗HER2治疗。
选择FFPE块进行分子检测对于GC至关重要,因为GC表现出广泛的肿瘤内分子背景异质性。在本研究中,研究者还检查了57名患者的ERBB2 CNA和HER2状态之间的一致性,这些患者使用不同的FFPE块进行HER2状态评估,作为常规临床实践。不同FFPE块中ERBB2 CNA和HER2状态之间的OPA低于相同FFPE块中的OPA。使用Foundation One CDx的检查也报告了56.2%的低PPA,这归因于不同的病理实验室使用不同于靶向肿瘤测序检测的样本进行IHC和ISH。这意味着由于GC中分子背景的肿瘤内异质性,HER2表达在组织块之间有所不同。先前接受过治疗的IHC和FISH结果为阴性的HER2阴性GC患者,在随后的靶向肿瘤测序检测中显示ERBB2 AMP,可能会从额外的抗HER2治疗选择中获益。然而,在本研究中,HER2阴性肿瘤中相同FFPE块和不同FFPE块之间的ERBB2 AMP检测频率没有显著差异。换句话说,即使选择与用于HER2检测的FFPE块不同的FFPE块作为靶向肿瘤测序检测的样本,也有可能为之前接受过HER2阴性治疗的患者提供抗HER2治疗的机会。在选择用于靶向肿瘤测序检测的标本时,没有什么比FFPE块更重要的了,FFPE块应该肿瘤占比高,以便提取足够的肿瘤衍生DNA。
曲妥珠单抗治疗耐药的分子机制包括HER2以外的受体酪氨酸激酶的AMP和HER2 DP内的基因变异,例如PI3K-AKT-mTOR和MAPK通路。基于NGS的肿瘤测序检测针对多个基因,有助于同时评估这些通路内的基因变异。在本研究中,HER2 DP中显示CNA的患者对曲妥珠单抗治疗的反应率降低,PFS较差。先前的一些研究表明,通过NGS在GC中识别的HER2 DP中的突变和CNA与曲妥珠单抗治疗耐药有关,证实了本研究的结果。遗憾的是,对于HER2 DP发生基因变异的HER2阳性GC患者,仍未找到明确的治疗策略。对于曲妥珠单抗耐药GC,一种潜在有效的抗癌药物是T-Dxd,它是一种抗体-药物偶联物,由人源化单克隆抗HER2抗体、可酶切的肽基连接子和新型细胞毒性拓扑异构酶I抑制剂组成。DESTINY-Gastric01试验证明,对于接受曲妥珠单抗治疗后病情仍有进展的HER2阳性GC,T-Dxd作为三线或后续治疗,与标准化疗相比具有显著的预后优势。如图3C所示,一名HER2 DP基因变异患者,在接受曲妥珠单抗治疗后,以T-Dxd作为第四线疗法,取得了持久的治疗反应并延长了治疗时间。正在进行的DESTINY-Gastric03试验正在评估T-Dxd与抗癌药物和免疫检查点抑制剂联合作为一线疗法的疗效和安全性。因此,T-Dxd具有显著的治疗效果,独立于潜在的曲妥珠单抗耐药,有望成为HER2阳性GC的关键抗癌药物。
这项研究有几个局限性。本研究中使用的靶向肿瘤测序检测尚未获得全球临床应用批准。通过临床上可用的测序检测(如 Foundation One CDx 或 OncoGuide NCC Oncopanel)识别HER2阳性GC的真实世界功效,应使用日本的高质量临床和测序数据集进行评估。在入组患者中,接受曲妥珠单抗治疗的患者人数仅为11人。三名患者在曲妥珠单抗治疗后发现的基因变异无法区分它们是在治疗前存在还是在治疗后获得。此外,研究者尚未通过体外或体内实验证明HER2 DP中的基因变异与曲妥珠单抗治疗耐药性有关。研究者无法得出明确的结论,即ERBB2 AMP或HER2 DP中的基因变异与曲妥珠单抗治疗反应或患者预后有关,还需要进一步调查和验证研究。尽管如此,研究者相信这项研究的结果可以作为胃癌领域精准医疗进一步发展的基础。
靶向肿瘤测序是检测HER2阳性胃癌的可靠方法。通过靶向肿瘤测序检测到的ERBB2 AMP和伴随的基因变异是评估曲妥珠单抗治疗反应的潜在指标。在胃癌精准医疗时代,靶向肿瘤测序检测已成为确定抗HER2治疗适应症的伴随诊断的合理候选方法。
参考文献:
Ichikawa H, Usui K, Aizawa M, et al. Clinical application of targeted tumour sequencing tests for detecting ERBB2 amplification and optimizing anti-HER2 therapy in gastric cancer. BMC Cancer. 2024;24(1):719. Published 2024 Jun 11. doi:10.1186/s12885-024-12482-5

作者:苏州绘真医学
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#胃癌# #HER2# #NGS#
0