细数基因疗法在6大领域的突破
2018-01-09 佚名 生物探索
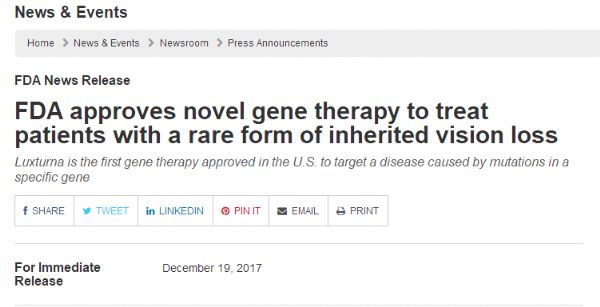
2017年,可以称得上是基因疗法“厚积薄发”的一年:美国先后批准两款CAR-T疗法、首款“靶向遗传学眼疾突变”的基因疗法;NEJM、Nature上多篇文章揭示基因疗法打破疑难杂症治疗难题,包括癌症、血友病、遗传性视网膜病变、脊髓性肌萎缩症等。
作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








学习了谢谢分享!!
61
学习了受益匪浅
55
henhao
51
学习谢谢分享
49