Science Translational Medicine:低剂量放射性核素靶向治疗,让冷肿瘤变热,提高免疫疗法响应
2021-07-22 “E药世界”公众号 “E药世界”公众号
2021年7月14日,来自匹兹堡大学医学院和威斯康星大学麦迪逊分校的研究团队在 Science Translational Medicine 期刊发表了题为:Low-dose targeted rad
以免疫检查点抑制剂为代表的癌症免疫疗法,通过加强患者的免疫系统从而对抗癌症,彻底改变了癌症治疗现状。但是,一些患者对当前的免疫疗法产生抗药性,而另一些患者则患有以免疫学“冷肿瘤”为特征的癌症,这些肿瘤逃避或抑制了患者对癌细胞免疫反应。
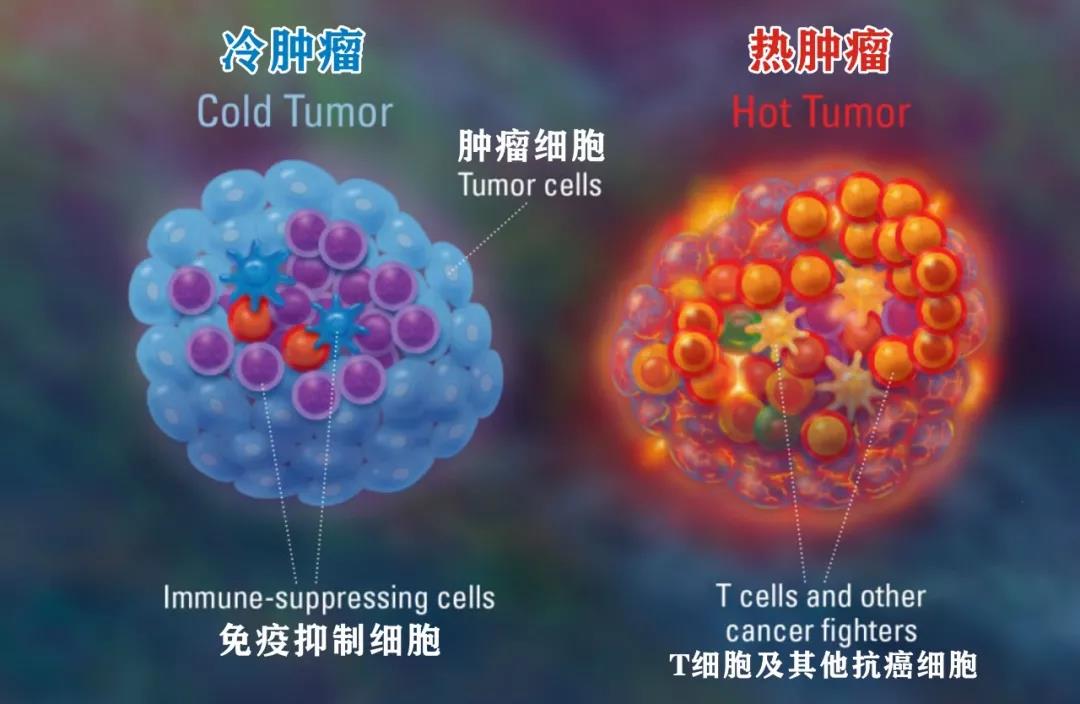
热肿瘤:肿瘤组织附近已经聚集了不少免疫细胞,免疫细胞已经在这里跟癌细胞发生过殊死搏斗,然而,道高一尺魔高一丈,癌细胞占据了上风,但是,胜负仍未尘埃落定,战场依然“火热”。
冷肿瘤:与热肿瘤相对,肿瘤组织中没有或者只有很少的免疫细胞,这里免疫细胞未曾与癌细胞战斗过,战场甚至没能点燃。
在冷肿瘤情况下,肿瘤学家开发了外放射治疗(EBRT)。进行EBRT的患者会被放置在经过精心校准的机器中,辐射束直接对准肿瘤区域。EBRT可以帮助将“冷肿瘤”或抗性肿瘤转变为“热肿瘤”,使其对免疫疗法敏感。
对于癌症已经转移或扩散到身体其他部位的患者,EBRT通常无法照射到所有肿瘤部位,因为远处的肿瘤可能太小、太多且弥散,以至于患者无法耐受如此多的辐射。在这些情况下,放射性核素靶向治疗(TRT)可能是一种选择。这种治疗方法使用一种放射性元素,该元素与癌症靶向分子相连,并通过静脉输注给药,将辐射直接传递给癌细胞。然而,随机临床试验尚未证明这种治疗方法是否能增加转移性肿瘤中免疫检查点抑制剂的全身反应。
2021年7月14日,来自匹兹堡大学医学院和威斯康星大学麦迪逊分校的研究团队在 Science Translational Medicine 期刊发表了题为:Low-dose targeted radionuclide therapy renders immunologically cold tumors responsive to immune checkpoint blockade 的研究论文,该论文也是当期封面论文。
不同于传统观念认为的那样,需要超大剂量的辐射才能杀死癌细胞。该研究低剂量放射性核素靶向治疗与免疫检查点疗法相结合,成功触发了免疫系统来杀死癌细胞,根除了小鼠转移性癌。该方法在犬实验中被证明十分安全,未来有可能应用于临床实践中。

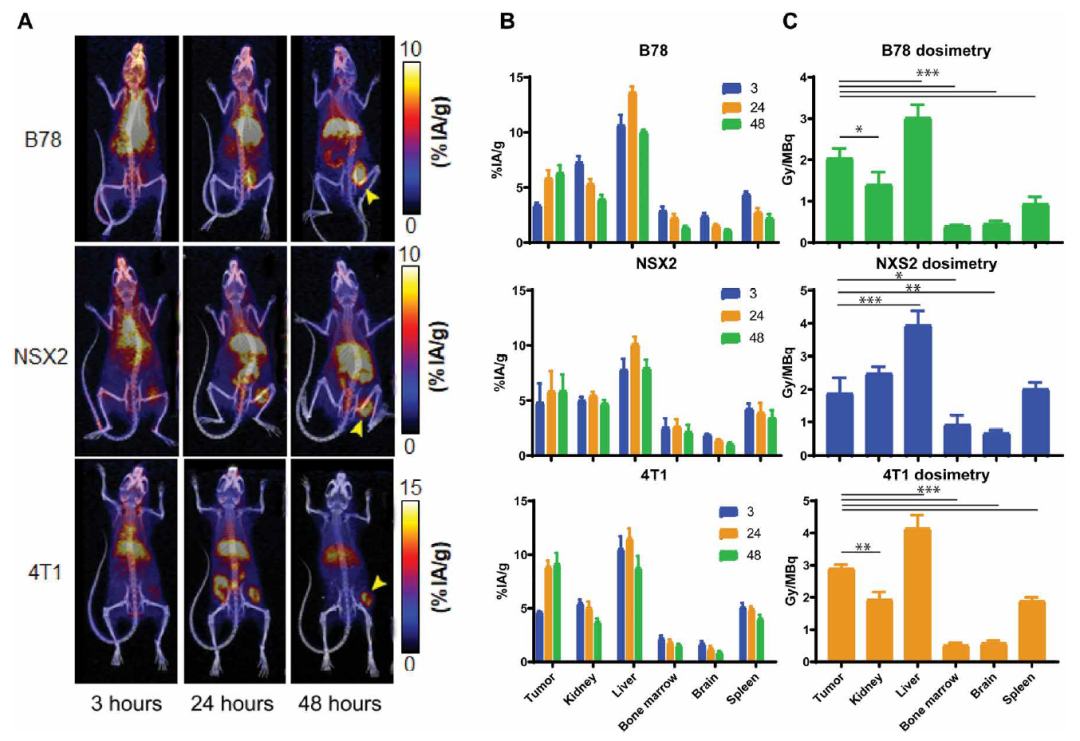
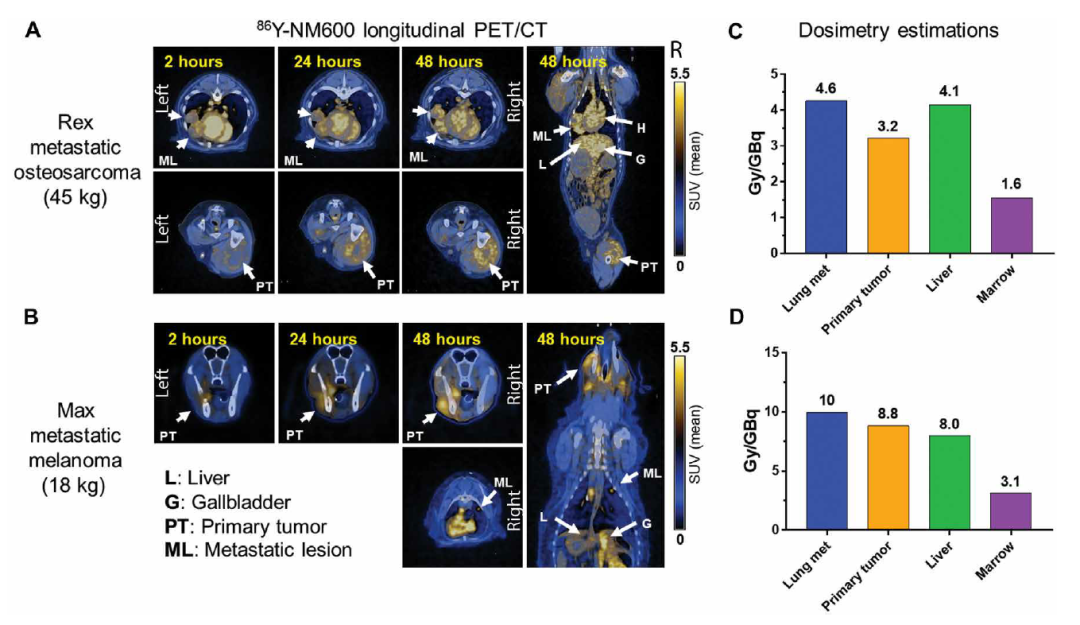
首先,研究团队在静脉注射86Y-NM600(一种治疗性TRT,能够螯合放射性金属,并将其传送到肿瘤,用于诊断成像或放射治疗)后3、24、48小时,使用PET/CT成像评估了三中小鼠肿瘤和正常组织中NM600的摄取。他们发现,与其他正常组织相比,肿瘤中摄取和滞留量随时间增加。
接下来,研究团队使用小剂量90Y-NM600联合免疫检查点疗法评估抗肿瘤功能。与单独使用90Y-NM600或抗CTLA-4相比,小剂量90Y-NM600联合抗CTLA-4治疗后抗肿瘤反应显着改善,生存期增加。当联合了双抗(抗CTLA-4和抗PD-L1)后,肿瘤小鼠出现了完全且持久的无肿瘤期。
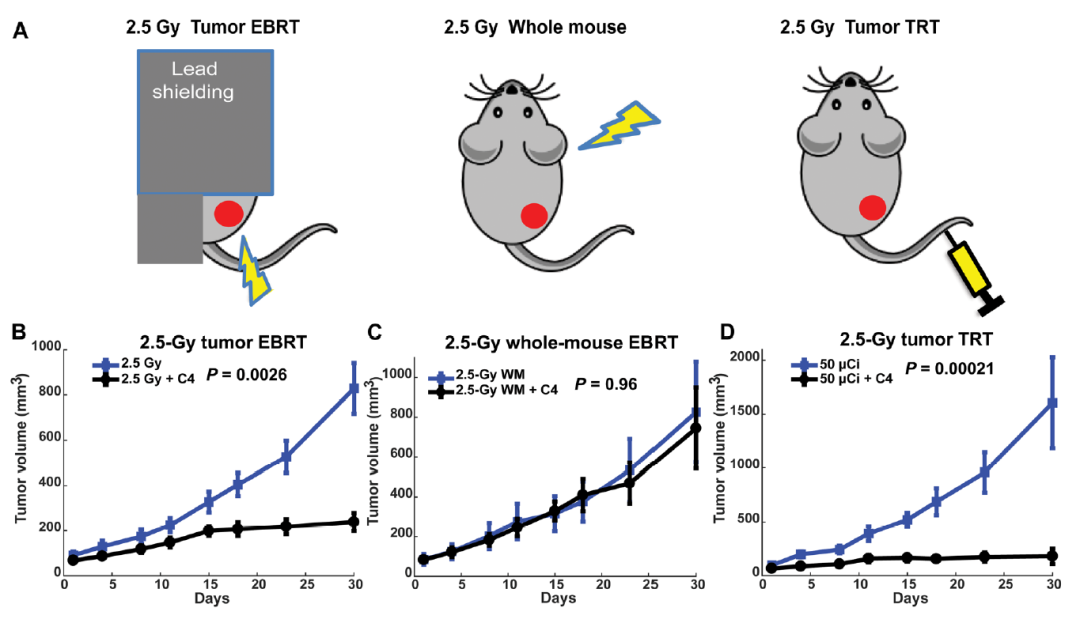
虽然EBRT可以将低剂量的辐射安全地传送到大范围或全身,但这会导致系统淋巴细胞衰竭和系统免疫抑制,从而阻碍抗肿瘤免疫的发展。因此,研究团队比较了通过靶向EBRT、全鼠EBRT或系统递送90Y-NM600对肿瘤的治疗效果。结果提示,联合免疫检查点抑制剂的低剂量肿瘤靶向EBRT或系统递送90Y-NM600显着增强了肿瘤应答,这种反应依赖于T细胞,表明肿瘤对90Y-NM600 +ICI的反应是辐射和T细胞依赖性的。
由于大型动物更接近于联合方法在人类临床转化时所处的环境,研究团队在患有广泛的转移性骨肉瘤和转移性黑色素瘤犬只身上测试了90Y-NM600治疗肿瘤的可行性和安全性。他们在实验室检测中没有观察到有临床意义的变化,包括碱性磷酸酶值和中性粒细胞、淋巴细胞、血小板和红细胞计数,表明这种低剂量辐射联合ICI疗法具有一定的安全性。
总的来说,该研究开发了一种使用90Y-NM600将低剂量辐射安全递送到实体肿瘤和任何潜在转移性肿瘤中的方法。这种方法可以调节免疫微环境,从而促进“冷肿瘤”对免疫检查点抑制剂的应答,延长总生存期,未来非常有希望应用于临床实践中。
原始出处:
Ravi B. Patel, et al. Low-dose targeted radionuclide therapy renders immunologically cold tumors responsive to immune checkpoint blockade.Science Translational Medicine 14 Jul 2021: Vol. 13, Issue 602, eabb3631. DOI: 10.1126/scitranslmed.abb3631.
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#Translation#
50
#translational#
59
#Transl#
46
#DIC#
30
#TRA#
40