ASCO 2021:摘要概览与展望20 |非小细胞肺癌专题研究速递(03)
2021-06-02 Oranhgy MedSci原创
美国临床肿瘤学会(ASCO)年度会议将在2021年6月4日至8日举行,国内外诸多顶级研究成果即将公布。在大会揭幕之前,已有科学人员开始宣布临床研究摘要以及报告的计划。梅斯医学将持续关注并报道学术亮点,
美国临床肿瘤学会(ASCO)年度会议将在2021年6月4日至8日举行,国内外诸多顶级研究成果即将公布。在大会揭幕之前,已有科学人员开始宣布临床研究摘要以及报告的计划。梅斯医学将持续关注并报道学术亮点,分享给各位同道。
肺癌专题汇总:
ASCO 2021 :摘要概览与展望14|非小细胞肺癌专题研究进展速递(02)
ASCO 2021:摘要概览与展望13|非小细胞肺癌专题研究速递(01)
ASCO 2021: 摘要概览与展望 4|小细胞肺癌领域研究速递
第一、第二和第三代间变性淋巴瘤激酶 (ALK) 抑制剂在非小细胞肺癌脑转移 (NSCLCBM) 中的结果
背景:非小细胞肺癌 (NSCLC) 是脑转移的最常见原因。编码酪氨酸激酶受体的 ALK 在 4-7% 的 NSCLC 中发生重排。由于血脑屏障 (BBB) 渗透性差和 ALK 抗性肿瘤突变,第一代 ALK 抑制剂的疗效受到限制。第二代 ALK 抑制剂显示出更好的 BBB 渗透性,而第三代 ALK 抑制剂甚至对 ALK 抗性突变也有效。
在这项回顾性研究中,调查了接受第一代、第二代和第三代 ALK 抑制剂治疗的 NSCLCBM 患者的总生存期 (OS) 和无进展生存期 (PFS)。
方法:评估了 2010 年至 2019 年间的 NSCLCBM 患者。分析有关分子标记状态、全身治疗和进展日期的数据。OS 定义为系统治疗的开始日期到最后一次随访或死亡的日期。Cox 比例模型用于估计 OS 和 PFS。
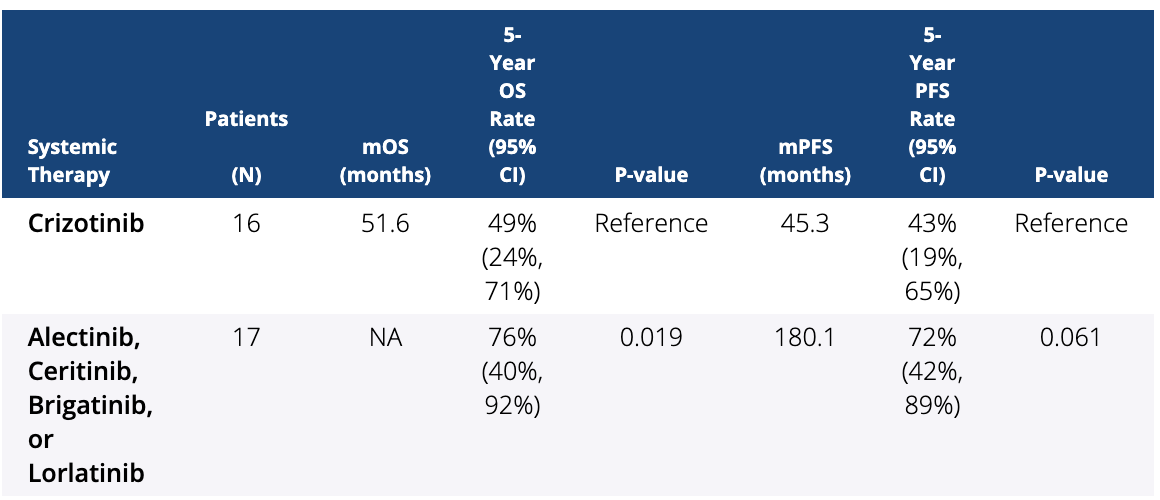
结果:共有 90 名患者有 ALK 基因重排。16 名 ALK 阳性患者接受了第一代 ALK 抑制剂(克唑替尼),中位年龄为 59.2 岁,50% 的队列为女性,83.3% 为白人。另外 17 名患者接受了第二代(艾乐替尼、色瑞替尼、布加替尼)和第三代 ALK 抑制剂(劳拉替尼),中位年龄为 52.2 岁,队列中女性患者占 52.6%,白人患者占 72.2%。第一代 ALK 抑制剂的 5 年 OS 率为 49%(95% 置信区间 (CI) = 24%、71%),第二代和第三代为 76%(95% CI = 40%、92%) ALK 抑制剂(p 值 (p) = 0.019)。接受第一代 ALK 抑制剂治疗的患者的中位 PFS (mPFS) 为 45.3 个月,接受第二代或第三代 ALK 抑制剂治疗的患者的中位 PFS (mPFS) 为 180.1 个月。
结论:NSCLCBM 中的新一代靶向治疗提高了 BBB 渗透率和抗耐药突变的有效性。我们确定,与第一代 ALK 抑制剂相比,接受第二代和第三代 ALK 抑制剂的患者有显着的 5 年 OS 获益,并且与第一代相比,新一代 ALK 抑制剂具有显着 PFS 获益的趋势。一代。这些结果令人鼓舞,但未来应检查对颅内病变大小和反应率的影响。
详情参见:第一、第二和第三代间变性淋巴瘤激酶 (ALK) 抑制剂在非小细胞肺癌脑转移 (NSCLCBM) 中的结果
第一代与第三代表皮生长因子受体 (EGFR) 抑制剂在脑转移非小细胞肺癌 (NSCLCBM) 中的结果
背景:非小细胞肺癌 (NSCLC) 是脑转移的最常见原因,10-30% 的患者发生脑转移。EGFR 是一种跨膜糖蛋白,在多达 50% 的 NSCLC 中发生突变。第一代 EGFR 酪氨酸激酶抑制剂 (TKI),如厄洛替尼和吉非替尼,受到血脑屏障 (BBB) 穿透和外显子 20 (T790M) 肿瘤突变的限制。第三代 EGFR TKI,如奥希替尼,已显示出更好的 BBB 渗透性和对抗 T790M 突变的功效。在这项回顾性研究中,我们评估了接受第一代和第三代 EGFR TKI 治疗的 NSCLCBM 患者的总生存期 (OS) 和无进展生存期 (PFS)。
方法:对 2010 年至 2019 年在我们三级医疗中心诊断的 NSCLCBM 患者进行了调查。收集了有关分子标记状态、全身治疗和进展日期的信息。OS 定义为系统治疗的开始日期到最后一次随访或死亡的日期。OS 和 PFS 由 Cox 比例模型估计。
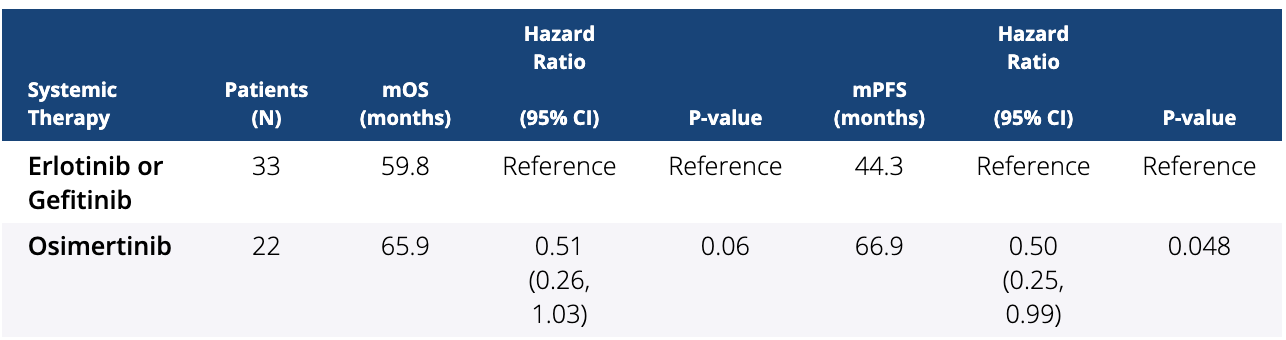
结果:共鉴定出 193 名具有 EGFR 突变的 NSCLCBM 患者。33例EGFR突变患者接受了第一代EGFR TKI治疗,其中56.7%为女性,82.1%为白人,中位年龄为63.2岁。22 名患者接受了第三代 EGFR TKI,其中 64.1% 为女性,76.9% 为白人,中位年龄为 71.5 岁。接受第一代和第三代 EGFR TKI 的患者的中位 OS (mOS) 分别为 59.8 个月和 65.9 个月(p 值 (p) = 0.06)。第一代和第三代 EGFR TKI 队列的中位 PFS (mPFS) 分别为 44.3 个月和 66.9 个月(p = 0.048,风险比 (HR) = 0.50(95% 置信区间 (CI) = 0.25, 0.99)。
结论:NSCLCBM 的新一代靶向治疗专注于克服以前的疗效障碍,包括 BBB 渗透和耐药突变。我们确定,与厄洛替尼或吉非替尼相比,奥希替尼具有显着的 mPFS 益处,并且在 NSCLCBM 患者中,与厄洛替尼或吉非替尼相比,奥希替尼具有显着 mOS 益处的趋势。然而,由于治疗选择偏倚,应谨慎解释这些结果,需要对脑转移病灶大小和反应率进行进一步研究。
第一代和第三代 EGFR TKI 的结果
详情参见:第一代与第三代表皮生长因子受体 (EGFR) 抑制剂在脑转移非小细胞肺癌 (NSCLCBM) 中的结果。
EGFR突变型非小细胞肺癌脑转移不同一线治疗的疗效和临床生存结局
背景:脑转移是肺癌预后不良的最重要因素之一,EGFR突变(m+)晚期NSCLC脑转移发生率较高。第一代 EGFR TKI 是标准的一线治疗。本研究的目的是探索EGFRm+ NSCLC脑部病变的最佳治疗方法,并找出影响生存结果的相关因素。
方法:回顾性分析NSCLC脑转移患者的临床资料。所有患者均接受第一代EGFR TKI治疗,患者分为4组,A组:EGFR TKI单药治疗,B组:EGFR TKI加化疗(CT),C组:EGFR TKI加贝伐珠单抗,D组:EGFR TKI加CT加贝伐单抗。分析颅内和颅外病变的疗效和生存结果。
结果:共筛选了2017年12月至2020年5月的584例EGFRm+晚期NSCLC患者,其中228例(39%)在初治时有基线脑转移。其中,194pts有完整的病历和随访资料。在随访日期(2021 年 1 月 1 日),147 人出现疾病进展,78 人死亡。A、B、C、D组颅内PFS分别为11.1m(n = 97)、11.3m(n = 59)、21.2m(n = 19)和18.9m(n = 19)。A组与B组无差异(P=0.745),C组与D组无差异(P=0.684),但C+D组(联合贝伐珠单抗)颅内PFS显着长于A+B组( 11.3m (95%CI 12.2-14.8) vs 21.0m (95%CI 15.2-22.7),P = 0.007。A、B、C、D组颅外PFS分别为11.0m、14.3m、21.7m、和 18.9m,P 值分别为 0.006、0.002 和 0.011,分别与A组比较。A、B组的mOS分别为27.8m和24.2m,但C、D组尚未达到。A、B、C、D组颅内ORR分别为17.9%(14/78)、37.3%(19/51)、60.0%(9/15)和66.7%(10/15)。颅外 ORR 分别为 48.5%(47/97)、81.1%(43/53)、73.7%(14/19)和 73.7%(14/19)。
结论:对于伴有脑转移的EGFR突变NSCLC,第一代EGFR-TKI加贝伐珠单抗可显着提高颅内病变疗效,延缓颅内病变进展,延长生存时间,虽然第一代EGFR-TKI加CT可显着提高颅内病变疗效,延缓颅内病变进展,延长生存时间。与ERGF-TKI单药治疗相比,可提高颅外ORR,但对颅内病变疗效有限,不能增加生存时间。
详情参见:EGFR突变型非小细胞肺癌脑转移不同一线治疗的疗效和临床生存结局
原发性肺肿瘤与配对脑转移肿瘤免疫微环境的比较
背景:肺癌是脑转移 (BM) 的最常见原因之一,并且总是与预后不良有关。为了评估非小细胞肺癌 (NSCLC) 脑转移瘤中肿瘤免疫微环境的特征,我们研究了原发性 NSCLC 和配对脑转移瘤的免疫表型。
方法:2000 年至 2019 年,43 名中国 NSCLC 患者在就诊时或疾病过程中出现 BMs 入院。RNA 测序(RNA-seq)为 80-对来自 43 名患者的原发性肺肿瘤和配对脑转移瘤的 6 个福尔马林固定石蜡包埋 (FFPE) 样本进行了全面分析肿瘤免疫微环境。
结果:数据显示,与原发性肺肿瘤相比,脑转移显示肿瘤浸润淋巴细胞 (TIL) 减少(所有 28 种免疫细胞亚型 P < 0.05)、活化 CD8 T 细胞和效应记忆 CD8 T 细胞在总 TIL 中的比例较低(P = 0.028 , P < 0.001, 分别); 总 TIL 中巨噬细胞和中性粒细胞的比例较高(分别为 P < 0.001、P < 0.01)。与原发性肺肿瘤相比,一些免疫相关特征的得分,包括 MHC 非类别特征、IFN γ 特征和 T 细胞炎症基因表达谱(GEP)特征,在脑转移灶中显着降低(P = 0.004) ,分别为 P = 0.009、P = 0.004),而脑转移灶的 MHC II 类特征评分更高(P = 0.045)。我们发现脑转移瘤和原发性肺肿瘤中肿瘤微环境免疫类型(TMIT)的分布不同。
与原发性肺肿瘤(47%)相比,脑转移瘤中 TMIT I(高 PD-L1/高 CD8A)的比例(23%)显着降低(P < 0.05)。此外,我们发现三种免疫抑制检查点分子,即 C10orf54 (VISTA)、CTLA4 和 CD274 (PD-L1) 在脑转移瘤中比在原发性肺肿瘤中下调(分别为 P < 0.001、P < 0.001、P = 0.034)。此外,成对的脑转移瘤和原发性肺肿瘤之间的 PD-L1 表达相关性较差(R = 0.28,P = 0.068)。无监督分层聚类分析显示,原发性肺肿瘤有两种不同的免疫基因特征模式,即聚类 A 和聚类 B,聚类 B 中的肿瘤免疫丰富。
结论:我们的工作说明了 NSCLC 脑转移的免疫景观,并表明与原发性肺肿瘤相比,脑转移中的肿瘤免疫微环境进一步受到免疫抑制,这可能有助于指导 NSCLC 脑转移的免疫治疗策略。
作者:Oranhgy
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#非小细胞#
75
#专题#
82
#ASC#
69