Sci Rep:不同类型胰腺癌细胞中KRAS突变的异质性
2017-08-22 王婳婳 BioArt
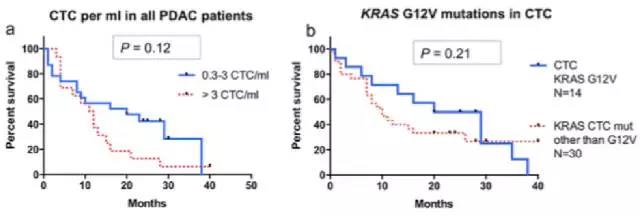
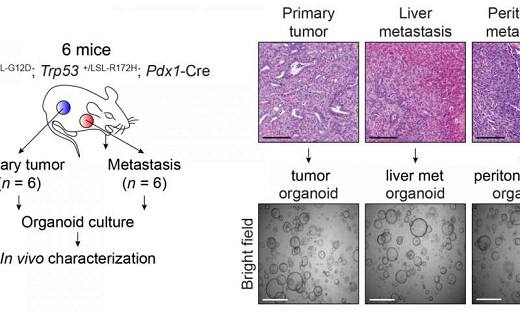
胰腺导管腺癌(PDAC)是一种破坏性疾病,血液中的循环肿瘤细胞(CTC)被认为是全身肿瘤扩散的手段。PDAC是美国和欧洲癌症相关死亡的第四大原因,发生率几乎等于死亡率,5年生存率<6%。这主要是由于其在转移期经常晚期诊断,具侵袭性,并仅对部分已知化学疗法应答。
作者:王婳婳
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#不同类型#
36
#癌细胞#
28
#KRAS突变#
38
#KRAS#
33
#RAS突变#
30