维泊妥珠单抗,维奈克拉和抗CD20单抗治疗复发/难治性B细胞非霍奇金淋巴瘤
2024-06-24 淋立尽治 淋立尽治
本研究表明polatuzumab vedotin和venetoclax分别联合obinutuzumab或rituximabin R/R FL和DLBCL的安全性可接受,在R/R FL中具有良好的反应率
研究背景
晚期复发难治滤泡型淋巴瘤(FL)及弥漫大B细胞淋巴瘤 (DLBCL)既往标准治疗无法治愈。因此,需要新的治疗提高这些B细胞非霍奇金的疗效和安全性。选择性BCL-2抑制剂venetoclax已被批准用于血液系统恶性肿瘤,但其作为单一药物疗效在FL或DLBCL 是有限的。
根据各药物的作用机制,我们进行了假设,polatuzumab vedotin, venetoclax和一种抗CD20药物可能会通过靶向综合增强R/R NHL疗效。在这里,我们报告了1b期队列和研究的最新随访数据。
研究目标
该研究的2期部分评估了polatuzumab vedotin 1.8 mg/kg和venetoclax 800 mg,以及固定剂量奥妥珠单抗 1000 mg或利妥昔单抗 375 mg/m2在复发/难治性(R/R)滤泡性淋巴瘤(FL)或弥漫性大b细胞淋巴瘤(DLBCL)患者中的安全性和有效性。
入组条件:
符合条件的患者年龄≥18岁,组织学上证实为CD20阳性的FL或DLBCL,既往化疗免疫治疗≥1次(包括抗CD20单克隆抗体), (ECOG PS)为0-2, PET-CT有≥1个可测量病变(最大尺寸>1.5 cm)。
研究方法
在1b期,患者接受了增加剂量的polatuzumab vedotin和venetoclax加上固定剂量的obinutuzumab(R/R FL)或rituximab (R/R DLBCL)来测定the RP2D。在第2期,FL患者接受polatuzumab vedotin诱导,RP2D为1.8 mg/kg,第1天静脉输注(IV),并在6个21天周期的第1- 21天口服venetoclax 800 mg,每日1次,加上obinutuzumab 1000 mg,在第1周期的第1、8和15天,以及第2 - 6周期的第1天静脉输注。患者继续每天接受venetoclax,直到EOI反应评估(最后一个诱导周期第1天后6-8周)。达到完全缓解(CR)、部分缓解(PR)或稳定的患者,每天接受维持性venetoclax,持续8个月,每隔一个月的第一天接受obinutuzumab,持续24个月。
DLBCL患者在每个诱导周期的第1天分别以1.8 mg/kg和375 mg/m2的固定剂量给予polatuzumab vedotin和rituximabh,并在6个21天诱导周期的第1- 21天每天1次加venetoclax 800 mg。诱导后达到CR或PR的患者有资格接受巩固治疗(每日venetoclax和每隔一个月的第一天美罗华,持续8个月)。
研究终点:
研究终点和结局指标主要是基于PET-CT扫描的CR率。
关键的次要疗效终点包括研究者(INV)评估的PET-CT客观缓解率(ORR)
关键的探索性疗效终点包括无进展生存期(PFS)
2个周期后行中期CT扫描,6个周期后行PET-CT扫描。
研究结果
2016年3月9日至2020年1月31日,131例患者入组治疗。人口统计学和基线临床特征详见表1。
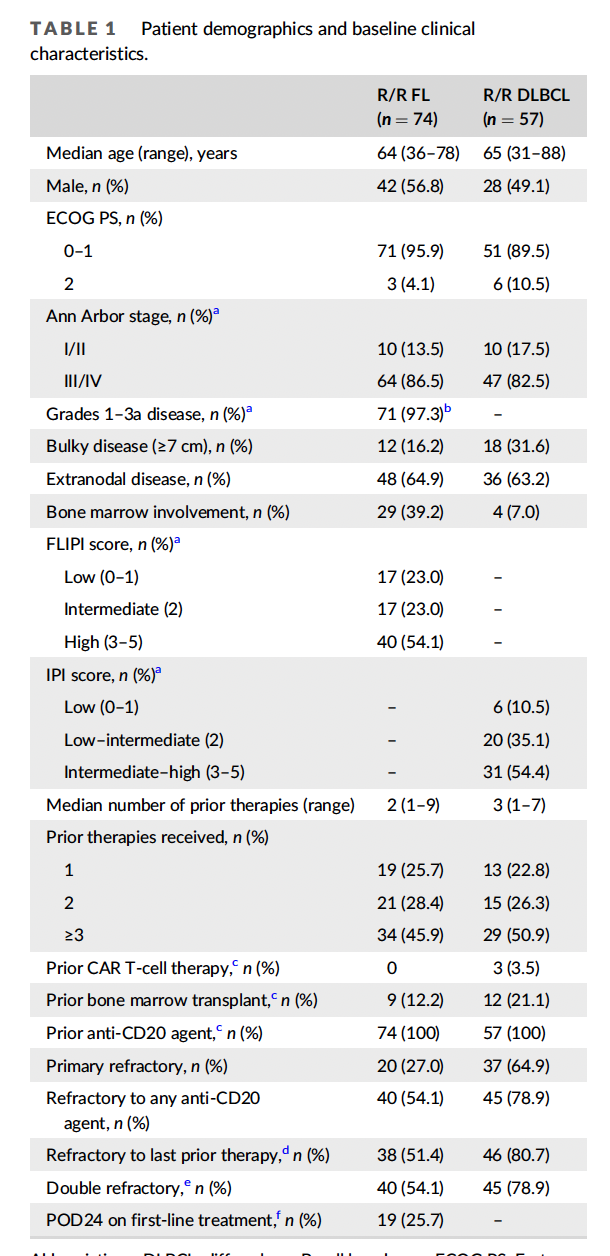
在FL队列(n = 74)中位年龄为64岁,86.5%的患者患有Ann Arbor III-IV期疾病,54.1%的FL国际预后指数(FLIPI)为3-5,74.3%的患者接受过≥2次既往治疗。
在DLBCL队列中(n = 57),中位年龄为65岁,82.5%的患者患有Ann Arbor III-IV期疾病,54.4%的患者IPI为3-5,77.2%的患者既往接受过≥2种治疗。
R/R FL
可安全性评估的人群包括74例患者。疗效评估人群包括49例患者(中位随访37.4个月)。66例(89.2%)完成诱导治疗,31例(41.9%)完成维持治疗。19名患者(25.7%)在研究完成前终止研究;4例患者失去随访,1例患者退出研究,14例患者死亡(6例因PD, 2例因不明原因,1例报道为心脏骤停,1例死于covid -19肺炎、肺炎、终末期肺部疾病、急性肺水肿、败血症和呼吸衰竭,1例死于同种异体干细胞移植后移植物抗宿主病继发多器官衰竭)。
R/R DLBCL
安全性可评估人群包括57例患者。可评估疗效的人群包括48例患者(中位随访9.8个月[范围,0.0-40.8])。完成诱导治疗30例(52.6%),完成巩固治疗11例(19.3%)。42例(73.7%)患者在研究完成前终止了研究(失去随访,n = 2;退出研究,n = 2;PD, n = 1;其他原因,n = 1;死亡,n = 36)。31例死亡原因以PD为主;其他死亡原因包括肺炎(n = 1)、感染(n = 1)、噬血细胞性淋巴组织细胞增多症(n = 1)和未知原因(n = 2)。
安全性
R/R FL
在诱导过程中,polatuzumab vedotin和obinutuzumab的中位治疗暴露时间为3.5个月(范围0-5),venetoclax的中位治疗暴露时间为5.3个月(范围0-9)。66例患者(89.2%)接受了全部6个周期的诱导治疗。总体而言,15例(20.3%)FL患者因AE而早期停止治疗;7名患者(9.5%)停止使用polatuzumab vedotin, 8名患者(10.8%)停止使用obinutuzumab, 12名患者(16.2%)停止使用venetoclax。28名患者(37.8%)需要减少治疗的剂量,主要是venetoclax(27/28[96.4%])。既往接受≥3个治疗线的患者比既往接受1 - 2个治疗线的患者(11/27[40.7%])更容易出现venetoclax的剂量减少(16/27[59.3%])。
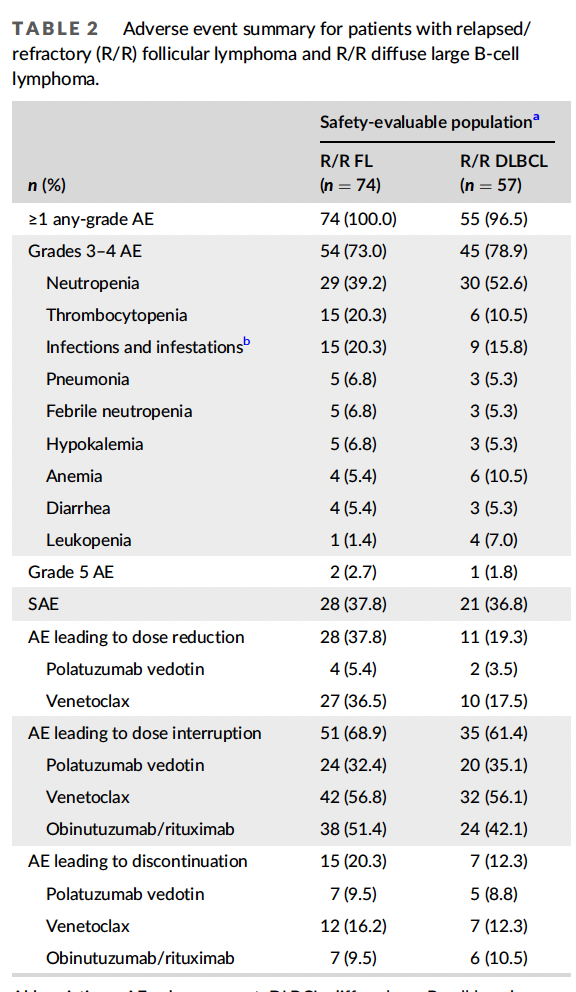
R/R DLBCL
在诱导过程中,polatuzumab vedotin和rituximab的中位治疗时间为3.4个月(范围0-5),venetoclax的中位治疗时间为3.9个月(范围0-11)。30例(52.6%)患者接受了全部6个诱导周期。7例(12.3%)患者因AE而早期停止治疗。最常见的停药原因是PD(27/57例[47.4%])。
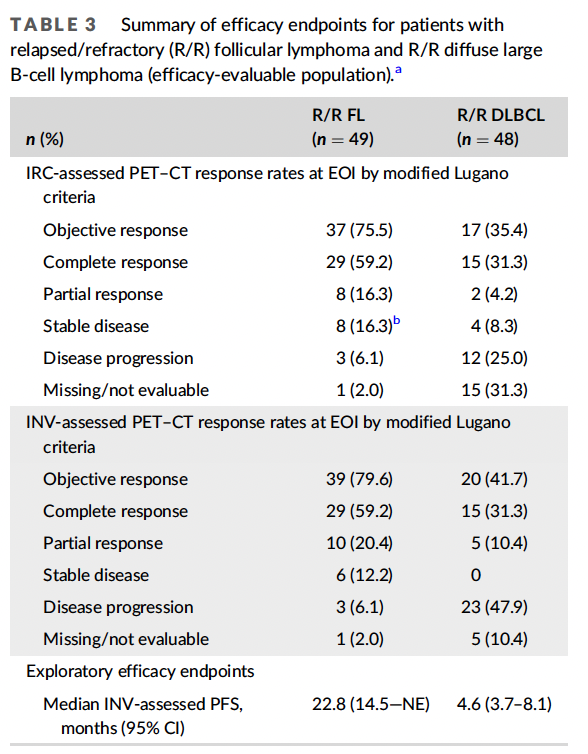
疗效
R/R FL
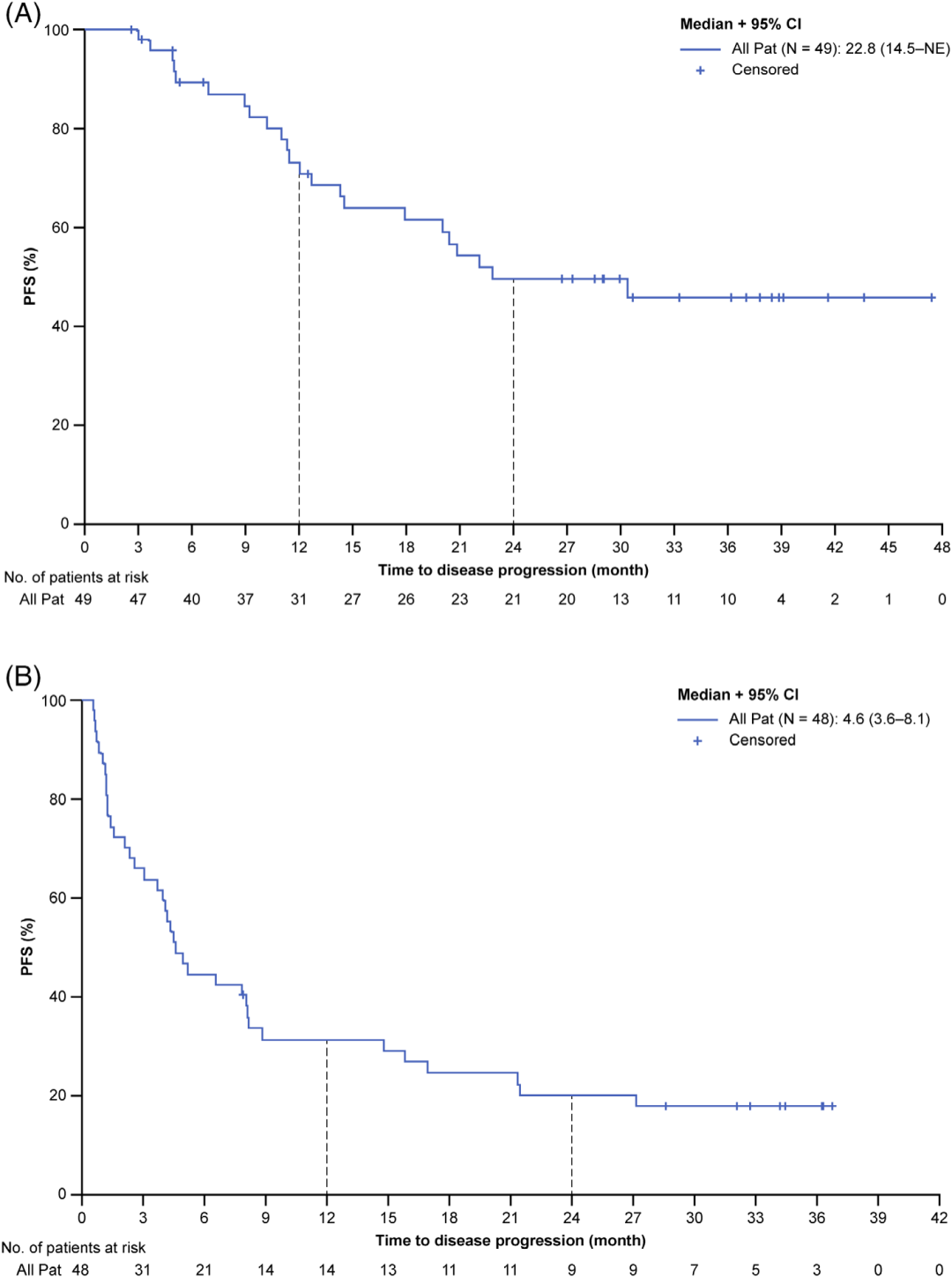
根据改进的Lugano标准,IRC评估的可评估人群(主要疗效终点)在EOI时的PET-CT CR率为59.2%,ORR为75.5%(表3)。36例患者在EOI时达到CR、PR或SD,并进入维持期,其中16例患者达到PR或SD。在维持治疗期间,3例PR改善为CR。PFS为22.8个月(95% CI, 14.5 -无法评估),12个月时PFS率为71.0% (95% CI, 57.6-84.3), 24个月时为50.0%(95% CI, 34.7-64.6), 36个月时为45.8% (95% CI, 30.3-61.4)(图1A)。中位OS未达到。
R/R DLBCL
在R/R DLBCL队列中,IRC评估的PET-CT在EOI时的CR率为31.3%,ORR为35.4%(表3)。INV评估的中位PFS为4.6个月(95% CI, 3.6-8.1;图1 B)。中位生存期为11.0个月(95% CI, 6.9-16.8)。
研究结论
本研究表明polatuzumab vedotin和venetoclax分别联合obinutuzumab或rituximabin R/R FL和DLBCL的安全性可接受,在R/R FL(包括高危患者)中具有良好的反应率。
参考文献
[1] Yuen, Sam et al. “Polatuzumab vedotin, venetoclax, and an anti-CD20 monoclonal antibody in relapsed/refractory B-cell non-Hodgkin lymphoma.” American journal of hematology vol. 99,7 (2024): 1281-1289. doi:10.1002/ajh.27341
作者:淋立尽治
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#弥漫大B细胞淋巴瘤# #难治滤泡型淋巴瘤#
69