读书报告 | 单细胞RNA测序评估新辅助免疫化疗治疗对NSCLC免疫微环境的重塑作用
2023-12-19 iCombo iCombo
本文利用单细胞测序、转录组测序、非靶向代谢组学以及多色荧光染色系统描述了可切除的NSCLC患者接受新辅助免疫治疗过程中TME的动态变化。
导读
抗PD-(L)1免疫检查点抑制治疗已成为晚期NSCLC的一线治疗方案。而对于早期可切除的NSCLC,新辅助免疫治疗已经显示出良好的应用前景。然而,新辅助免疫疗法在早期NSCLC的平均主要病理缓解率(MPR)约为32%,大多数患者系ICB难治性或获得耐药,其潜在机制仍有待探索。肿瘤微环境(TME)对于肿瘤治疗耐药具有关键作用,而免疫疗法本身又可重塑TME(克服T细胞功能障碍/衰竭,促进T细胞克隆扩增),两者相辅相成、互为表里。因此,更全面地表征NSCLC患者在ICB治疗期间的TME有利于更加准确地预测患者反应,并可能进一步提供新的治疗靶点。
本文利用单细胞测序、转录组测序、非靶向代谢组学以及多色荧光染色系统描述了可切除的NSCLC患者接受新辅助免疫治疗过程中TME的动态变化,观察到MPR者抗原递呈机制活化、FCRL4+FCRL5+记忆性B细胞和CD16+CX3CR1+单核细胞激活。而NMPR者雌激素代谢酶过表达和血清雌激素升高,为后续临床实践提供思路和依据(Genome Med. 2023 Mar 3;15(1):14. doi: 10.1186/ s13073-023-01164-9)。
研究背景
ICB是无驱动基因突变的晚期NSCLC患者的一线治疗方案,而对于早期可切除NSCLC,新辅助免疫治疗显示出良好的应用前景
然而,新辅助免疫疗法在早期NSCLC的平均主要病理缓解(MPR)率约为32%,可见大多数患者为难治性或获得耐药,其潜在机制仍有待探索
免疫疗法重塑TME(克服T细胞功能障碍/衰竭,促进T细胞克隆扩增),而TME反过来影响对免疫疗法的应答(T细胞克隆扩增的患者对ICB治疗反应良好)
因此,更全面地表征NSCLC患者ICB治疗期间的TME有利于更准确地预测患者反应,并可能提供新的治疗靶点
患者队列
无EGFR/ALK突变的可切除NSCLC患者
先接受2~4个周期(3周/cycles)新辅助治疗(PD-1抗体+基于铂类的化疗),然后接受手术
2019年9月~2021年5月共招募39名患者,包括scRNA-seq队列(n=15)、独立RNA-seq队列(n=21)和另外3名仅捐献外周血的患者。
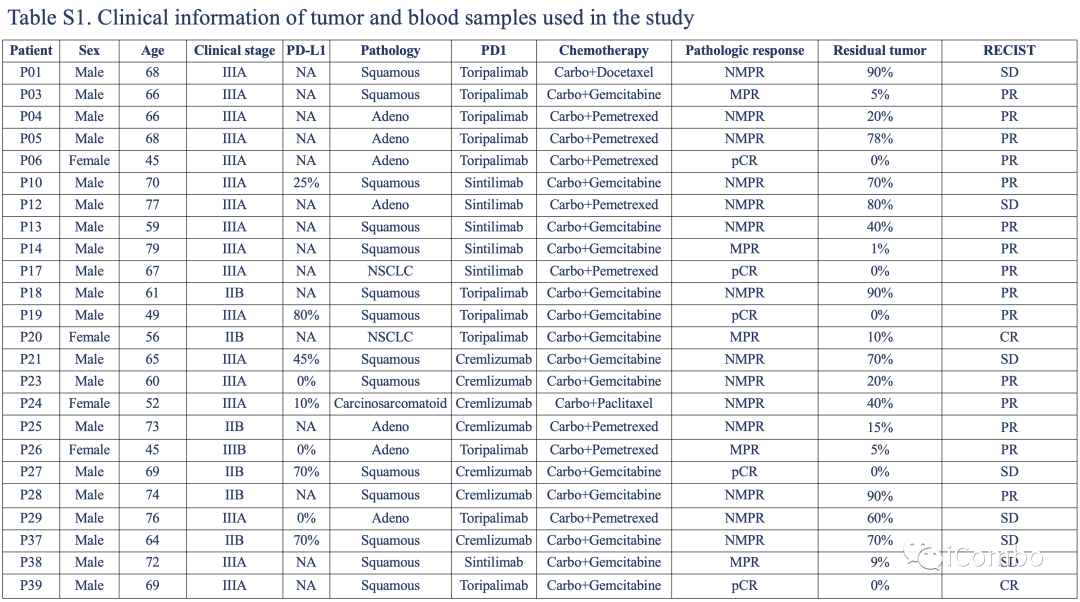
研究样本
给药前通过经皮肺活检、支气管镜活检或支气管内超声活检获得原发部位肿瘤组织,最后一程新辅助治疗后立即手术切除肿瘤组织;15例患者中选择了15个肿瘤样本进行scRNA-seq,21名患者中选取了21个治疗前肿瘤样本进行RNA-seq
在3个时间点收集了24例患者的67个外周血样本:基线(n= 24)、治疗中(第1/第2个周期,n= 24)和治疗后(最后一个周期后,n= 19);24例患者中,9例来自scRNA-seq队列,12例来自独立RNA-seq队列
PD1抗体联合化疗期间NSCLC患者的scRNA-seq表征治疗后TME重塑

B:使用92330个细胞的转录组进行分析,中位基因数为1256个/细胞,确定了26个群。
C/D:TN、MPR和NMPR患者中不同细胞类型的比例
-
MPR患者中,T细胞、NK细胞和B细胞的比例增加,尽管由于样本量有限而没有得到阳性P值。
-
髓系细胞在TME中富集,但在TN、MPR和NMPR患者中没有表现出差异。
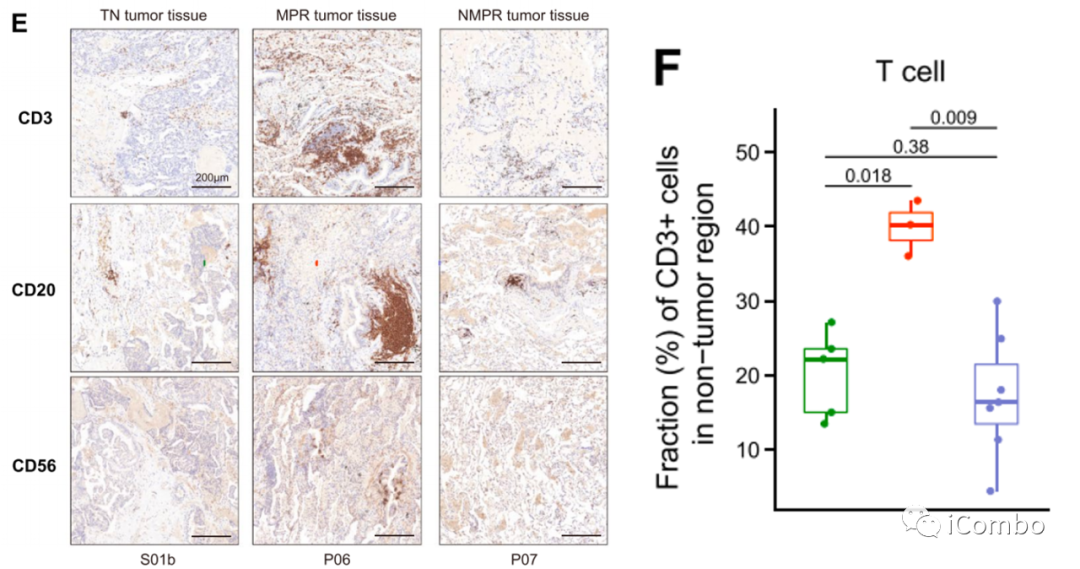
E/F:IHC染色证实,在MPR样本中,除NK细胞(CD56+)外,T细胞和B细胞丰度增加。
这与之前的报道一致,即T细胞和B细胞扩增与ICB更好的应答有关。
联合治疗后达pCR的患者:正常肺上皮细胞增加并检测到残留肿瘤细胞
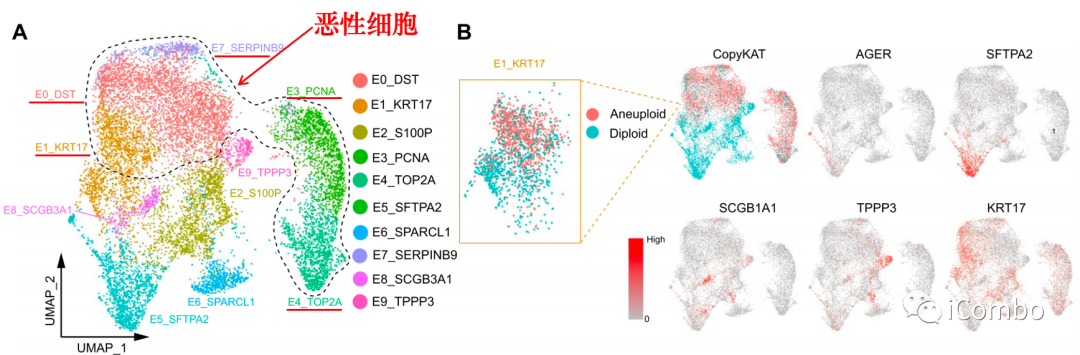
将上皮细胞重新聚类为10个群,然后分离恶性细胞和正常细胞。
肺泡细胞(E5_SFTPA2)、分泌细胞(E8_SCGB1A1)和纤毛细胞(E9_TPPP3)的组分在治疗后增加,尤其是MPR的患者,表明联合治疗在消除恶性细胞后,促进正常上皮细胞扩增(可能有助于重建先前肿瘤床中的正常肺结构)。
恶性细胞不同的分子特征区分MPR和NMPR
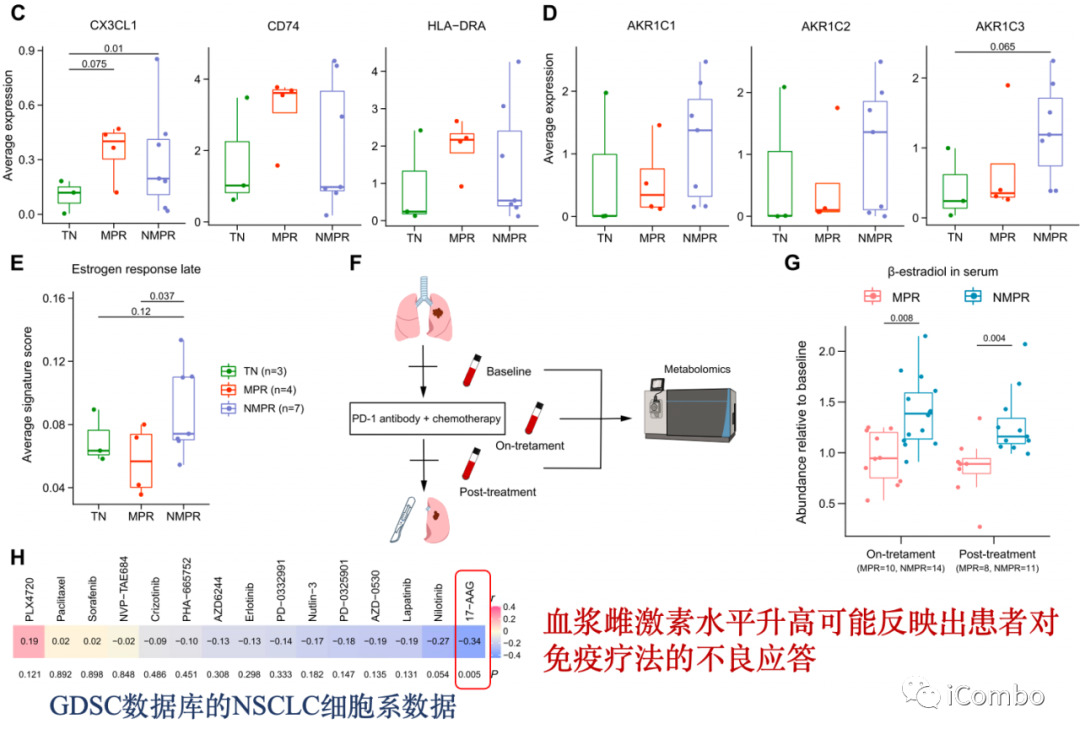
C: MPR患者的恶性细胞高表达CX3CL1(-CX3CR1, NK/单细胞)、CD74(肿瘤抗原)和MHC-II;TCGA队列中,CD74和HLA-DRA高表达与更好的预后相关
D:NMPR患者的癌细胞高表达AKR1B1/10(促转移/耐药)和AKR1C1-3(参与雌激素代谢,催化雌激素还原为β-雌二醇)
E:NMPR患者的恶性细胞中雌激素反应途径上调
F/G:检测基线、治疗中和治疗后血清类固醇的丰度:10名MPR和14名NMPR;与基线相比,NMPR患者的β-雌二醇(可能产生免疫抑制性TME)水平显著升高。
联合治疗后细胞毒性T/NK细胞扩增及Tregs减少的程度与病理应答呈正相关
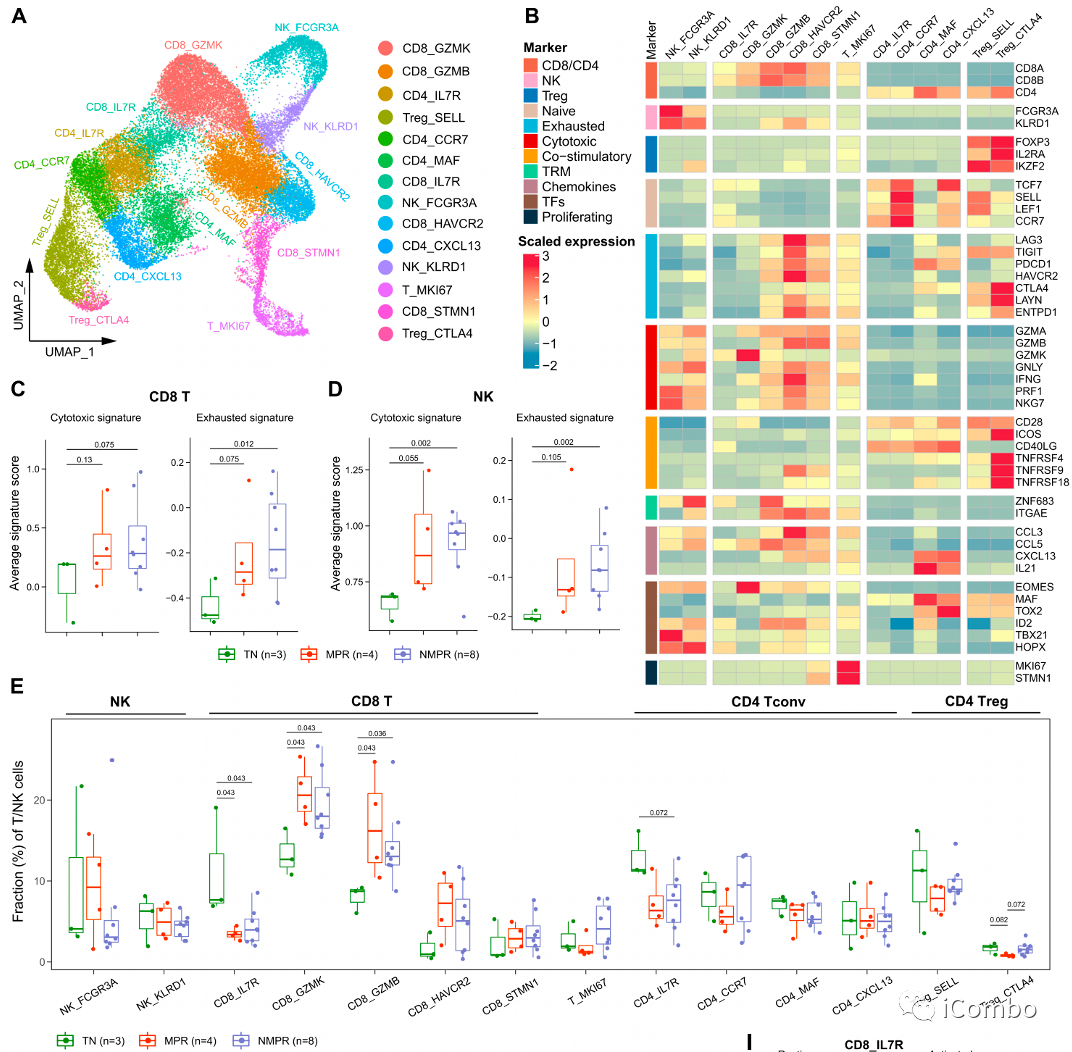
A/B:14个T/NK细胞群
C/D:治疗后,CD8+T/NK的细胞毒性和耗竭信号均显著增加
E:治疗后所有CD8+T细胞群组分增加;与TN相比,治疗后MPR患者Tem(CD8_GZMK,驻留在TME,ICB后局部扩增)和Trm(CD8-GZMB,其增加与新抗原特异性T细胞的扩增一致)以及循环效应T细胞(CD8_STMN1)的占比增加得更明显
E:幼稚Tregs(Treg_SELL)在MPR和NMPR患者中均降低,而活化Tregs(Treg_CTLA4)仅在MPR患者中降低
FCRL4+FCRL5+记忆B细胞预测对ICB的反应,并通过激活CD4+T细胞促进免疫治疗
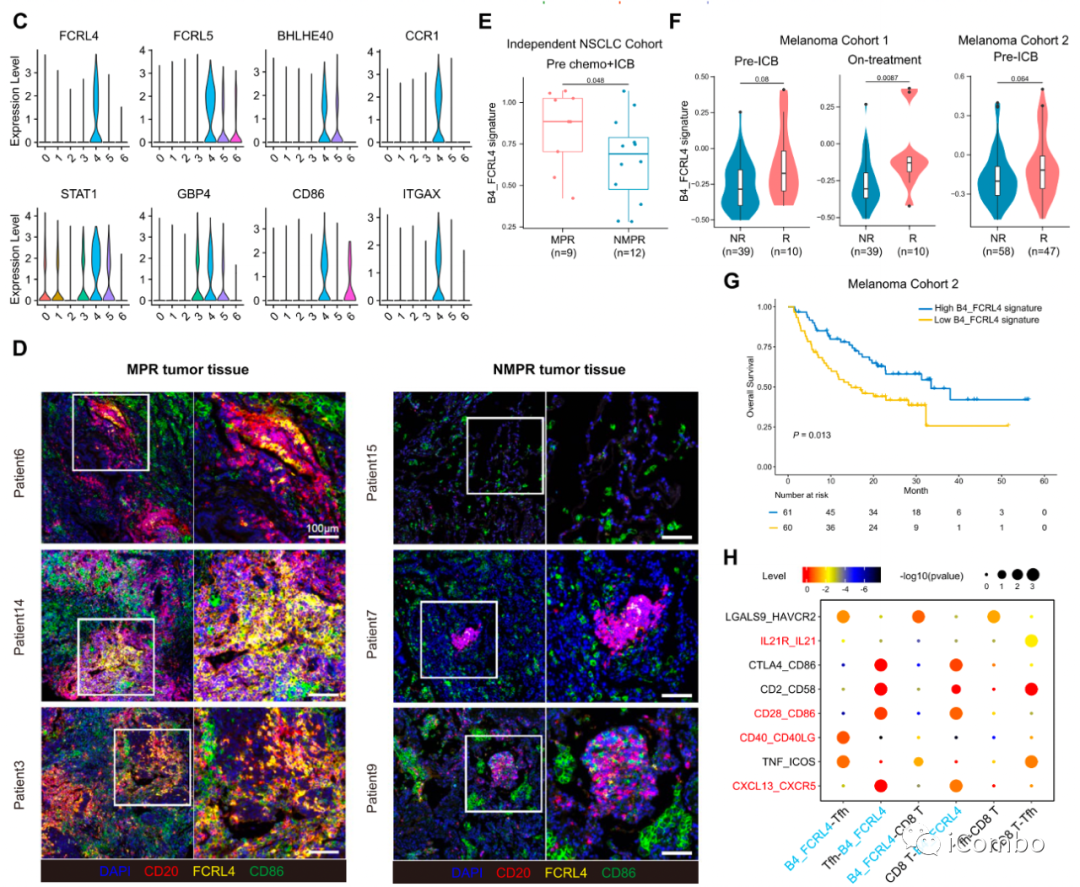
MPR患者中,高表达CD86的FCRL4+FCRL5+(预后更好)非典型记忆B细胞表现出增加趋势
D:多色荧光染色显示这群细胞在MPR中富集程度更高;CD20+B细胞在TLS中聚集, FCRL4+FCRL5+B细胞位于TLS的中心(与抗肿瘤活性和对联合治疗的积极响应有关)。
E/F/G:在另外两个黑色素瘤队列中,应答者(CR/PR)的B4_FCRL4信号高于无应答者(SD/PD)。
H:细胞互作分析发现这群B细胞可以通过CD86-CD28和CD40-CDLG激活滤泡辅助T细胞(Tfh)产生IL-21,而IL-21可进一步激活CD8+T细胞。
CX3CL1募集巡逻单核细胞预测免疫治疗反应
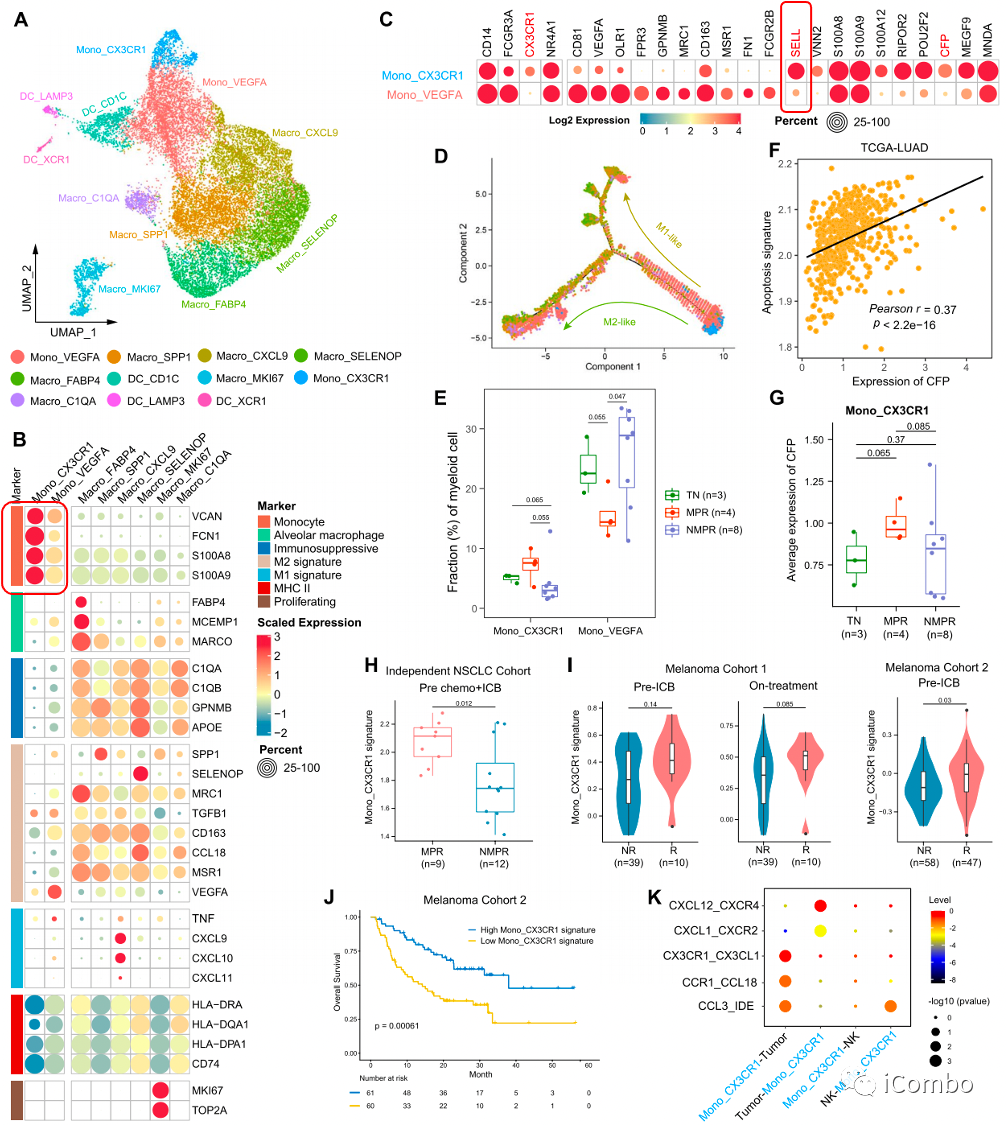
A:髓系细胞分为2个单核细胞亚型、6个巨噬细胞亚型和3个DC亚型
B/C/D:Mono_CX3CR1代表“幼稚样”状态,Mono_VEGFA代表“前巨噬细胞”状态(幼稚单核和巨噬细胞之间的中间表型)
E/F/G:MPR患者中,Mono_VEGFA细胞减少,而Mono_CX3CR1细胞(与巡逻单核细胞相似)丰度增加,后者通过分泌CFP诱导TC凋亡
H/I/J:验证队列的MPR患者和两个独立黑色素瘤队列的应答者中,观察到更高水平的Mono_CX3CR1信号,且与生存率的提高有关
K:细胞相互作用分析表明,CX3CL1-CX3CR1配对在Mono_CX3CR1细胞和MPR患者的癌细胞之间显著富集。
联合治疗使组织驻留巨噬细胞扩增,并将TAM重新编程为M0表型,解除MPR患者的免疫抑制
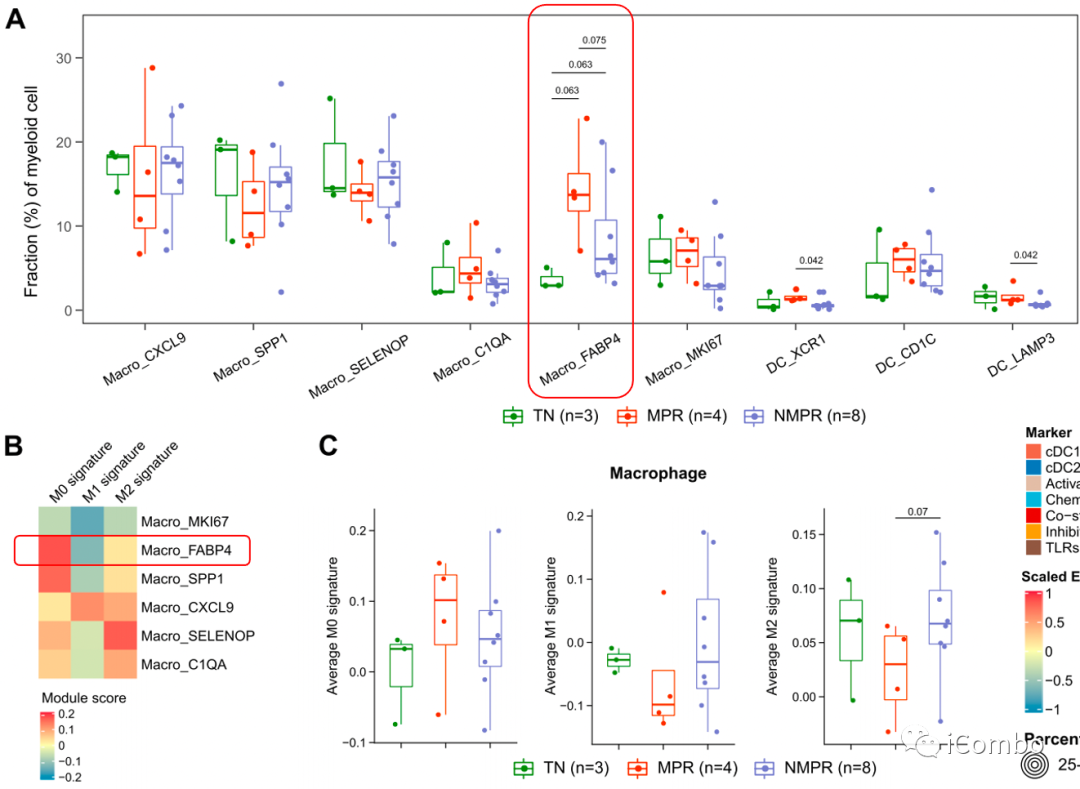
A:Macro_FABP4(即AM,组织固有肺泡巨噬细胞,可与AT2细胞共同作用,再生正常肺结构)在治疗后患者中显著升高,在MPR患者中升高程度更显著
B:AM表现出M0样表型,Macro_SPP1、Macro_SELENOP和Macro_C1QA均具有更强的M2特征,只有Macro_CXCL9显示出高M1信号
C:在MPR患者中,M2信号降低,然而M1特征和M1样亚群也在治疗后减少;与TN患者相比,MPR患者的M0特征增加
DC被治疗激活并在MPR患者中扩增
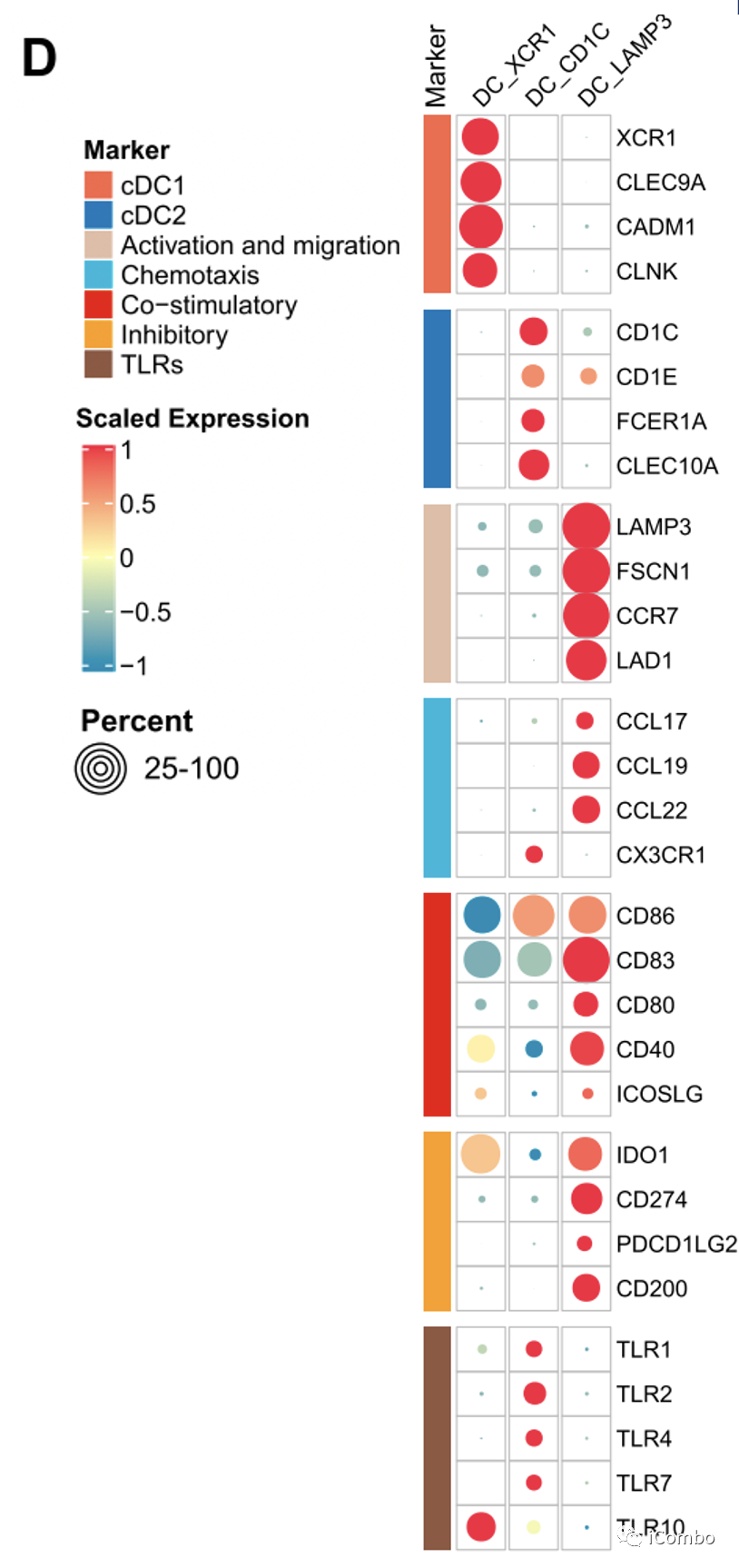
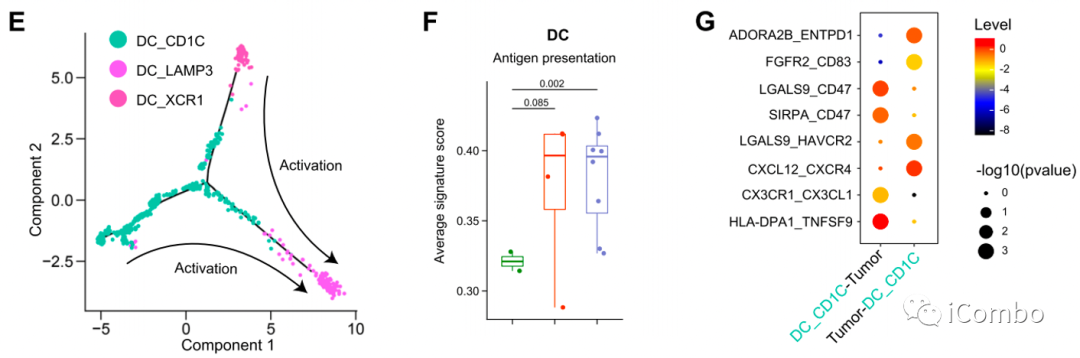
E:mregDCs(通过IL-4与肿瘤浸润性Treg相互作用,或抑制CD8+T介导的抗肿瘤免疫)可能由cDC1s和cDC2s产生。
联合治疗后,MPR患者的cDC1s和cDC2s分数增加。
F:DC的抗原呈递特征在治疗后显著增加,尤其是MPR患者,表明DC在治疗后被激活。
D/G:DC_CD1C细胞表达CX3CR1,CX3CL1-CX3CR1相互作用在DC_CD1C细胞和MPR患者的癌细胞之间显著富集
DC在治疗后被激活,并在MPR患者中被募集,这可能有助于TME中CD8+和CD4+T细胞激活。
MPR患者的衰老中性粒细胞减少,并通过CCL3和CCL4募集SPP1+TAM
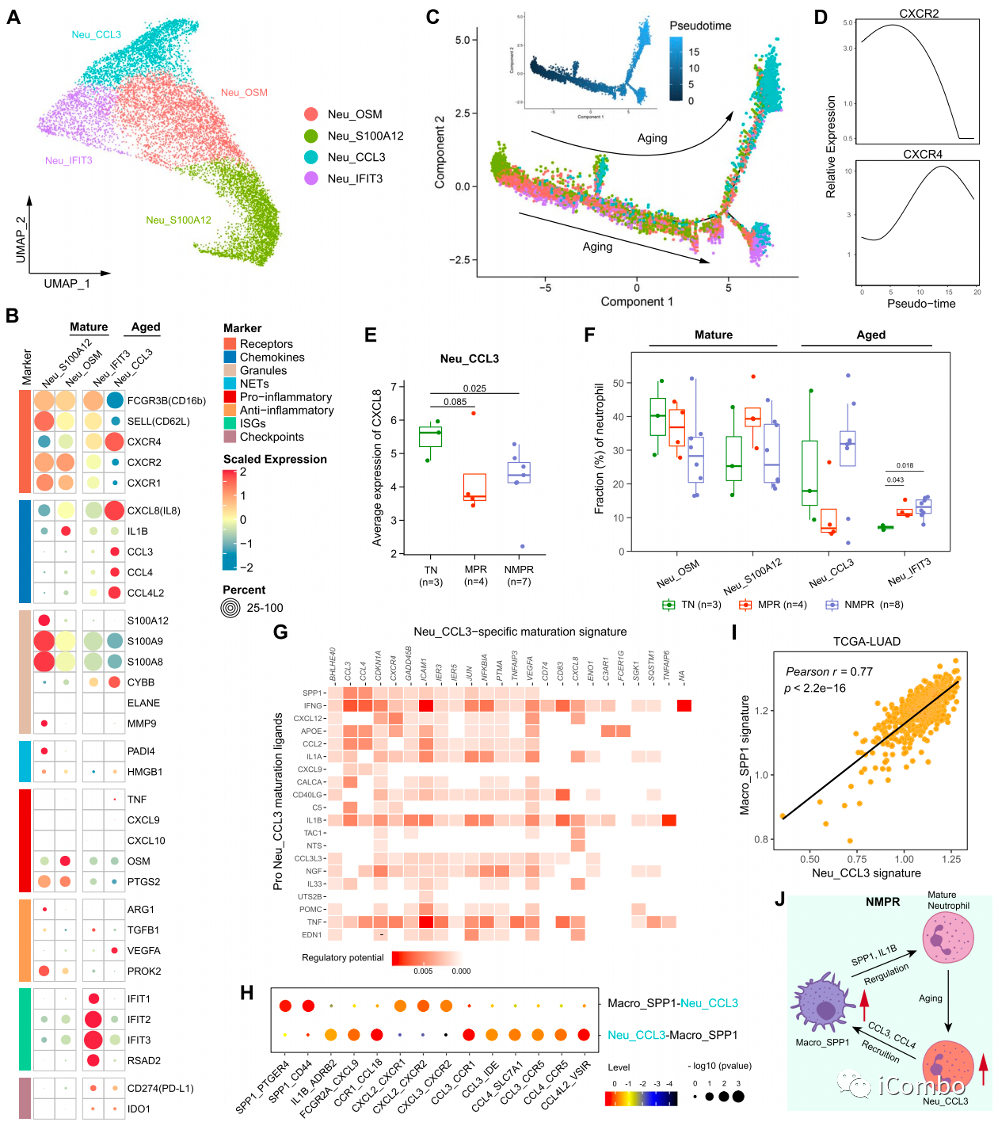
A/B:中性粒细胞分为4个亚群:2个成熟亚群和2个衰老亚群
C:Neu_S100A12亚群是轨迹的根源,Neu_CCL3亚群(衰老亚群,过度分泌多种趋化因子,其中CXCL8是免疫治疗不良结果的有力预测因子,并且高表达PD-L1和IDO1等及趋化因子IL8)是终点
E/F:MPR患者的Neu_CCL3细胞消耗最多,并且Neu_CCL3细胞的CXCL8表达较低
G/H/J:细胞互作分析发现CCL3+的衰老中心粒可能和SPP1+巨噬细胞存在着正反馈调节以互相促进增加:SPP1+巨噬细胞分泌SPP1诱导中性粒向衰老CCL3+表型转化,而这群中性粒则分泌CCL3、CCL4等趋化因子反过来招募更多的SPP1+巨噬细胞。
小结
ICB联合化疗期间NSCLC患者的TME动力学
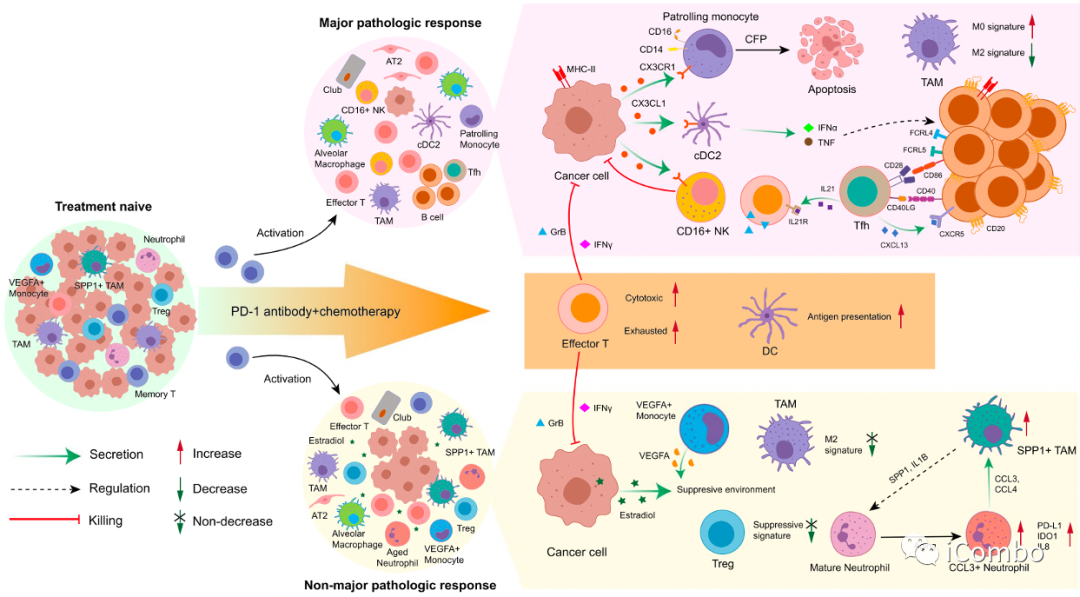
共同特征:化免治疗后IC表型重塑,TME中的正常上皮细胞扩增。效应T细胞的细胞毒性作用显著增强;然而耗竭Marker也增加了。记忆性CD8+T细胞被激活为效应表型。治疗增强了DC的抗原呈递功能。
1)MPR中残留的TC表达MHC-II以呈递肿瘤抗原,并分泌CX3CL1以招募PMos(分泌CFP促进TC凋亡)、cDC2s和CD16+NK细胞。Tfhs释放CXCL13募集CD20+B细胞,使其聚集在TME中。来自cDC2s的IFNα和TNF驱动FCRL4+FCRL5+记忆B细胞产生,后者通过CD86-CD28和CD40-CD40LG相互作用激活Tfhs。活化的Tfhs分泌IL21来增强效应T释放GrB。MPR中抑制性Tregs和TAM的M2信号降低。
2)在NMPR患者中异常的雌激素代谢导致TME中的雌二醇升高。NMPR中的TME仍然具有抑制性,TAMs的M2信号没有减少,VEGFA+单核细胞和Tregs的抑制信号没有增加。而SPP1+TAMs和CCL3+中性粒细胞相互作用以促进扩增:SPP1+TAM分泌SPP1和IL1B以诱导CCL3+嗜中性粒细胞的产生,而CCL3+中性粒反过来通过CCL3/CCL4吸引SPP1+TAMs。
作者:iCombo
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#NSCLC# #单细胞RNA测序# #新辅助免疫化疗#
47