Claudin18.2:不止眼前的抗体/ADC ,还有远方的CAR-T与mRNA药物
2023-09-10 洞见conjugates 猎药人俱乐部
全球在研Claudin18.2靶向药管线共138个,申请上市的有1个,进入临床阶段的有69个。
根据沙利文预测,预计到 2025 年,全球新胃癌患者发病总数将达到 125.6 万(包括中国约 54.6 万例),到 2030 年将达到143.5 万(包括中国约 62.2 万例)。预计到2030 年,全球胰腺癌患者人数可升至 63.9 万人。
据不完全统计,全球在研Claudin18.2靶向药管线共138个,申请上市的有1个,进入临床阶段的有69个。
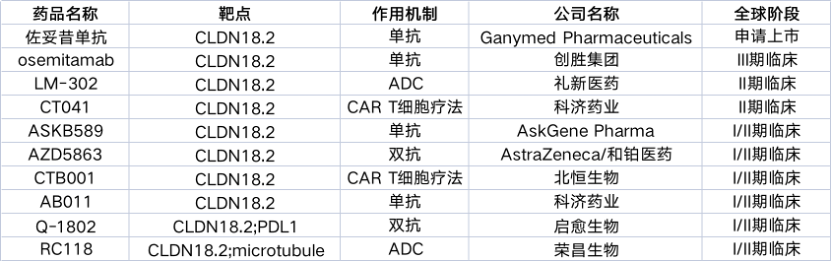
作为胃癌/胰腺癌领域最具前景的靶点,Claudin18.2靶向药的技术路线几乎囊括了所有主流方向:单抗、双抗、ADC、CAR-T、mRNA。相对于获得更多关注的抗体类潜力药物,CAR-T、mRNA正“强强联手,大做文章“。
1、潜力靶点:Claudin18.2
Claudins(CLDNs)为紧密连接(TJs)蛋白家族,能够连接细胞,形成细胞旁屏障。它们主要分布在胃、胰腺和肺组织中,可以用于疾病的诊断和治疗。CLDNs有四个跨膜结构域(TMDs),NH2和COOH端位于细胞内,另有ECL1和ECL2两个胞外环。磷酸化位点在细胞质位点的C端。CLDN 18.2作为其中一种亚型,由261个氨基酸组成。
CLDN18.2是一种高度选择性的分子,并且只在癌细胞中广泛表达,它就成为一种理想的靶点。CLDN18.2通常埋藏在胃粘膜中,正常组织中的单克隆抗体基本上接触不到,恶性肿瘤的发生会导致紧密连接的破坏,使肿瘤细胞表面的CLDN18.2表位暴露出来,成为特定的靶点。因此,CLDN18.2赋予靶向治疗的特异性。最近发现在胰腺癌(50%)、食管癌和肺癌中的表达也显示了诊断和治疗其他肿瘤的潜力。
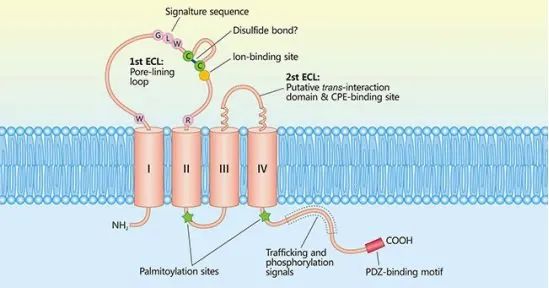
CLDNs蛋白结构
2、Claudin18.2:抗体类临床进展较快的药物
01、ADC

礼新医药--ADC(LM-302)
临床III期
康方生物与礼新医药共同推进的PD-1/VEGF双抗新药依沃西(AK112)联合Claudin18.2 ADC(LM-302)疗法,正处于临床III期。
LM-302是一款礼新医药自主研发的靶向Claudin 18.2抗体偶联药物。该产品由礼新医药基于独家多次跨膜蛋白抗体发现平台开发的Claudin 18.2 特异性抗体、可裂解连接子、以及毒素载荷甲基澳瑞他汀E(MMAE)组成。LM-302 能特异性靶向Claudin 18.2 阳性的肿瘤细胞并高效结合,之后借助抗体依赖的细胞毒性作用 (ADCC), 以及内吞进入细胞内溶酶体后释放毒素载荷等多种机制杀伤肿瘤细胞,从而起到抗肿瘤效果。LM-302在临床前研究中显示出良好的安全性及体内外活性,尤其在Claudin 18.2 低表达的肿瘤模型中显示出超过对照抗体Zolbetuximab的良好药效,基于LM-302临床前研究数据展现的疗效潜力和相关治疗人群的流行病学数据,美国FDA于2021年认定并授予LM-302针对胰腺癌,胃癌及胃管交界部癌和胆管癌的三项孤儿药资格。
02、单抗
安斯泰来的Zolbetuximab(佐妥昔单抗)是国内首款申报上市的CLDN18.2单抗。此外,佐妥昔单抗已在美国、欧洲和日本申报上市。
03、双抗

1/2期临床
3、Claudin18.2:Car-T、mRNA均有进入II期临床药物
01、mRNA
BioNTech--BNT-141
II期临床
BioNTech的BNT-141使用了核苷修饰的mRNA设计用于减少免疫原性,以避免免疫反应,并且可以在细胞当中翻译生成靶向CLDN18.2的抗体。该疗法使用靶向肝脏的脂质纳米颗粒(LNP)递送技术,采用静脉给药方式,以确保抗体的全身可用性,延长编码抗体在体内的作用时间。目前已经II期。
02、Car-T

科济药业--CT041
II期临床
CT041是一种全球潜在同类首创的,靶向Claudin18.2蛋白的自体CAR-T细胞候选产品。主要治疗胃癌/食管胃结合部腺癌(GC/GEJ)及胰腺癌(PC)。Claudin18.2在一系列实体瘤中表达,包括GC/GEJ、PC、胆癌(BTC)、结直肠癌、肺癌及卵巢癌。科济药业在全球范围內率先成功识别、验证并报告Claudin18.2可作为实体瘤的相关抗原,是治疗Claudin18.2中或高表达的实体瘤的CAR-T细胞疗法的可行靶点。为了进一步解决CAR-T细胞疗法治疗实体瘤的挑战,科济开发了一种创新且受专利保护的FNC清淋方案于CT041输注前给药。该FNC方案特点是在包含环磷酰胺和氟达拉滨的传统清淋方案的基础上,加入低剂量白蛋白结合型紫杉醇。
2022年6月,科济公布了两篇关于CT041的研究结果:
(1)CT041美国1b期试验结果:
1b期试验(NCT04404595)中,纳入了CLDN18.2阳性患者,包括之前接受过至少两种前线系统治疗的胃癌/食管胃结合部腺癌患者以及至少接受过一种前线治疗的胰腺癌患者。截至2022年5月6日,共有14例患者入组,其中,5例胃癌/食管胃结合部腺癌,9例胰腺癌。既往中位治疗线数为3线,且共接受了18个周期的CT041治疗。
在胃癌/食管胃结合部腺癌患者中,客观缓解率(ORR)为60%,其中1例患者实现了完全缓解(CR)。此外,在80%(4/5)的疾病稳定(4例胰腺癌患者)患者中观察到了肿瘤的缩小。
中位缓解持续时间(DOR)和中位无进展生存期(PFS)尚未达到。接受DL3的两例患者在数据截止日期前尚未进行肿瘤疗效评估。在DL1和DL2中观察到剂量依赖性反应。在DL1中观察到的ORR为16.7%,疾病控制率(DCR)为50%。在DL2中观察到的ORR为33.3%,DCR为83.3%。
在安全性方面,未观察到剂量限制性毒性或治疗相关死亡。
(2)CT041中国1b/II期的安全性和初步疗效结果:
1b/II期试验(NCT04581473)关键入选标准为至少二线治疗失败或不耐受的CLDN18.2表达阳性的晚期胃癌/食管胃结合部腺癌患者。HER2阳性患者应接受过标准抗HER2治疗。截至2021年12月22日,14例符合条件的胃癌/食管胃结合部腺癌患者纳入1b期研究。其中57.1%的患者转移器官数目>3个,92.9%存在腹膜转移。大多数患者(85.7%) 之前接受过二线治疗或包含氟尿啼呢、奥沙利铂和紫杉醇的三联疗法治疗。35.7%的患者曾接受过PD.1/PD-L1抑制剂治疗。
试验结果显示,14例患者中有8例 (57.1%)在CT041首次输注后的首次肿瘤评估即达到部分缓解,基于研究者评估的ORR和DCR分别为57.1%和78.6%。中位随访时间为8.8个月,中位PFS为5.6个月,中位总生存期 (OS) 为10.8个月。至数据截止日期,有7例患者仍然存活。
4、小结
2023年中场过半,科济药业依旧火力全开,在实体瘤领域取得革命性进展,CT041已成为全球首个进入到确证性II期临床试验的以Claudin 18.2为靶点用于治疗实体瘤的CAR-T细胞候选产品。Claudin 18.2作为极具潜力的治疗靶点,引众创新药企争相布局,成为必争之靶点高地。
CT041里程碑事件一览:
- CT041自2020年起,一路过关斩将,作为全球首创的CLDN18.2 CAR-T细胞药物,先后获得FDA和EMA授予“孤儿药”称号。
- 2021年,CT041入选欧洲药品管理局(EMA)授予优先药物(PRIME)资格。CT041是全球首个入选PRIME计划的实体瘤CAR-T产品(入选PRIME有助于缩短药物申请的审评时间)。
- 2022年,CT041又斩获FDA再生医学先进疗法(RMAT)资格,成为全球首个获得此殊荣的实体瘤CAR-T产品。
- 2023年4月,CT041获得国家药监局的IND批准用于Claudin18.2表达阳性的胰腺癌术后辅助治疗。5月,CT041在美国启动2期临床试验,用于治疗至少二线治疗失败的Claudin18.2表达阳性的晚期胃癌/食管胃结合部腺癌患者。8月,科济药业与美德纳公司(Moderna)启动了一项合作协议,以研究CT041与美德纳的试验性Claudin18.2 mRNA癌症疫苗的组合效果。
此外,今年8月21日,科济药业宣布与Moderna启动了一项合作协议,双方将开展临床前和I期临床试验,以研究科济药业Claudin18.2 CAR-T候选产品(CT041)与Moderna的试验性Claudin18.2 mRNA癌症疫苗的联合治疗效果。
mRNA与CAR-T的组合已经不是第一次,此前BioNTech开发了一款能够编码CLDN18.2抗体的mRNA疗法(BNT141),目前处于II期临床。
Moderna作为mRNA领域的龙头之一,此次与科济药业的碰撞,必将助燃Claudin18.2靶向药赛道“跑赢”胃癌。
资料来源:
药渡Daily、小药说药、药研网、科济药业年报、各公司官网
作者:洞见conjugates
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







