Mol. Neurodegener:Trem2缺失通过小胶质细胞外泌体途径增强tau蛋白的分散性和病理特征
2022-12-11 brainnew神内神外 brainnew神内神外
阿尔茨海默病(AD)是一种年龄依赖性的神经退行性疾病,表现为持续的Aβ和tau蛋白脑部病变。小胶质细胞免疫受体TREM2的变异与散发性阿尔茨海默病(AD)发病风险增加有关。
阿尔茨海默病(AD)是一种年龄依赖性的神经退行性疾病,表现为持续的Aβ和tau蛋白脑部病变。小胶质细胞免疫受体TREM2的变异与散发性阿尔茨海默病(AD)发病风险增加有关。虽然最近的研究表明TREM2功能障碍可以加重tau蛋白病理,但TREM2依赖于tau蛋白病理调节的机制仍然不清楚。
近期,《Molecular Neurodegeneration》期刊上发表了题为“Trem2 deletion enhances tau dispersion and pathology through microglia exosomes”的论文,作者团队通过向野生型(WT)和TREM2基因敲除(KO)小鼠的内侧内嗅皮层注射AAV-P301L tau病毒,描述了tau蛋白从内侧内嗅皮层(MEC)到海马区的渐进性扩散的差异,并将海马tau蛋白组织病理学的变化与空间记忆和恐惧记忆进行了关联。
作者团队还利用微流控分散试验比较了tau在培养的体外小胶质细胞和神经元在小鼠体内神经元中的分散效果,分析了小胶质细胞摄取tau蛋白后转运的差异,并对纯化的WT和TREM2 KO外泌体的tau蛋白分泌和致病性进行了量化。研究结果揭示了TREM2在抑制外泌体的tau蛋白致病性中的作用,并证明了TREM2的缺失可以增强tau蛋白在小胶质外泌体中的运输、分布和播撒。
 研究背景
研究背景
虽然阿尔茨海默病(AD)的认知障碍和记忆力衰退的症状最终是通过神经元功能障碍表现出来,但AD也与神经炎症密切相关,在AD大脑中神经胶质细胞通常表现出慢性激活。最近通过全基因组关联研究(GWAS)发现的与散发性AD发病风险增加相关的遗传变异中涉及许多风险基因,其中一些基因在小胶质细胞中表达丰富,包括TREM2和CD33。TREM2作为一种几乎只在小胶质细胞和髓样细胞类型中表达的免疫受体,其突变变体(如罕见的R47H突变)已被证明能显著增加AD发生的风险。
已有文献报道TREM2的R47H突变能够改变Aβ斑块形态、小胶质细胞能量代谢,并造成与TREM2配体(如APOE和Aβ寡聚体)的结合受损。虽然TREM2在小胶质细胞中的作用已被描述为小胶质细胞对Aβ的反应,但TREM2是否能类似地改变AD发病期间tau蛋白病理的进展尚不清楚。最近的研究表明TREM2缺失(Trem2 KO)可加重tau蛋白过度磷酸化,增强tau小鼠模型中巨噬细胞的激活。
此外,在APP/PS1 AD小鼠模型中Trem2 KO或TREM2 R47H突变都促进了病理性tau蛋白的播种;在P301L tau/PS2 APP小鼠模型中,以及在5xFAD小鼠大脑中注射从人类AD大脑中提取的tau蛋白聚集物后病理检测结果都表明TREM2的缺失加剧了tau蛋白的扩散/病理。然而,目前还不清楚TREM2是如何介导tau蛋白分散的,以及这些机制是否会影响tau蛋白依赖性的认知功能损伤。
鉴于TREM2只在大脑中的小胶质细胞中表达, TREM2的调控可能会影响小胶质细胞的某些行为或功能,从而加重下游tau蛋白的病理。尽管小胶质细胞不表达tau蛋白,但已有报道在AD小鼠模型中小胶质细胞能改变tau蛋白病理和扩散。小鼠fractalkine受体CX3CR1的缺失已被证明可以增强APP/PS1小鼠模型中的小胶质细胞激活和减少Aβ病理,并与增强tau病理和记忆相关。CX3CR1敲除(KO)小胶质细胞转移侵染也可诱导hTau小鼠大脑发生tau蛋白病变,提示激活小胶质细胞可潜在加重tau蛋白发病。最近的证据表明,在小胶质细胞激活过程中,NLRP3炎症小体(包括NLRP3、ASC和caspase-1)的组装是tau蛋白过度磷酸化和聚集所必需的。
而耐人寻味的是,炎症小体的激活也可以通过小胶质细胞中自噬体生物发生的重要媒介Atg7的缺失来诱导,导致tau蛋白病理和tau蛋白在PS19小鼠大脑中的扩散加剧。尽管NLRP3、CX3CR1或小胶质细胞Atg7缺失可增强tau蛋白病理,但使用PLX3397 CSF1R耗竭小胶质细胞后,12月龄Tg4510 (P301L tau)小鼠小胶质细胞缺失对tau蛋白负载影响不大,尽管疾病相关小胶质细胞(DAM)基因信号上调。这提示在tau蛋白病理早期激活小胶质细胞可能是加重tau蛋白扩散和病理积累的必要条件。
尽管越来越多的证据表明小胶质细胞可以改变tau蛋白的病理,但小胶质细胞依赖的tau蛋白分散的确切细胞机制仍不清楚。既往研究表明,小胶质细胞可通过外泌体挤压/传递传播病理性tau蛋白。在PS19(P301S tau)小鼠大脑的小胶质细胞中观察到了病理性tau蛋白;从人AD大脑分离的小胶质细胞中和在转基因Tg4510(P301L tau)小鼠大脑中都观察到了tau蛋白种子。小胶质细胞也被证明可以转化、包装和释放含有增强毒性的Aβ的微泡。尽管越来越多的证据表明小胶质细胞外泌体可以传递多种毒性蛋白(如Aβ和tau蛋白),但仍不清楚与AD风险基因(如TREM2和APOE)相关的遗传成分如何通过外泌体相关机制影响tau蛋白的分散和病理。
在本研究中,作者团队观察到TREM2缺失增强了人P301L tau蛋白从小鼠大脑内侧内嗅皮层(MEC)到海马齿状回(DG)区的转移,这与tau蛋白病理增加、突触传递减少、空间记忆和恐惧记忆受损相关。使用微流控检测系统检测发现TREM2 KO小胶质细胞可以在孤立的神经元层之间转移tau蛋白,并表现出内化tau蛋白进入前外泌体运输囊泡的增强运输,而外泌体抑制剂治疗抑制了WT和TREM2 KO小胶质细胞的外挤压tau蛋白。与WT小胶质细胞的外泌体相比,暴露于tau蛋白低聚物的TREM2 KO小胶质细胞的纯化外泌体也具有tau蛋白水平升高的特点,并在体外显示出增强的tau蛋白播种能力,并诱导WT小鼠大脑中tau蛋白的病理性磷酸化增强。
结果
01结TREM2缺失加剧了tau蛋白从MEC向海马DG区的分散
先前的研究表明,小胶质细胞的耗竭可以抑制AAV介导的tau蛋白从小鼠脑内的MEC到DG区的传播。然而,小胶质细胞调节神经元间tau蛋白分散的成分还有待鉴定。因此,作者团队首先检测了TREM2缺失是否可能影响tau蛋白从MEC到DG的分散。作者团队将AAV-P301L tau(“AAV-tau”)立体定向注射到4个月大的野生型(WT)和TREM2 KO小鼠的MEC区,并在AAV-tau注射后5周对病理pS202/pT205(AT8抗体)和pT231 (AT180)tau磷化形式进行染色(图1A)。
结果发现在WT和TREM2 KO动物中注射AAV-tau后5周在MEC区都观察到了强烈的AT8和AT180染色,但仅在TREM2 KO动物的海马DG区观察到明显的AT8或AT180染色,而在WT DG中很少或没有磷酸化tau染色(图1B、C)。另外与WT相比,在TREM2 KO动物中的人源tau蛋白在DG区域中的传递也明显增强(T13染色,图1D,E)。这表明病理性MEC/DG tau(p-tau)分散可能是由DG中转入的人P301L tau触发的,而不是源自MEC的最初的病理性的tau蛋白。而在MEC AAV-tau注射后5周,MEC和DG区的小胶质细胞数量没有发生明显变化(图1E)。另外,作者团队还通过在WT动物的MEC中立体定向注射AAV-GFP/AAV-tau的实验证实了病理tau的分散是通过tau转移造成的并排除了可能的AAV载体的跨突触转运介导的可能。
 图1.Trem2缺失加重了病理tau从内嗅皮层到海马的扩散
图1.Trem2缺失加重了病理tau从内嗅皮层到海马的扩散
作者团队进一步在注射AAV-tau MEC 5周后,通过标记小胶质激活(CD68)和稳态(P2Y12)的抗体对WT和TREM2 KO MEC中MEC和DG区域的小胶质细胞进行了表征(图2A)。结果发现在WT DG中主要观察到的是P2Y12阳性小胶质细胞,而在TREM2 KO DG中CD68阳性、P2Y12阳性和CD68/P2Y12双阳性小胶质细胞都被观察到(图2A- C),表明小胶质细胞激活与MEC和DG区域的病理tau蛋白状态相关,而DG中的小胶质细胞激活与TREM2 KO小鼠大脑中的tau蛋白分散相关。另外作者团队还检测了稳态小胶质细胞中表达的其它基因(如TMEM119)或在疾病相关小胶质细胞(DAM)或神经退行性小胶质细胞(MGnD)中表达上调的其他基因(如CD9和Clec7a)。
结果发现与WT相比,MEC注射AAV-tau 5周后,TREM2 KO小鼠的MEC和DG中CD9染色强度以及CD9/Iba1阳性小胶质细胞数量显著增加(图2C, D)。尽管在WT和TREM2 KO动物的MEC区TMEM119阳性、Clec7a阳性或Clec7a/TMEM119双阳性小胶质细胞均无明显差异,但是在TREM2 KO动物DG区Clec7a阳性细胞以及Clec7a/TMEM119双阳性小胶质细胞均明显增加(图2E, F)。总之,这些结果表明,小鼠大脑中TREM2的缺失可能会在5周内加重MEC局部给药tau蛋白向DG的分散,其中tau病理向DG区域分散与DAM/MGnD相关标志物如CD68、CD9和Clec7a的表达相一致。
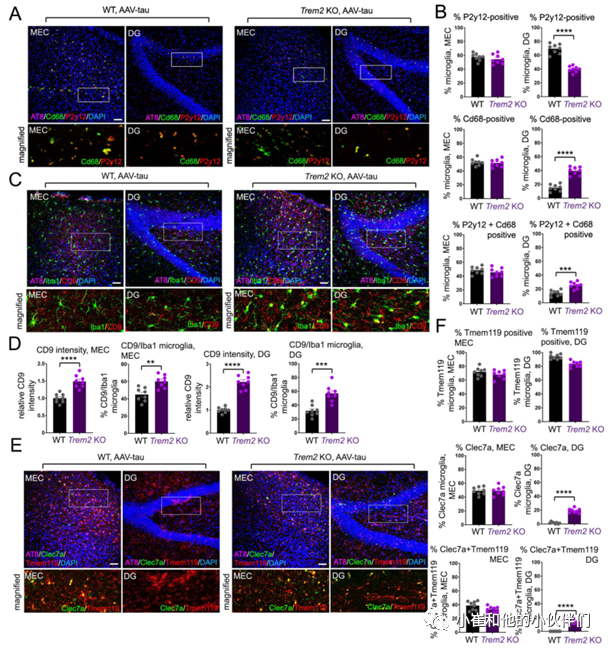 图2.用MEC AAV-tau转导表征小胶质细胞激活
图2.用MEC AAV-tau转导表征小胶质细胞激活
02TREM2缺失造成认知行为障碍及突触缺陷并且与MEC的tau蛋白分散有关
鉴于TREM2缺失可以增强tau蛋白从MEC到DG的分散,因此作者团队怀疑TREM2 KO动物海马中病理tau蛋白的浸润可能引起记忆和神经元功能的改变。为了验证这一假设,作者团队使用适用于小鼠的巴恩斯迷宫测试以评估不同分组小鼠的空间学习和记忆的变化,以及需要海马体和杏仁核协调活动的情景恐惧记忆变化。在训练试验中,作者团队观察到只有TREM2 KO/AAV-tau的动物在注射AAV 5周后对目标逃逸洞的导航功能受损。虽然在注射AAV 2周后WT或TREM2 KO动物在寻找目标逃逸洞方面几乎没有差异,但在注射了AAV-tau后TREM2缺失加剧了小鼠寻找目标逃逸孔的记忆障碍行为(图3A,B)。
另外,在巴恩斯迷宫探针试验中,与WT或TREM2 KO AAV对照动物相比,注射AAV-tau的WT动物在注射5周后出现轻微的、不显著的记忆损伤(图3B,右图)。在背景恐惧条件反射实验中,AAV对照/AAV-tau注射的WT和TREM2 KO小鼠也被观察到类似的效果。在注射病毒5周后的预适应实验中或在注射病毒2周后的探针试验中,AAV对照/AAV-tau注射的WT或TREM2 KO动物的冻结行为没有明显差异(图3C)。
然而, AAV-tau/TREM2 KO动物在注射AAV 5周后冻结时间显著减少(图3D,底部图)。这些结果表明在MEC中注射AAV-tau蛋白5周后 TREM2缺失小鼠表现出记忆障碍与海马区磷酸化tau蛋白的出现相一致。
考虑到TREM2的缺失可以通过注射的tau蛋白从MEC的分散来损害记忆,作者团队进一步确定了海马记忆障碍是否也与突触功能缺陷相一致。在MEC AAV-con或AAV-tau注射后5周,作者团队通过刺激WT和TREM2 KO动物急性海马切片的穿孔通路记录了DG中诱发的局部突触场电位。在对穿孔通路施加从0到200 μA的逐步刺激并测量齿状颗粒细胞的群体尖峰反应时,注射对照AAV的WT或TREM2 KO动物的群体峰值振幅几乎没有差异(图3E)。
然而,注射AAV-tau则显著降低了WT和TREM2 KO动物的群体峰值振幅(图3E),并且在TREM2 KO动物中群体峰值振幅受损更加严重(图3E)。另外对突触标记物PSD95的免疫染色也发现TREM2 KO DG中的PSD95点的数量明显减少(图3F, G)。总之这些结果表明,TREM2缺失导致海马记忆和突触缺陷,并且与AAV-tau蛋白从MEC到海马的分散有关。
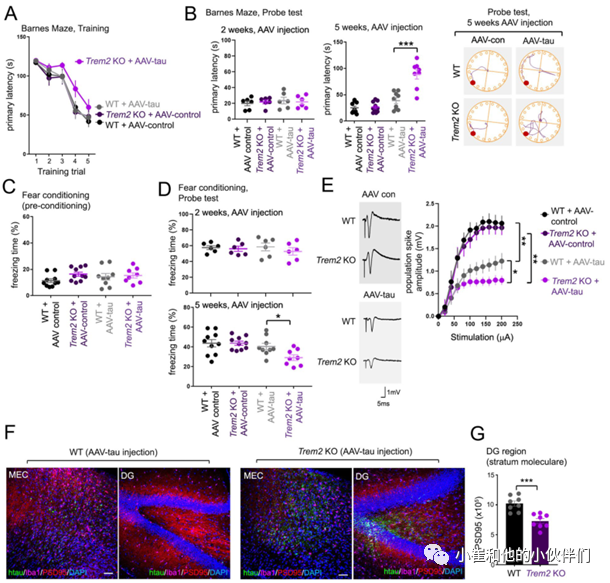
图3.TREM2缺失加重与AAV-tau表达相关的记忆和突触损伤
03TREM2缺失增强了体外小胶质细胞介导的神经元间tau蛋白的分散
虽然到目前为止作者团队的结果表明TREM2的缺失可以促进tau依赖性的分散和神经功能障碍,但这些影响是否源于小胶质细胞功能的改变尚不清楚。因此,作者团队在体外使用三室微流体检测系统(图4A)重建了非相邻神经元群体之间的tau蛋白转移。该检测系统包括第1层和第3层培养的原代神经元,以及第2层的原代小胶质细胞。其中第1层神经元被AAV-tau(“tau输入”)感染,并且tau可能被第2层的小胶质细胞吸收并传导(“tau传递”),然后传输到第3层神经元(“tau转导”)(图4A)。
作者团队通过WT或TREM2 KO小胶质细胞比较了AAV-tau在第1层和第3层的转导情况,或者在中间第2层中没有小胶质细胞时通过荧光成像进行了比较(图4B)。结果发现在第2层没有小胶质细胞的情况下, tau蛋白几乎没有传输到第3层神经元(图4B,C);当在第2层培养WT小胶质细胞时tau蛋白向第3层神经元有微弱的转导(图4B、C)。然而,当第2层中为TREM2 KO的小胶质细胞时则明显增强了第1层和第3层之间tau蛋白的转导(图4B、C)。这些结果说明TREM2缺失在促进小胶质细胞依赖的tau蛋白在非相邻神经元群体之间的传递方面具有重要的作用。
图4.TREM2缺失增强神经元间tau信号转导
04TREM2缺失促进小胶质细胞tau转运和外泌体中释放
鉴于目前的研究结果,TREM2的缺失可能会增强tau蛋白的摄取,从而通过增加细胞tau蛋白的装载和分泌来增加小胶质细胞tau蛋白的转导。由于已有结果表明WT和TREM2 KO小胶质细胞中tau蛋白的负载没有差异(图4B,C,“Iba1/tau蛋白重叠”),通过实时实时成像或FACS分析也没有观察到荧光tau蛋白低聚物的吸收,说明TREM2缺失对tau蛋白的吸收速率相对不受影响。
因此作者团队进一步比较了tau蛋白低聚物在WT和TREM2 KO小胶质细胞中定向胞内转运到不同囊泡的潜在差异。在小胶质细胞暴露于tau蛋白低聚物24小时后,通过共聚焦成像定量tau蛋白与早期内体(Rab5)、晚期内体(Rab7)、溶酶体(LAMP1)和多泡体(MVB)/外泌体(CD63, Tsg101)标记的共定位(图5A)。结果发现在4h处理后的WT和TREM2 KO小胶质细胞的Rab5、Rab7和LAMP1囊泡中观察到tau分布的差异很小,但在24h时在TREM2 KO小胶质细胞中观察到tau蛋白分布明显转移到晚期内体Rab7囊泡并远离LAMP1囊泡(图5A)。除此之外,作者团队还观察到tau与CD63和Tsg101的共定位增强,与LAMP1的共定位降低(图5A),表明在TREM2缺失后多囊泡体(MVB)/外泌体小泡中tau积聚增强。
为了进一步确定小胶质细胞依赖性tau传递是否需要外泌体释放,作者团队首先用tau寡聚体加载WT和TREM2 KO小胶质细胞,并在存在或不存在外泌体抑制剂GW4869(10微米)的情况下用LPS/ATP刺激外泌体释放(图5B),然后收集小胶质细胞培养基并通过ELISA分析进行tau定量(图5C),或与神经元一起孵育并通过共聚焦显微镜对tau摄取成像(图5D,E)。结果发现,在没有外泌体抑制剂的情况下TREM2 KO小胶质细胞中tau释放增加,并且GW4869处理显著抑制了小胶质细胞中tau的释放(图5C)。
另外,tau蛋白加载的TREM2 KO小胶质细胞的培养基孵育的神经元中tau蛋白摄取也明显增加(图5D,F),而GW4869处理后神经元tau蛋白摄取显著减少(图5E,F)。这表明TREM2缺失以依赖于外泌体的方式增强了神经元内tau蛋白传递性。为了确定TREM2缺失是否会影响外泌体的大小或粒径分布,作者团队用LPS/ ATP诱导后从WT和TREM2 KO小胶质细胞中制备了外泌体,并通过电子显微镜(EM)观察到WT和TREM2 KO外泌体的大小(图5G-H)或粒径分布(图5I)没有明显变化。这些结果表明,TREM2的缺失促进了tau蛋白运输到晚期内体/前外泌体囊泡并在不显著改变外泌体的大小的情况下通过外泌体释放增强了tau蛋白的转运。
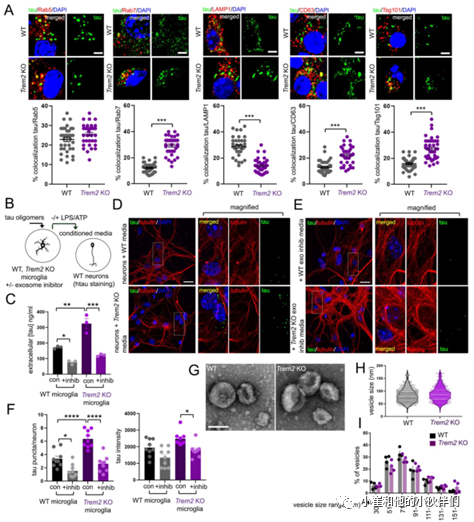
图5.TREM2缺失促进tau蛋白分布到晚期内体和前外泌体并促进其释放
05TREM2缺失对小胶质细胞外泌体和tau蛋白相关通路的影响
鉴于小胶质细胞在LPS/ATP刺激诱导外泌体释放之前预先装载的tau蛋白寡聚物,作者团队随后通过蛋白质组学分析确定TREM2缺失是否会影响tau蛋白或外泌体相关的细胞通路以应对tau或LPS/ATP暴露。将WT或TREM2 KO小胶质细胞暴露于tau寡聚物(运行1)或LPS/ATP(运行2),然后从未处理的小胶质细胞和tau蛋白或LPS/ATP处理的小胶质细胞中生成细胞裂解液,并通过质谱法对蛋白质进行无标记蛋白质组学分析(图6A)。
主成分分析(PCA)发现不同分组重复样品之间具有良好的一致性(图6B,C),并发现了大量差异富集或表达的蛋白质(DEPs)。作者团队比较了TREM2 KO(“KO”)与WT小胶质细胞在稳态下的蛋白质组学特征(1189个DEPs,运行1;495个DEPs运行2)或tau寡聚物(KO tau vs WT tau, 1150个DEPs)或LPS/ATP处理(KO LPS/ATP vs WT LPS/ATP, 660个DEPs),观察到与未处理的WT(1473个DEPs)或TREM2 KO小胶质细胞(1833个DEPs)相比,tau处理或LPS/ATP处理的蛋白质组学图谱发生了显著变化(图6D,E)。有趣的是虽然tau刺激产生的上调DEPs比下调的DEPs更多(图6D),但LPS/ATP诱导的上调和下调DEPs的数量大致相当(图6E)。
为了进一步比较tau蛋白和LPS/ATP暴露在蛋白质组学图谱中的异同,作者团队在WT和TREM2 KO小胶质细胞中比较了tau蛋白和LPS/ATP暴露重叠的DEPs。在WT和TREM2 KO小胶质细胞中tau蛋白和LPS/ATP刺激分别有302和473个共有的DEPs。而在WT(302)和TREM2 KO(473)tau、LPS/ ATP反应性 DEPs中共有141个DEPs。对这些DEPs的基因本体(GO)分析显示与“免疫系统过程”、“炎症反应”和“NFkB转录因子活性”GO BP(生物过程)类以及“NFkB信号通路”GO KEGG类相关的基因富集。所有DEPs的GO分析(2867,运行1;3481,运行2)(图6F,H)识别出52个与“mmu04064:NF-kappa B信号通路”KEGG通路相关的DEPs。对tau蛋白(运行1)或LPS/ATP(运行2)蛋白质组学数据集的GO分析显示,总共有38个GO CC(细胞成分)“细胞外泌体”DEP(图6J)。与WT相比,TREM2 KO小胶质细胞具有更强的反应;与KO、LPS/ ATP处理的样品相比,tau处理的KO小胶质细胞具有更强的DEP反应(图6J)。
总之,蛋白质组学分析表明刺激外泌体释放的tau蛋白和LPS/ATP条件可以诱导培养的小胶质细胞发生强大的蛋白质组学变化,而TREM2缺失可以显著改变对tau蛋白和免疫刺激/嘌呤能小胶质细胞激活的反应。
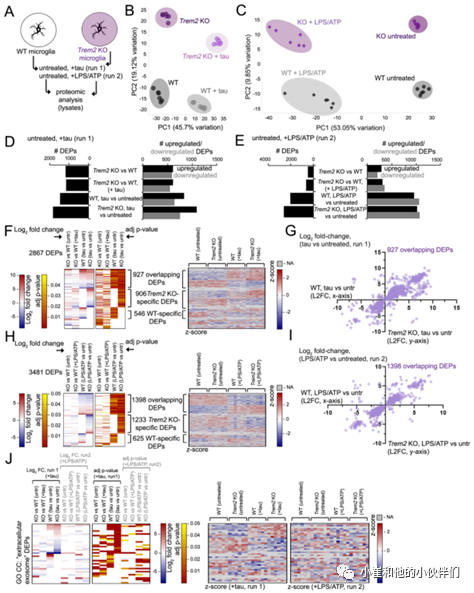
图6.TREM2 KO小胶质细胞外泌体诱导相关的蛋白质组学特征
06TREM2缺失增强了外泌体tau蛋白的释放、播种和病理
为了进一步明确TREM2 KO小胶质细胞中tau蛋白分布和致病性的潜在改变,作者团队通过免疫印迹和ELISA比较了TREM2 KO和WT小胶质细胞中tau蛋白摄取和LPS/ATP诱导后的外泌体tau蛋白水平(图7A-C)。正如预期的那样,在LPS/ATP刺激下WT小胶质细胞外泌体制剂中外泌体标志物如Alix和tau蛋白富集,而在未刺激的外泌体制剂中很少或没有Alix/tau蛋白(图7A)。通过Western blot和ELISA比较WT和TREM2 KO小胶质细胞外泌体制剂中的tau蛋白水平,发现来自TREM2 KO小胶质细胞的外泌体中tau蛋白水平显著增加(图7B,C)。
接下来,作者团队确定了来自WT和TREM2 KO小胶质细胞的外泌体制剂是否能在HEK-293衍生的tau蛋白FRET报告系(tau- RD)中诱导随后的tau蛋白播种,并检测了在小鼠大脑中立体定向注射WT或TREM2 KO外泌体制剂的效果(图7D)。首先,作者团队在WT和TREM2 KO小胶质细胞中诱导和纯化了含有LPS/ATP的外泌体,无需tau蛋白预孵育(“无tau蛋白”)或存在tau蛋白寡聚物(“+ tau蛋白”),或TREM2 KO小胶质细胞在存在tau蛋白时添加外泌体抑制剂GW4869(“+ tau蛋白,+外泌体抑制剂”)。然后,将tau- RD细胞与外泌体制剂一起孵育并通过FRET成像和分析来检测tau种子(图7E)。结果发现,与tau寡聚物处理的WT小胶质细胞制备的外泌体相比,暴露于tau寡聚物的TREM2 KO小胶质细胞的外泌体显示出更多的tau FRET活性(图7E,F)。在不存在tau,或存在tau并添加GW4869的情况下,在来自WT或TREM2 KO小胶质细胞的外泌体制剂中tau RD细胞中没有观察到tau种子活性(图7E,F)。
为了确定负载tau蛋白或未负载tau蛋白 (对照) 的WT和TREM2 KO小胶质细胞的外泌体制剂是否能在体内诱导tau蛋白病理,作者团队用LPS/ATP刺激WT和TREM2 KO小胶质细胞,并将来自条件培养基的纯化外泌体立体定向注射到WT小鼠海马中。在注射外泌体21天后处死小鼠对其大脑进行组织学切片并AT8染色(图7G)。结果观察到注射没有tau蛋白负荷的WT和TREM2 KO小胶质细胞的外泌体制剂的动物海马中没有AT8阳性细胞(“无tau蛋白”);而负载tau的WT和TREM2 KO小胶质细胞外泌体制剂都在一定程度上诱导了海马AT8-tau病理,并且负载tau的TREM2 KO小胶质外泌体诱导的tau病理显著增强(图7G,H)。这些结果表明,TREM2的缺失可以增强小胶质细胞的外泌体途径,并通过外泌体增加tau的播种能力。
 图7.TREM2 KO外泌体表现出增强的tau播种活性
图7.TREM2 KO外泌体表现出增强的tau播种活性
小结
作者团队提供了开创性的证据证明TREM2的缺失可以增强tau蛋白在海马体中从MEC向DG的传播,这与小鼠的行为恐惧和记忆缺陷相一致。TREM2的功能通常会减少tau蛋白向小胶质细胞中晚期内体/MVBs和外泌体囊泡的转运,以限制tau蛋白的分散和播种。
此外,TREM2的缺失可以影响小胶质细胞内内化货物的细胞内运输。表明除了免疫信号外,适当的TREM2功能可能在小胶质细胞内运输途径中很重要。由于TREM2功能障碍先前已被证明影响Aβ斑块的病理,这些结果也巩固了TREM2在改变Aβ和tau的病理以及与Aβ和tau相关的神经退行性影响方面的双重作用。总之,本研究的结果暗示了TREM2在tau发病和扩散早期的保护作用,早期干预可能阻止或延迟AD中tau相关病变的整体效应和其他潜在相关的tau病疾病理。
作者:brainnew神内神外
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言