Cancer Discovery:追踪化疗后的顽抗癌细胞,揭秘高危神母复发机制
昨天 儿童肿瘤前沿 儿童肿瘤前沿
研究利用单细胞核RNA测序和全基因组测序技术,识别并表征了在治疗期后仍存活的恶性癌细胞,揭示其化疗逃逸机制与化疗后肿瘤微环境的改变及NFκB通路激活有关,为降低高危神经母细胞瘤的复发率提供了关键思路。
高危神经母细胞瘤是一种起源于发育中的交感神经系统的儿童癌症,具有很强的化疗耐药性及隐匿性。尽管患者从放射学检查(如 X 射线、CT、MRI 等)结果来看,肿瘤似乎已经完全消失或得到了极大的缓解,但实际上一小部分恶性细胞在化疗后仍然存活,而且有可能导致后期的癌症复发。有统计表明,高危神经母细胞瘤的复发率约为40%~60%。面对这样一个狡猾的对手,早先的研究未能解释这些“前朝余孽”导致神母细胞瘤高复发率的原因。
近日,Liron D. Grossmann 等科学家在 Cancer Discovery 上发表题为 Identification and characterization of chemotherapy resistant high-risk neuroblastoma persister cells 的文章,研究利用单细胞核RNA测序和全基因组测序技术,识别并表征了在治疗期后仍存活的恶性癌细胞,揭示其化疗逃逸机制与化疗后肿瘤微环境的改变及NFκB通路激活有关,为降低高危神经母细胞瘤的复发率提供了关键思路。

研究人员从费城儿童医院选取了 2009~2022 年间治疗的20例高危神经母细胞瘤患者(图2)的匹配诊断和确定性手术样本,这些患者在治疗期均接受过高强度诱导化疗后接受了手术治疗。利用单细胞核RNA测序技术,研究者从取自患者样本的248,591个细胞核中区分出恶性细胞和非恶性细胞(包括免疫、间充质、内皮和施万细胞等),并进一步识别出化疗耐药持久细胞。
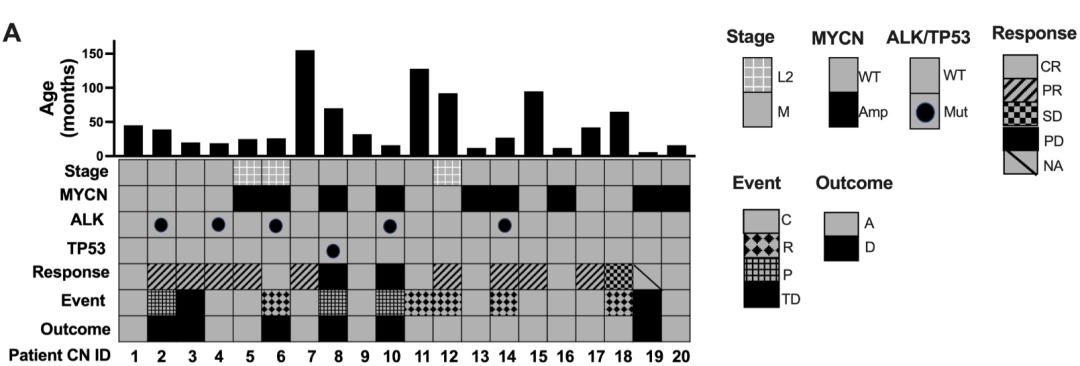
图2 20 例高危神经母细胞瘤患者在诊断和手术切除时的配对匹配队列的患者特征。包括患者的 CN ID、Stage、MYCN、ALK、TP53、Response、Event、Outcome 等信息。
研究发现,确定性手术后,恶性细胞显示出统计学上显著的减少(p = 0.013,配对 Wilcox 检验),施万细胞显著增加p = 0.006,配对 Wilcox 检验)。癌症相关成纤维细胞(CAFs)的亚群在化疗后增加,其中炎症性CAFs(iCAFs)显著增加。(图3C)肿瘤相关巨噬细胞(TAMs)在化疗后也增加,且在MYCN扩增和非扩增两种状态的肿瘤中均有增加。这说明化疗重塑了神经母细胞瘤的恶性和肿瘤微环境的细胞组成,导致了肿瘤内和肿瘤间较大的异质性。
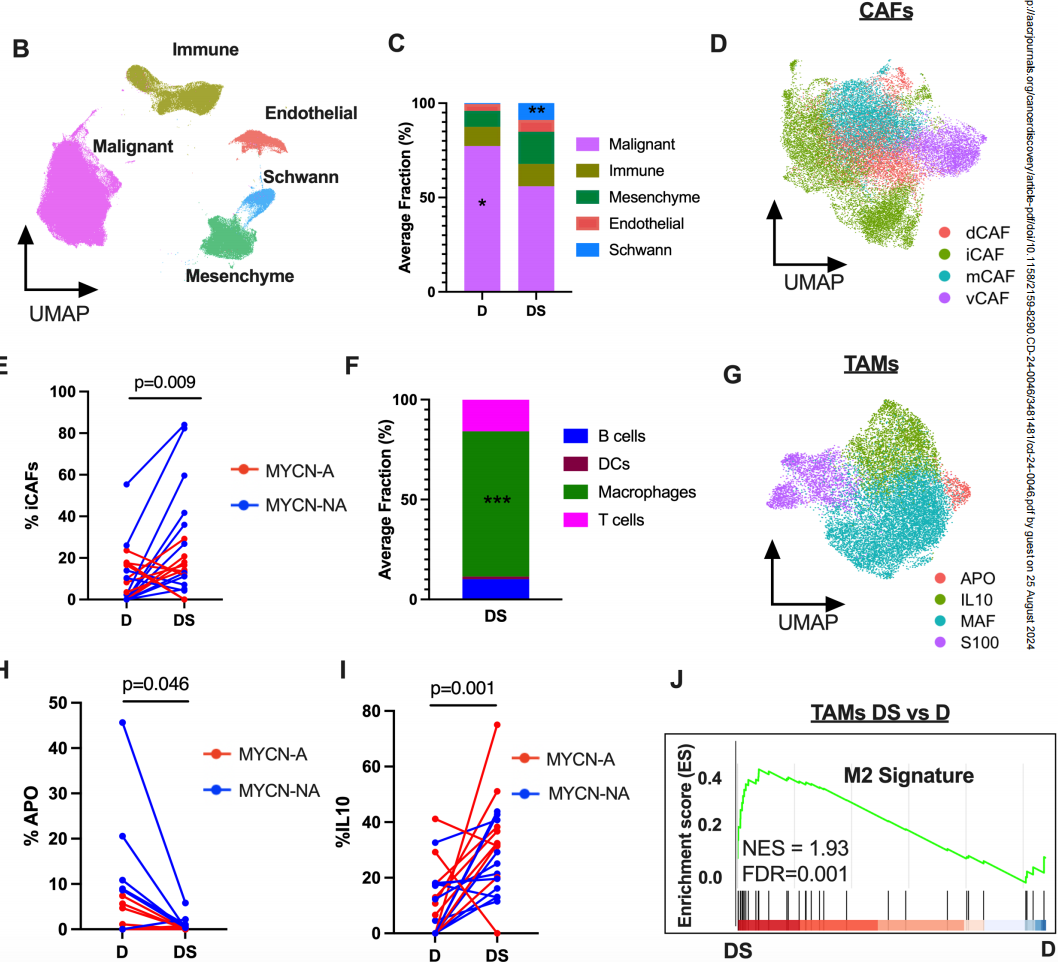
图3
通过聚类分析化疗后残存的癌细胞,研究人员识别到四种四种转录持久细胞亚型:循环型、NFκB/Stemness型、NFκB/Stress型和神经元型。其中,NFκB/Stemness表现为干细胞标志物如 CD44 和 KLF6 的高表达,在确诊治疗前就存在的亚型,而NFκB/Stress则表现为因为后天环境压力(如化疗药物)干预而激活NFκB信号的亚型。循环型持久细胞几乎只在具有 MYCN 扩增且携带 TP53 或 ALK 突变的肿瘤中出现,且具有相对高的MYC(N)基因活性。该亚型持久细胞比例高的患者生存时间最短(20例样本中有3例),并死于进行性或复发难治性疾病。(图4 H) NFκB/Stemness型持久细胞在 MYCN 非扩增肿瘤的患者中占主导地位。
一般来说,MYC(N)表达活性高会驱动神经母细胞瘤持续生长和增殖。通过基因集富集分析(GSEA)分析发现,在MYCN 扩增类型的神经母细胞瘤中,非循环持久细胞中的 MYC(N)活性却是受抑制的。不过当神经母细胞瘤复发时,MYC(N)活性会恢复增加(图 4K)。这一结论在体外培养中也得到了验证(图 4L)。
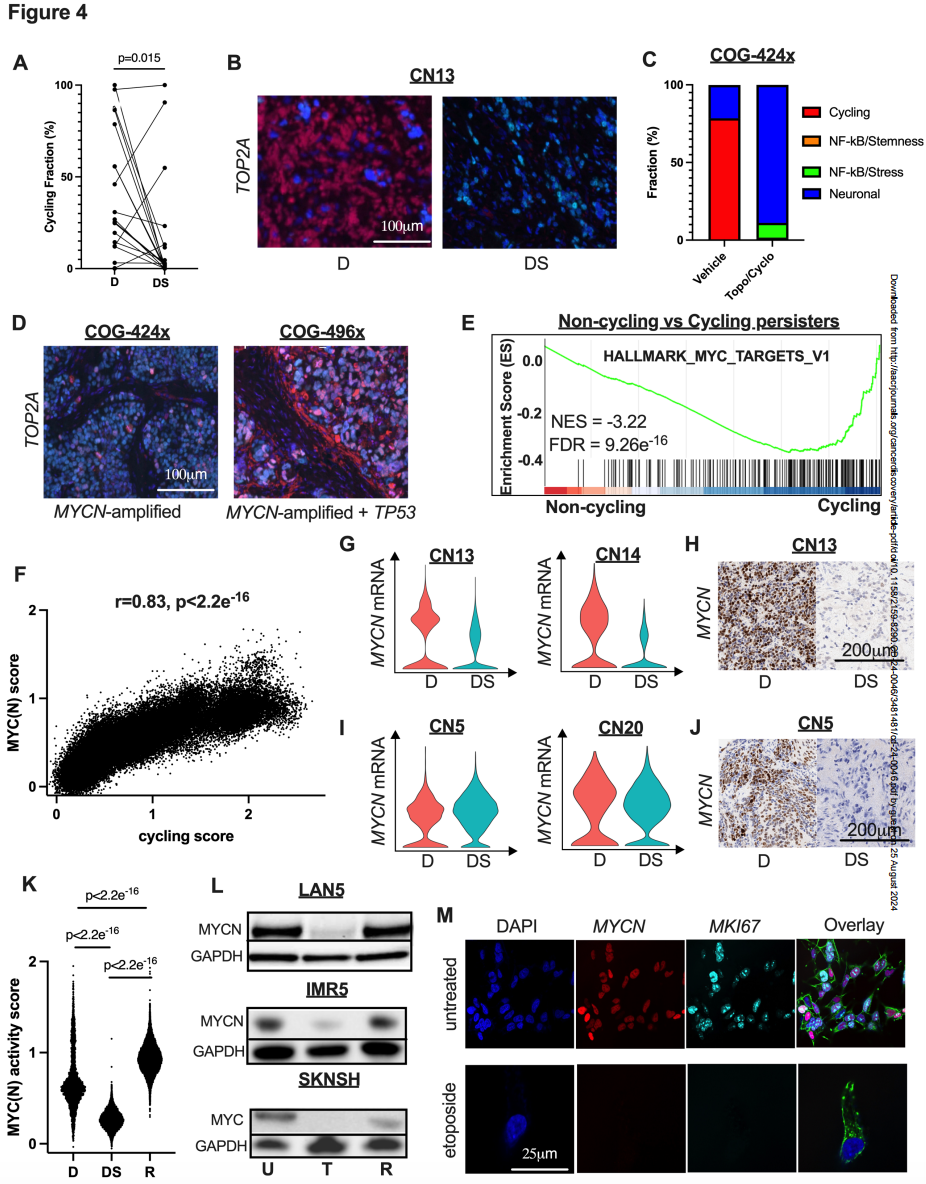
图4
至于活性在复发时增加的机制,研究人员认为有两种。一种是化疗主要杀死的是非循环、低 MYC(N)活性的恶性细胞,一小部分高 MYC(N)活性的细胞亚群逃脱了化疗期,并在药物洗脱后生长。另一种潜在机制是单个恶性细胞在化疗药物的攻击下下调 MYCN mRNA / 蛋白质,并在治疗期结束到癌症复发期间上调了表达,好似“野火烧不尽,春风吹又生”。尽管两种机制都有可能,但研究者们认为在看似同质的细胞系中,后一种机制的几率更大。不过,直接证明这一结论的数据还需要谱系追踪实验来明确。
研究者们通过一系列细胞实验及动物实验证实,非循环持久性细胞中,高活性的NF-κB 能够让癌细胞产生耐药性。细胞的间充质状态能够激发这种高活性,肿瘤微环境中诱导型 CAFs(iCAFs)频率的增加与 NF-κB / Stemness持久细胞亚型的频率增加呈正相关,而 IL10 TAMs 和 NF-κB / stress亚型的频率增加显示出正相关。(图 5B)
既然NF-κB 激活会导致癌症的持续进展,那阻断这一信号通路是否有可能降低复发率呢?这一假设在动物试验中得到证明。研究人员分别用依托泊苷,以及依托泊苷和 JSH-23(一种特异性的 NF-κB 抑制剂)的组合方案治疗患人类同源癌症的小鼠,发现前者的肿瘤在治疗中进展,而用依托泊苷和 JSH-23的组合方案治疗的小鼠的肿瘤没有生长了(图 5G 和 5H)。
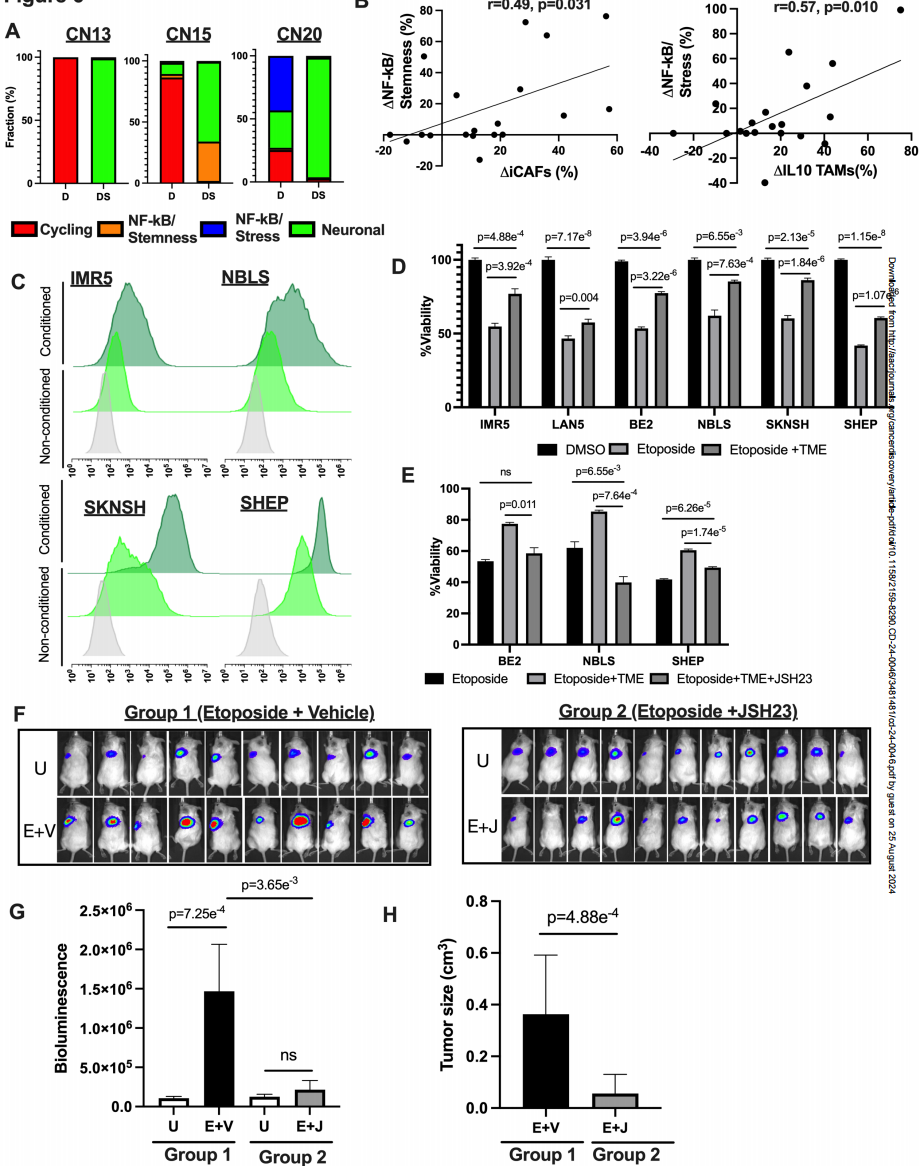
图5
本研究数据详实丰富,虽仍有不足之处,如样本绝对数少,但它帮助我们深入地理解了神经母细胞瘤的各种细胞亚型及其临床结果的关联,以便在后续治疗中医生能采用更加个体针对性的方案或药物,改善神经母细胞瘤患者的预后,将复发风险降至最低。
作者:儿童肿瘤前沿
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#神经母细胞瘤# #全基因组测序# #单细胞核RNA测序#
24