最大亚洲患者队列:SMARCA4缺失型肺癌的基因图谱及生存预后,大细胞肺癌常见!
2024-04-30 苏州绘真医学 苏州绘真医学
本研究证实了SMARCA4 IHC在识别SMARCA4变异肿瘤中的必要性,这可能在LCC和无已知驱动事件的肿瘤中特别重要。
SMARCA4突变已成为肺癌预后不良的生物标志物,并在癌症治疗中具有潜在的预测价值,但缺乏针对哪些患者需要进行检测的建议。在一个免疫组织化学分型的非小细胞肺癌(NSCLC)大队列中全面研究了SMARCA4变异及其临床病理意义。通过免疫组织化学(IHC)研究了总共1416名患者是否存在SMARCA4缺陷。随后,对其中397例患者的肿瘤进行了全面的测序,以研究SWI/SNF和SMARCA4变异的突变谱。2.9%的NSCLC患者存在IHC SMARCA4缺陷。在测序的肿瘤中,38.3%显示SWI/SNF复合体变异,9.3%有SMARCA4突变。值得注意的是,SMARCA4变异在大细胞癌(LCC)中比其他组织学肿瘤亚型更普遍。SMARCA4缺陷型和SMARCA4突变型肿瘤分别占全部LCC的40.5%和51.4%。多变量分析证实SMARCA4突变是肺癌的独立预后因素。部分肿瘤的免疫表型常表现为TTF1阴性和HepPAR1阳性。SMARCA4突变或其缺陷与有吸烟史和不良预后相关,且与EGFR突变相互排斥。综上所述,SMARCA4变异在LCC中的高发生率可能提示其诊断和预后价值。本研究证实了SMARCA4 IHC在识别SMARCA4变异肿瘤中的必要性,这可能在LCC和无已知驱动事件的肿瘤中特别重要。
研究背景
在许多癌症中,哺乳动物SWI/SNF染色质重塑复合体的变异已成为重要的致癌事件。SWI/SNF复合物由15个蛋白质亚单位组成,其中最具临床重要性的亚单位包括SMARCA4、SMARCB1/INI1和ARID1A。它们的变异通常是失活或缺失,可以在上皮癌、肉瘤和横纹肌样瘤中观察到。这些蛋白亚单位功能缺失的最终结果被认为是SWI/SNF复合体的不稳定,导致核小体结构的改变,从而导致异常转录激活或SWI/SNF与其他癌基因之间的异常相互作用。在胸部肿瘤中,SMARCA4突变见于一个独特的高级别胸部肉瘤亚群,这一亚群后来构成了一个独特的诊断实体,称为“胸部SMARCA4缺陷未分化肿瘤”。进一步研究表明,SMARCA4变异也可能与5-15%的NSCLC相关,特别是一些以实性为主或明显坏死的腺癌。然而,关于哪些NSCLC患者需要对SMARCA4突变状态进行辅助检查,目前缺乏标准建议。
了解NSCLC是否携带SMARCA4突变具有几个临床意义。首先,SMARCA4突变与这些患者的预后较差相关,可能需要更积极的随访或治疗。其次,研究发现SMARCA4突变与高肿瘤突变负荷(TMB)相关,而与PD-L1表达低或阴性相关。因此,虽然其中一些患者可能PD-L1表达低,但一些SMARCA4突变癌症患者可能因与高TMB相关而适合接受免疫治疗,这些可能通过二代测序(NGS)进一步证实。第三,虽然SMARCA4变异尚未成为可用于治疗的靶点,但SMARCA4突变可能与化疗(如顺铂)耐药相关,此外一些正在开发中的新型靶向疗法(如CDK4/6抑制剂)可能使这些患者获益。
鉴于这些意义,在一些NSCLC患者中识别SMARCA4突变可能至关重要。虽然二代测序可用于这一目的,但该技术在许多中心的广泛使用仍然有限。免疫组织化学(IHC)仍然是更容易获得的诊断方法,但有必要确定哪些亚群的NSCLC患者将从SMARCA4表达状态的常规调查中获益。另一个困难在于,一些SMARCA4变异(例如称为2类变异的错义突变)无法通过IHC检测到。
因此,在本研究中,研究者首先根据世界卫生组织(WHO)分类标准,使用IHC对该机构的一个大队列NSCLC患者的组织学类型进行了全面表征,以达到标准化组织学诊断。LCCs通过其缺乏分化和缺乏TTF-1和p40表达来鉴定。随后,研究者系统地研究了这些NSCLC患者的免疫组化谱和SMARCA4蛋白复合物的突变状态,以提供与病理结果和临床结果的相关性。特别是,研究者检查了之前记录的与干细胞特性相关的标志物,如SOX2和SALL4,以及HepPar1,据报道,HepPar1存在于SMARCA4缺失的肺腺癌中,并反映肝样分化。Claudin 4被用于确定NSCLC的上皮性质,因为在SMARCA4缺失的胸部未分化肿瘤或肉瘤样恶性肿瘤中,Claudin 4可能呈阴性。SMARCA2是SWI/SNF复合体的另一个成分,在SMARCA4缺陷的肿瘤中也可以显示缺失。研究者还检查了肺癌中的SMARCA4变异是否与其他驱动突变和易获得的IHC标志物相关。由于现有数据主要来自白种人队列,因此在亚洲患者中研究这些特征很重要,而已知亚洲患者与白种人患者相比,有不同的吸烟史、驱动突变背景和治疗应答。综上所述,研究者试图提供一个全面的临床病理分析,严格的IHC亚型肺癌,并探讨在NSCLC诊断路径和实践中的意义。据研究者所知,本研究代表了对SMARCA4变异及其临床病理意义进行详细研究的最大的亚洲患者队列。
研究结果
NSCLC患者的SMARCA4缺陷:
研究者在由1416例手术切除的NSCLC患者组成的队列中,通过IHC评估了SMARCA4缺陷,并研究了SMARCA4缺陷的IHC结果对患者临床病程的影响。经IHC评估的SMARCA4缺陷被定义为完全失去染色。该队列包括982例腺癌、275例鳞状细胞癌、37例LCCs和122例其他组织学亚型的肿瘤,经形态学和IHC结果证实。在41个肿瘤(2.90%)中发现SMARCA4表达缺失,在LCC中最常见(15/37,40.5%)(表1)。在腺癌和鳞状细胞癌中,SMARCA4缺陷的发生率分别为2.3%和1.1%。除了组织学类型外,男性性别、有吸烟史、肿瘤增大和阳性PD-L1(TPS≥1%)表达似乎显示出与SMARCA4缺陷相关(表1)。
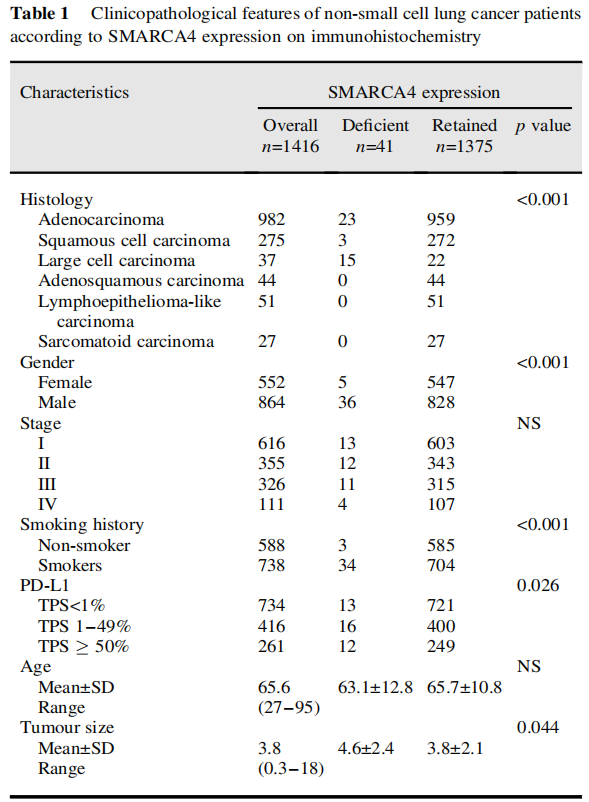
表1
在本队列中,LCC占所有肿瘤的2.6%。所有LCC均为EGFR突变阴性,3例KRAS突变,1例ALK阳性,经IHC评估。HepPar1染色了相当大比例(40%)的SMARCA4缺陷型LCC(图1A,表2)。同时,SMARCA4缺陷型腺癌(图1B,C)倾向于发生在曾经吸烟的男性患者中(表3)。免疫组织化学结果显示,这些肿瘤更多为TTF1阴性。分子检测显示,这些肿瘤中的大多数也呈EGFR、ALK和KRAS驱动突变阴性。SALL4在少部分病例中异常表达。尽管大多数SMARCA4野生型腺癌没有PD-L1表达(TPS<1%),但比例增加的SMARCA4缺陷型腺癌有PD-L1阳性表达(TPS>1%)(表3)。同时,CD8-淋巴细胞密度在SMARCA4缺陷组和SMARCA4保留组之间似乎没有显著差异。
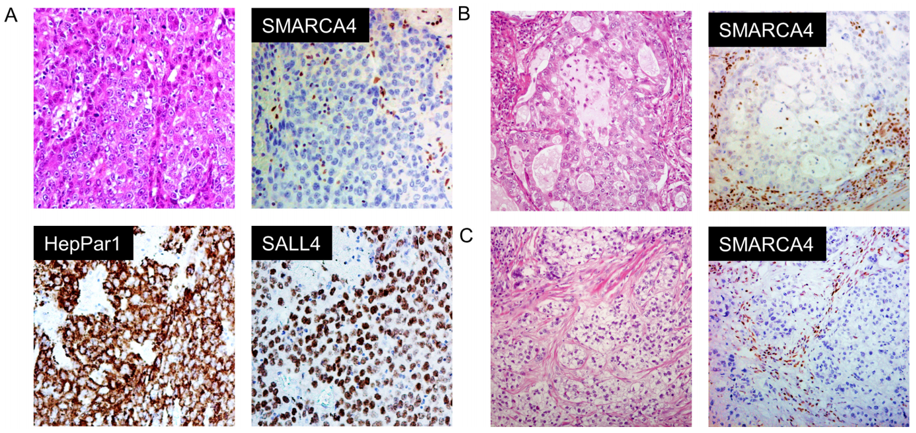

图1
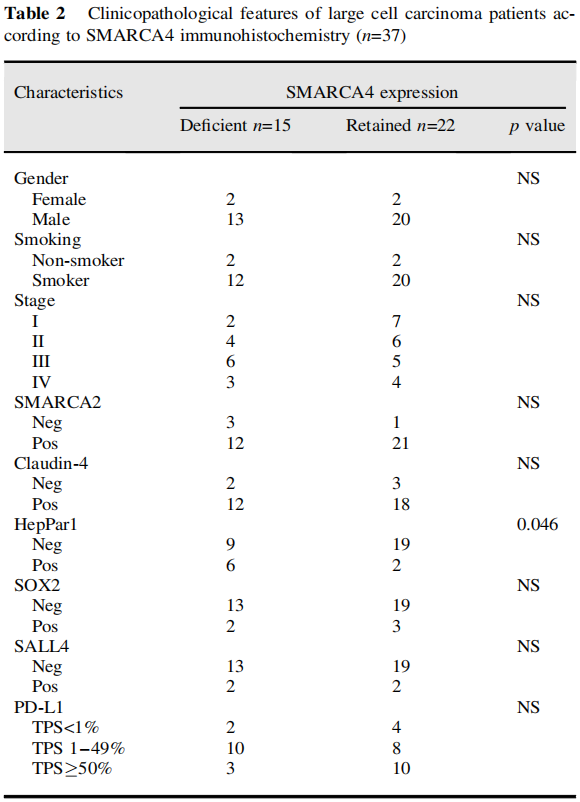
表2
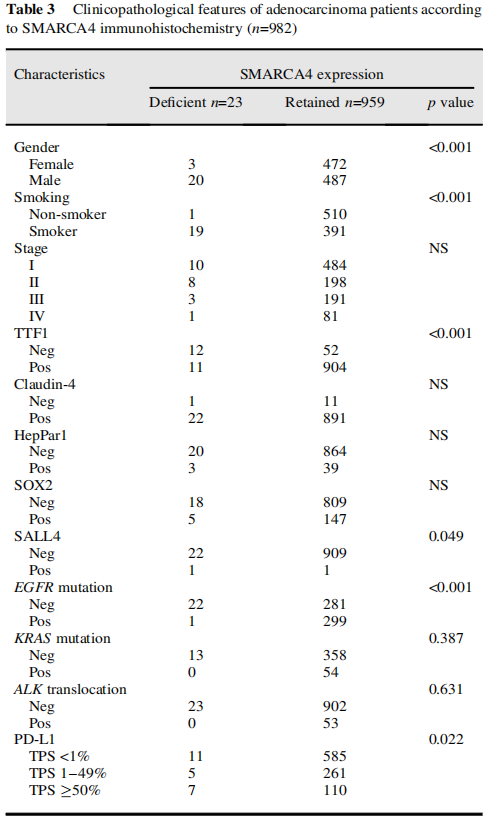
表3
研究者采用Kaplan-Meier曲线分析本队列NSCLC患者的总体生存情况,如图2所示。平均随访时间为58.4个月(范围:0.065-288.35个月)。SMARCA4缺陷的NSCLC患者的中位生存期为42.4个月,而无SMARCA4缺陷的患者为157.7个月(log-rank p=0.001)(图2A)。在腺癌中,SMARCA4缺陷患者的中位生存期为66.54个月,而无SMARCA4缺乏患者的中位生存期为172.1个月(log-rank p=0.036)(图2B)。
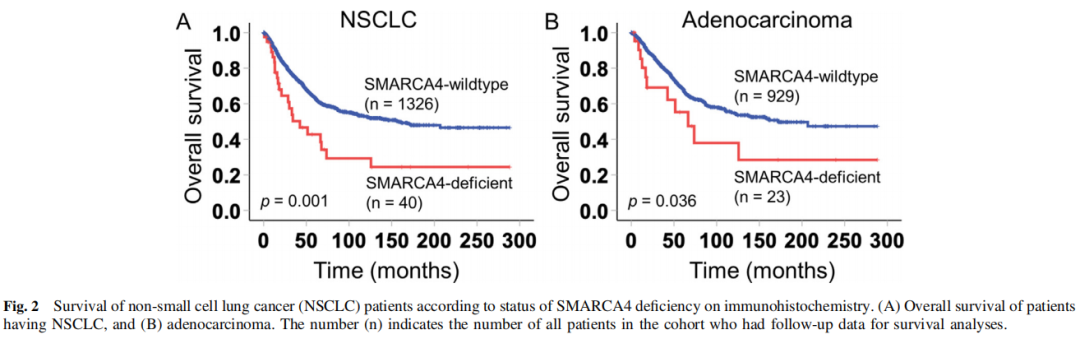
图2
NSCLC中SWI/SNF和SMARCA4变异:
为了表征SMARCA4缺陷肿瘤的分子谱,研究者对来自IHC研究队列的397例患者进行了NGS分析。其中腺癌254例,鳞癌106例,LCC 37例。该队列包含了每个组织学组的代表性比例,以提供每个亚型的总体情况,而所有LCC患者都被纳入该队列,因为患者数量相对较少,并且在这一组中发现了显著的SMARCA4缺陷。患者年龄为64.9±11.5岁,女性占33.8%,从不吸烟者占34.8%。152例(38.3%)患者存在SWI/ SNF复合体相关基因变异。50例(12.6%)肿瘤存在不止一个SWI/SNF复合体相关基因变异。共检测到14个SWI/SNF家系基因的231个突变,包括56例患者中符合1类突变(无义突变、剪接位点、移码突变、大片段缺失)的72个突变;和96例患者中符合2类突变(错义突变,所有其他意义未知的变异)的159个突变(表4)。SWI/SNF家族中最常见的突变基因是ARID1A、SMARCA4、ARID1B和ARID2(图3A)。值得注意的是,没有任何肿瘤同时出现SMARCA4(9.3%的所有患者)和SMARCA2(4.0%的所有患者)变异,这可能与已知的对肿瘤细胞的合成致死效应(与SWI/SNF复合物相关)相一致。
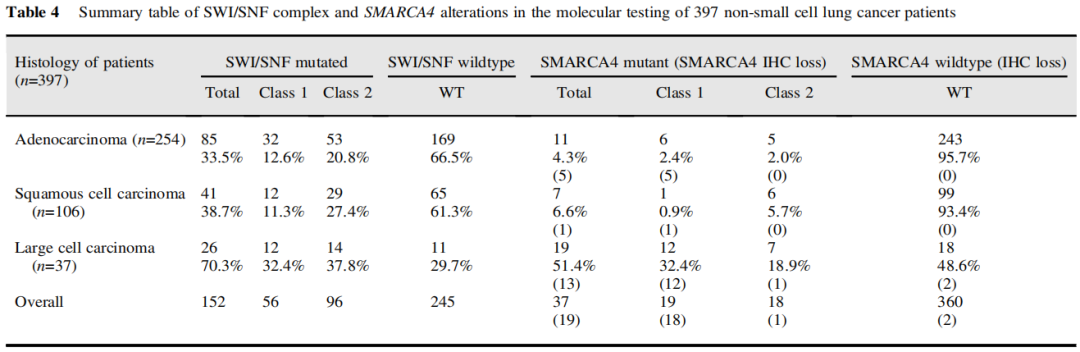
表4
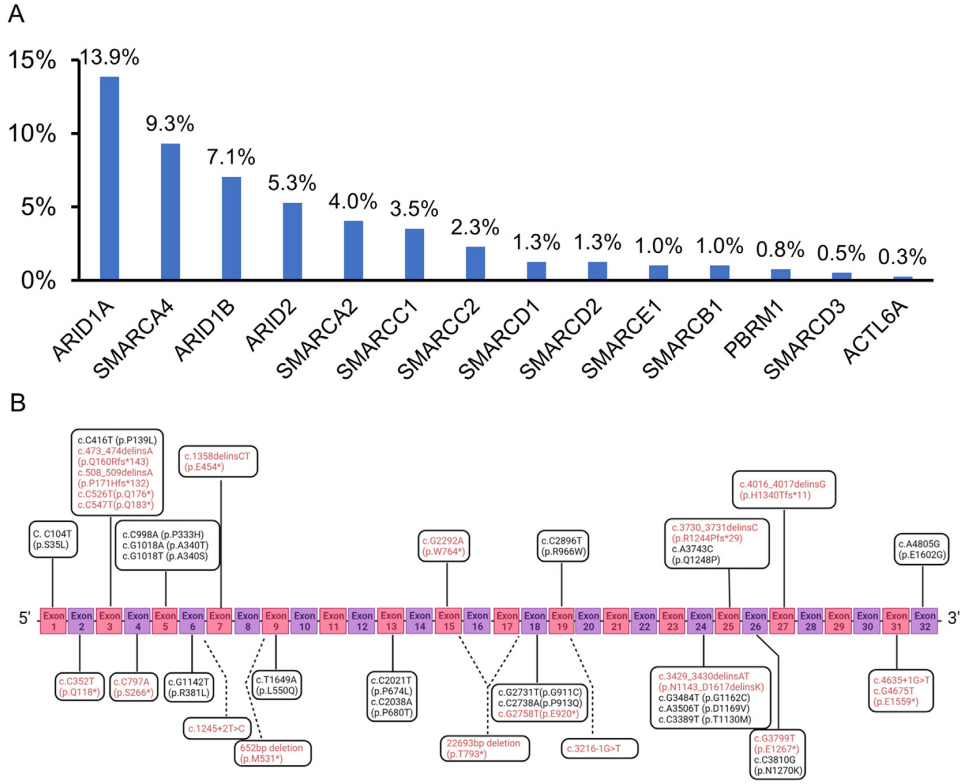
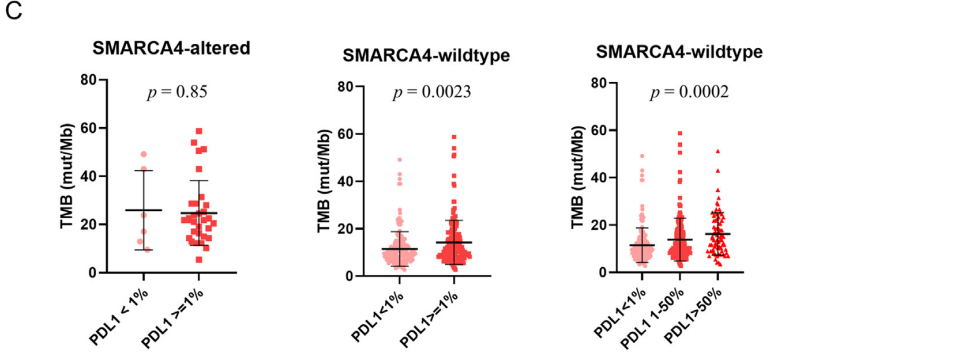

图3
同时,在所有分析的397例NSCLC中有37例(9.3%)发现SMARCA4突变,在LCC中发生率最高(19/37,51.4%;表4),显著高于其他各组。这些突变包括符合1类变异的19个变异和符合2类变异的18个变异(图3B)。1类突变似乎在腺癌和LCC中更主要,但另一方面,2类突变似乎在鳞状细胞癌中过度表达。
研究表明,大多数SMARCA4 1类变异的病例存在IHC SMARCA4缺失或SMARCA4缺陷,而在2类变异的病例中不常见(表4)。仅在2例未携带SMARCA4突变的病例中检测到SMARCA4缺陷。因此,SMARCA4 IHC是SMARCA4突变的特异性标志物(对NGS队列的特异性=99.4%)。除了在LCC中的发生率增加,SWI/SNF和SMARCA4变异与吸烟、较高的肿瘤突变负荷和阳性PD-L1(TPS≥1)表达相关(表5)。TPS≥1%的SMARCA4缺陷型NSCLC和TPS<1%的NSCLC在平均TMB方面无显著差异,尽管在野生型的对照中观察到PD-L1表达水平增加似乎与逐步升高的TMB相关(p=0.0023,图3C)。
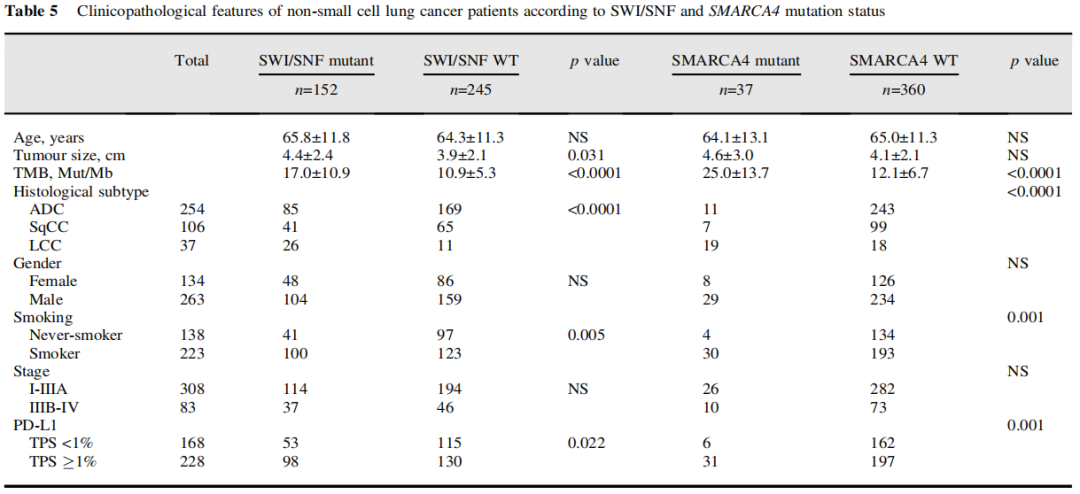
表5
此外,必须指出的是,虽然SMARCA4 IHC是SMARCA4突变的特异性标志物,但在2型突变中通常为阴性,因为错义突变仅在很小的范围内改变了蛋白质,SMARCA4抗体仍能识别这种蛋白质。然而,对于1型突变,在队列中SMARCA4 IHC检测缺失的敏感性为18/19例(94.7%)。
SWI/SNF突变与EGFR突变呈负相关,与TP53、NF1突变呈正相关,与其他常见驱动突变(如KRAS、ALK和ROS1)无明确关联(表6)。SMARCA4突变显示出类似的关联,但与KEAP1和STK11有额外的相关性。表7显示了RAS、KEAP1、STK11和P53基因共变异的肿瘤数量。
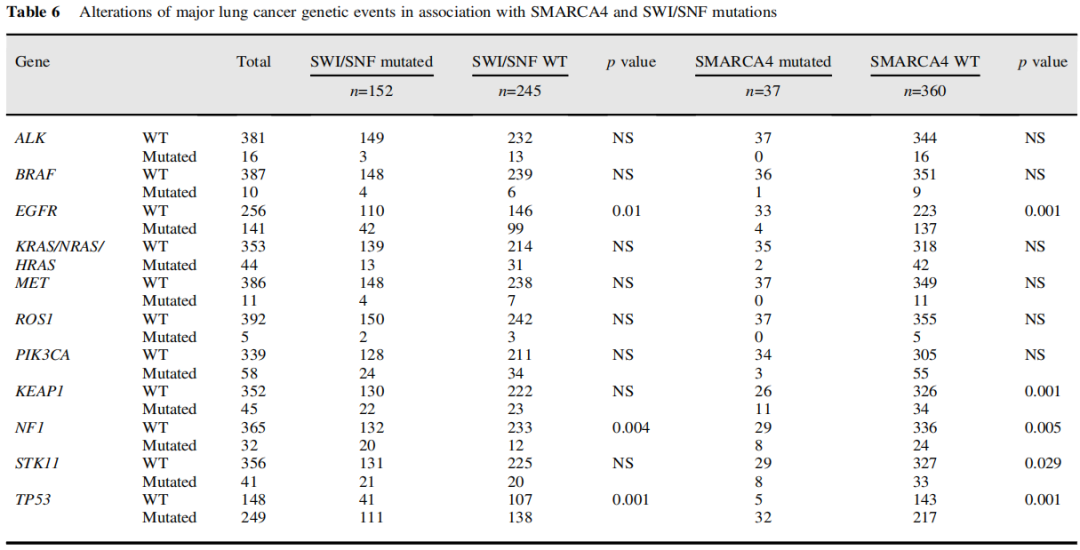
表6
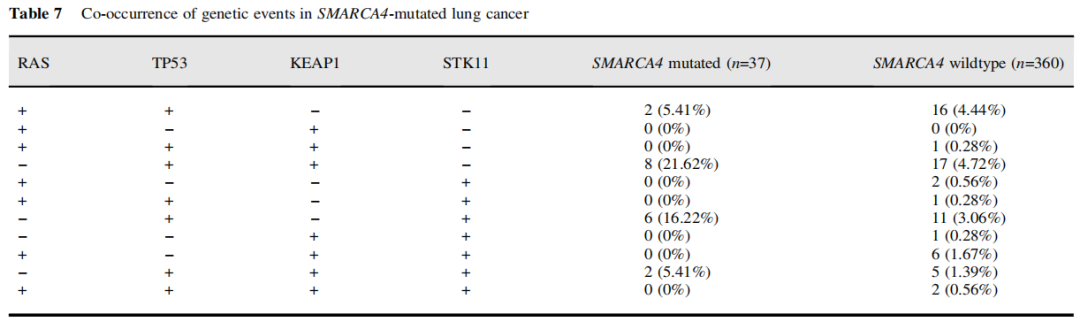
表7
SWI/SNF和SMARCA4变异患者的生存结局:
术后平均随访时间为54.7个月(范围:0.10-217.5个月)。重要的是,SMARCA4突变预示着NSCLC患者较差的预后(p=0.004)(图4A),1类变异患者的生存率低于2类变异患者(图4B)。SWI/SNF复合突变患者的总体生存情况如图4C、D所示。1类SWI/SNF突变患者的预后较差,但这主要归因于该组中SMARCA4变异的预后影响(图4D)。这表明SMARCA4在SWI/SNF复合体中相对于其他基因的临床重要性。

图4
研究者在SMARCA4突变的肿瘤中进一步分析了临床重要的预后因素。单变量分析显示SMARCA4突变(p=0.013)和晚期(p<0.001)与较差的生存率相关。在这项分析中,SMARCA4突变类型(1类或2类)似乎未证明相关性。进一步的多变量分析显示SMARCA4突变(p=0.014)和分期(p<0.001)是NSCLC患者队列中独立的不良预后因素(表8)。
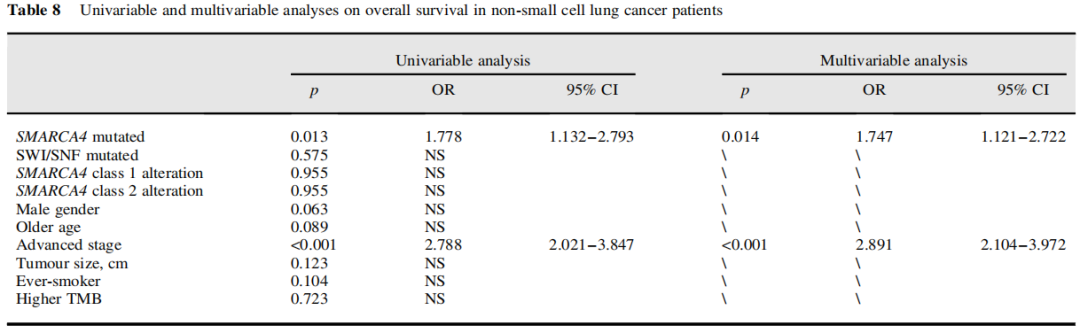
表8
讨 论
SWI/SNF变异已成为NSCLC的不良预后预测因素,但其在各种NSCLC组织学亚型中的发生情况、临床病理特征以及与IHC和分子谱的相关性尚不完全清楚。也有基于高加索人口的报告,而关于亚洲人口的数据则不那么全面。由于研究表明有SMARCA4变异的肿瘤具有更强的化疗耐药性,因此在临床上诊断肺癌中的这些变异变得越来越重要。本研究通过使用IHC提供精确的组织学亚型并进行分子研究,对一个大队列的NSCLC患者的SMARCA4变异进行了全面的临床病理分析。
目前发现了两类SMARCA4变异。SMARCA4的1类变异主要是截短突变、融合和纯合缺失,而2类变异是错义突变或意义不明的变异。1类变异导致向全长蛋白翻译的缺陷,表现为IHC上的蛋白表达缺失,即SMARCA4缺陷。而对于2类变异,取决于突变的性质,在大多数情况下SMARCA4表达是完整的。1类突变似乎比2类突变具有更大的预后意义,并导致最差的生存。据报道,在NSCLC队列中,SMARCA4变异的发生率约为5-15%。在本研究中,在所有测序的肿瘤中,9.3%携带SMARCA4突变,其中1类突变(如截短突变)和2类突变的比例似乎与癌症基因组图谱(TCGA)的研究结果基本一致。有趣的是,对TCGA队列进行的通路分析表明,携带SMARCA4突变的肿瘤中,以下基因的表达可能升高:包括发育、分化、代谢和有丝分裂过程相关基因。进一步的研究对于理解这些不同过程如何影响SMARCA4突变肿瘤的发生至关重要。
研究者分析的一个优势是在所有病例中使用IHC来确定肿瘤的组织学分类,其中腺癌由TTF1阳性支持,鳞癌有p40阳性支持,LCC由这两种标志物均不表达支持。本研究的一个重要发现是SMARCA4变异在LCC中富集。在NSCLC中,LCC是指在形态学和免疫组织化学上缺乏特异性分化的NSCLC,与较差的预后相关。研究者发现SMARCA4缺陷可能是相当大比例(约40.5%)该肿瘤的基础,这可能部分解释了LCC的侵袭行为。SMARCA4变异被认为在这一LCC亚群中起着关键的致癌作用。在本研究中,这些变异与肿瘤大、TMB高和PD-L1表达(TPS≥1%)相关。最近,一项研究报告了在SMARCA4缺陷的胸部肿瘤患者中,有前景的免疫治疗反应,其中大多数有反应的患者为PD-L1 TPS≥1%。另一份报告也表明SMARCA4缺陷的NSCLC具有较高比例的PD-L1 TPS≥1%。虽然研究者发现SMARCA4表达和SMARCA4缺陷的LCC之间没有显著的预后差异,但这种组织学实体的相对罕见可能为分析带来混杂因素。尽管如此,在临床实践中确定SMARCA4缺陷的LCC亚群可能是必要的,因为这可能预测对免疫治疗或化疗的应答。
由于LCC只能在广泛取样的切除标本中得到明确诊断,因此在小活检或细胞学检查中识别这一实体是不可能的。然而,超过70%的LCC患者表现为晚期疾病,这使许多患者无法接受手术,而且可能无法获得LCC的切除标本。因此,当活检或细胞学样本无特异性分化、TTF1和p40阴性、缺乏腺癌特有的驱动突变时,LCC始终是一种诊断可能性。这类患者可能特别受益于进一步的SMARCA4检测,因为SMARCA4变异可能在LCC亚组中显著富集。
同时,在本队列中,亚洲人群中腺癌的SMARCA4缺陷率约为2.3%,似乎低于高加索人群。在亚洲腺癌中,EGFR突变的高发生率似乎与SMARCA4缺陷相互排斥,这可能解释了这一发现。TTF1阴性和患者吸烟状态进一步与SMARCA4缺陷相关,这对这些患者的诊断提出了特别的担忧。至于鳞状细胞癌,SMARCA4变异不常见。SMARCA4突变预后意义的研究结果与以前的报道基本一致。值得注意的是,2019年的一项研究表明,在1013例NSCLC患者中,患者生存期较差,临床病程较侵袭性。尚不确定SMARCA4缺失是否可以解释该队列中观察到的生存差异。研究者发现SMARCA4缺陷和SMARCA4突变的肿瘤预示着更差的结局,而SWI/SNF变异并没有显著改变总生存期(图4),这似乎突出了SWI/SNF复合物中SMARCA4蛋白的预后重要性。与此同时,与本研究发现相似,Naito等人的论文也表明,在SWI/SNF表达缺失的肿瘤中,PD-L1阳性和肿瘤突变负荷增加,再次提示免疫治疗可能是这些患者的潜在治疗选择。
本研究存在一些局限性。最大的队列主要集中在SMARCA4 IHC研究,而不是测序研究。研究者推断,在目前的病理学实践中,IHC仍然是最容易获得的诊断方法。虽然SMARCA4缺陷可能无法在2类SMARCA4突变中被检出,但研究者认为一些2类突变可能是乘客突变,在临床实践中检测SMARCA4缺陷可能更有效和更容易获得。IHC表达缺失反映了当存在致病性突变时SMARCA4缺失的结果。另一方面,当没有SMARCA4突变时,不太可能出现SMARCA4缺陷。在这些病例中,无突变的表达缺失可能是由于表观遗传失活;例如,启动子甲基化或蛋白质翻译后调节。在没有SMARCA4突变的情况下,SMARCA4缺陷本身是否具有预后意义尚不确定,这需要对这一小部分患者进行进一步研究。
虽然目前的WHO分类并未推荐对NSCLC进行常规SMARCA4免疫组织化学检测,但越来越多的研究似乎表明,该标志物可能对患者的预后有显著意义,而且本研究表明,SMARCA4缺陷在LCC和腺癌中普遍存在。因此,本研究结果表明,以下用于识别SMARCA4缺陷的诊断方法可能适用于一些NSCLC患者:当缺乏鳞状分化,肿瘤的IHC结果为 TTF1阴性和p40阴性,并且分子研究显示无驱动突变时,应进行SMARCA4 IHC,因为这些患者亚群携带SMARCA4缺陷的概率较高。SMARCA4缺陷的存在高度提示该肿瘤具有预后最差的1类SMARCA4变异。通过分子分析检测2类SMARCA4变异,该类变异预示着比野生型肿瘤略差的预后,可能有助于将其纳入NGS基因panel。识别SMARCA4缺陷无疑将加深我们对NSCLC分子分型和亚型的理解。
参考文献:
Cheung, Alvin Ho-Kwan et al. “SMARCA4 deficiency and mutations are frequent in large cell lung carcinoma and are prognostically significant.” Pathology, S0031-3025(24)00056-4. 15 Feb. 2024, doi:10.1016/j.pathol.2023.12.414

作者:苏州绘真医学
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











感谢分享
5
#肺癌# #SMARCA4#
11