Nat Commun:双重阻断CD47和HER2能消除乳腺癌细胞的放疗抗性
2020-09-16 xiaozeng MedSci原创
放疗(RT)相比于化疗具有相对较小的全身性副作用,且被应用于所有亚型乳腺癌(BC)的治疗。然而,由于潜在的肿瘤放疗抵抗,最终可能会导致患者肿瘤复发或转移。
放疗(RT)相比于化疗具有相对较小的全身性副作用,且被应用于所有亚型乳腺癌(BC)的治疗。然而,由于潜在的肿瘤放疗抵抗,最终可能会导致患者肿瘤复发或转移。
目前,RT与靶向免疫疗法(TI)相结合的治疗策略正越来越多的用于各种癌症的治疗。尽管TI能够增强癌症放疗的效果,但放疗诱导的相关免疫抑制因子仍有待鉴定。
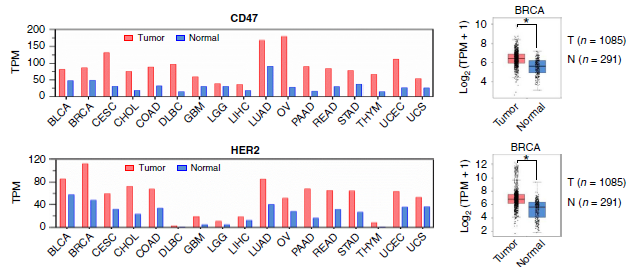
CD47和HER2在多种癌症中共表达
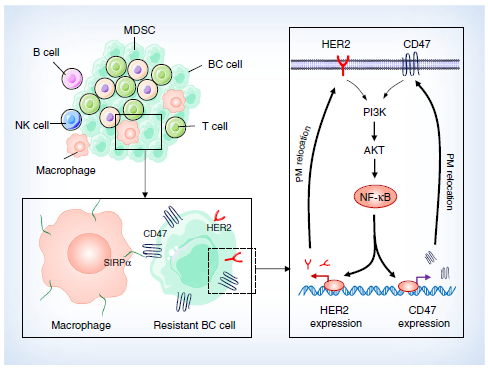
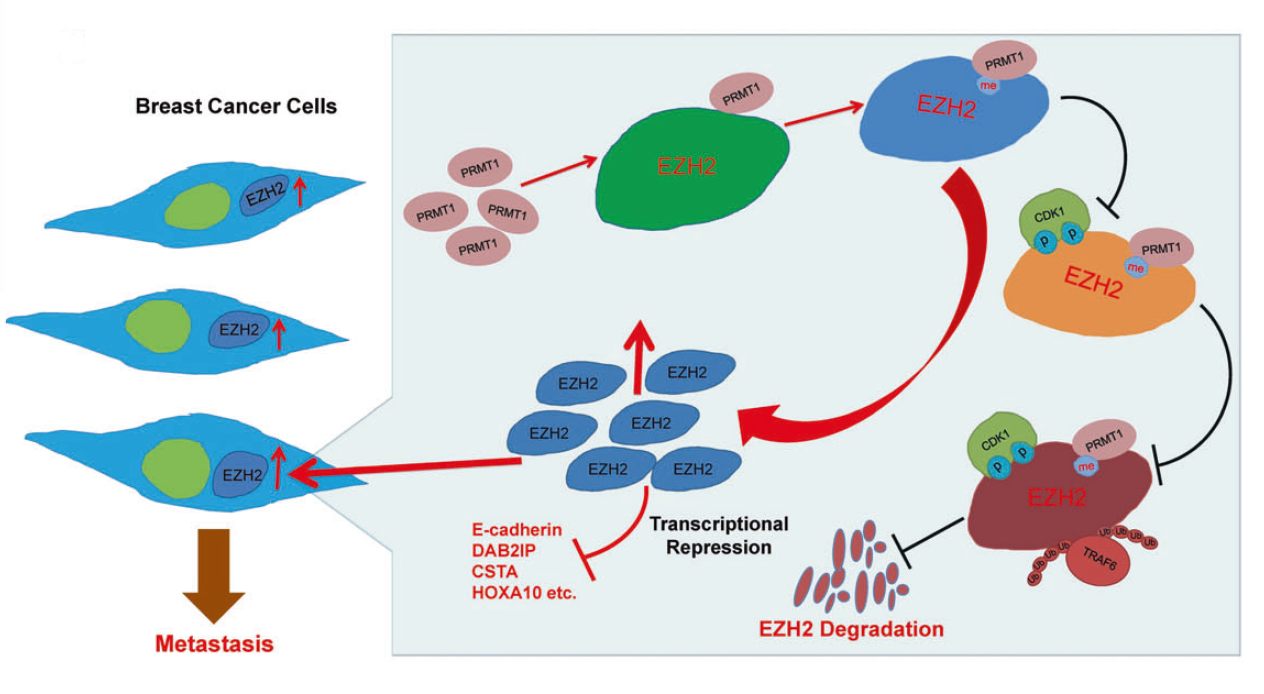
该研究发现,在放疗抗性乳腺癌(BC)细胞中,CD47介导的抗吞噬作用增强,同时HER2的表达水平也升高。在预后较差的复发性BC患者中,经常能够检测到这两种受体蛋白的共表达。在HER2表达的细胞中CD47的表达被优先上调,而阻断CD47或HER2的表达可同时降低这两种受体蛋白的水平,伴随着细胞集落形成能力的减弱和吞噬作用的增强。
双重阻断CD47和HER2与放疗具有协同抑癌作用
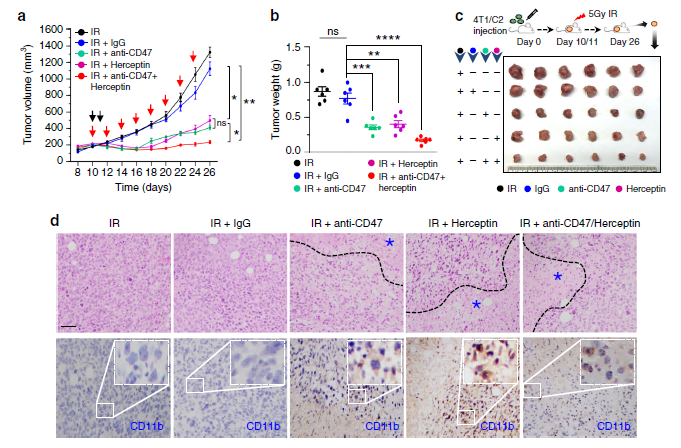
同样的,通过CRISPR技术双敲除CD47和HER2不仅能够抑制细胞集落的形成,且能够增强巨噬细胞对肿瘤细胞的攻击能力。进一步的研究显示,在同源小鼠乳腺肿瘤中,这两种受体蛋白的双重抗体与RT具有协同抑癌作用。
放疗抗性乳腺癌细胞模型
综上研究结果显示,具有放疗抗性的乳腺癌细胞的侵袭作用是由CD47介导的抗吞噬作用与HER2介导的细胞增殖作用共同引起的。CD47和HER2的双重阻断则可以抵消乳腺癌细胞的放疗抗性。
原始出处:
Candas-Green, D., Xie, B., Huang, J. et al. Dual blockade of CD47 and HER2 eliminates radioresistant breast cancer cells. Nat Commun 11, 4591 (14 September 2020).
作者:xiaozeng
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#CD47#
111
#CD4#
41
#阻断#
37
#COMMUN#
34
#Nat#
29