ASCO 2016:百时美免疫组合Opdivo+Yervoy一线治疗晚期非小细胞肺癌实现临床意义缓解
2016-06-06 佚名 生物谷
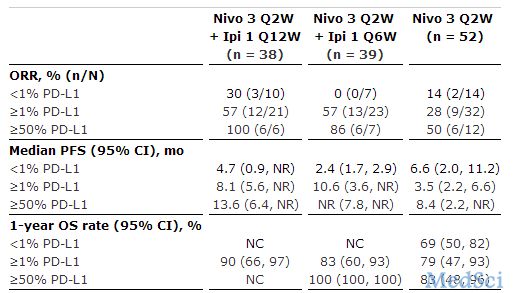
瑞士制药巨头罗氏(Roche)近日在2016年第52届美国临床肿瘤学会(ASCO)年会上公布了一项II期临床研究(IMvigor210)中PD-L1肿瘤免疫疗法Tecentriq(atezolizumab)用于既往未接受治疗(一线治疗)以及不适合顺铂为基础的化疗治疗的局部晚期或转移性尿路上皮癌(mUC)患者的的更新数据。数据显示,Tecentriq使24%(n=28)的患者肿瘤体积缩小,在实现

作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#ASC#
34
#非小细胞#
37
#百时美#
40
#Opdivo#
38
#Yervoy#
36