盘点:资本热捧,CRISPR加持,协同致死效应成为抗癌新药研发的一匹黑马
2017-04-12 BioTalker 奇点网
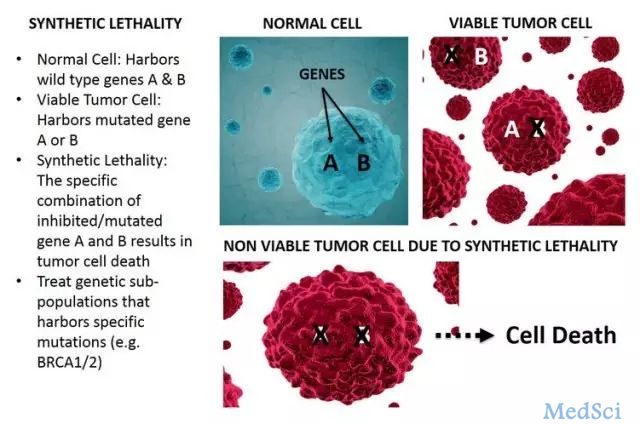
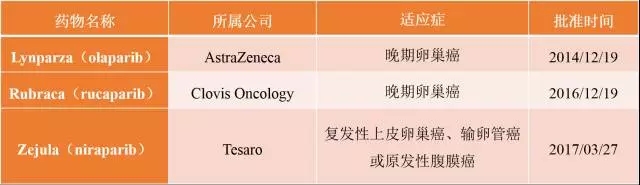
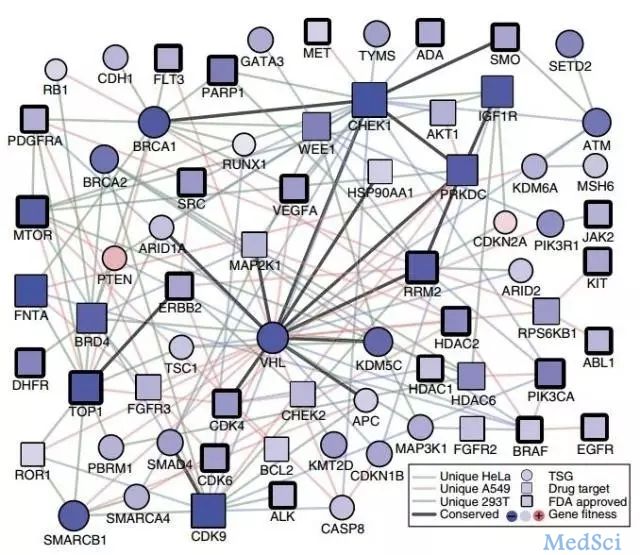
协同致死」领域风云再起,继去年5月初,IDEAYA Biosciences获得5AM、Celgene、诺华和药明康德投资的4600万美元A轮之后。上个月底,在Third Rock Ventures孵化了两年的Tango Therapeutics获得Third Rock Ventures的5500万美元A轮投资,正式宣布成立。

作者:BioTalker
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#资本#
41
#抗癌新药#
41
#CRISPR#
30
#研发#
33