Blood:我如何治疗免疫治疗后复发的B-ALL
2024-08-21 聊聊血液 聊聊血液
作者概述了一种系统的方法来管理免疫治疗后的复发,按CD19阳性复发、CD19阴性复发和LS进行分类。
尽管B细胞急性淋巴细胞白血病(B-ALL)的单抗原靶向治疗取得重大进展,但无反应和复发仍是主要挑战。在贝林妥欧单抗或CD19 CAR-T治疗后抗原逃逸、CD19阴性B-ALL或谱系转换(LS)为急性髓系白血病,都是目前的诊断和治疗难点。CAR-T输注后复发的患者预后不佳,特别是靶抗原丢失的患者,亟需诊断和治疗的策略。
Blood近日发表文章“How I treat post-immunotherapy relapsed B-ALL”,作者概述了一种系统的方法来管理免疫治疗后的复发,按CD19阳性复发、CD19阴性复发和LS进行分类。

在考虑B-ALL免疫治疗后复发的管理策略时,需要考虑许多因素,以便根据患者的具体情况最佳地定制治疗。这些因素包括目前的疾病负荷、既往接受的治疗、最近治疗的时间(如早期与晚期)、髓外病变(如中枢神经系统病变)、既往毒性(如神经毒性或肝毒性史)、累积治疗负担(如造血干细胞移植[HSCT]史)和分子靶点的可用性(如酪氨酸激酶抑制剂[TKI]用于费城染色体阳性[Ph+])。
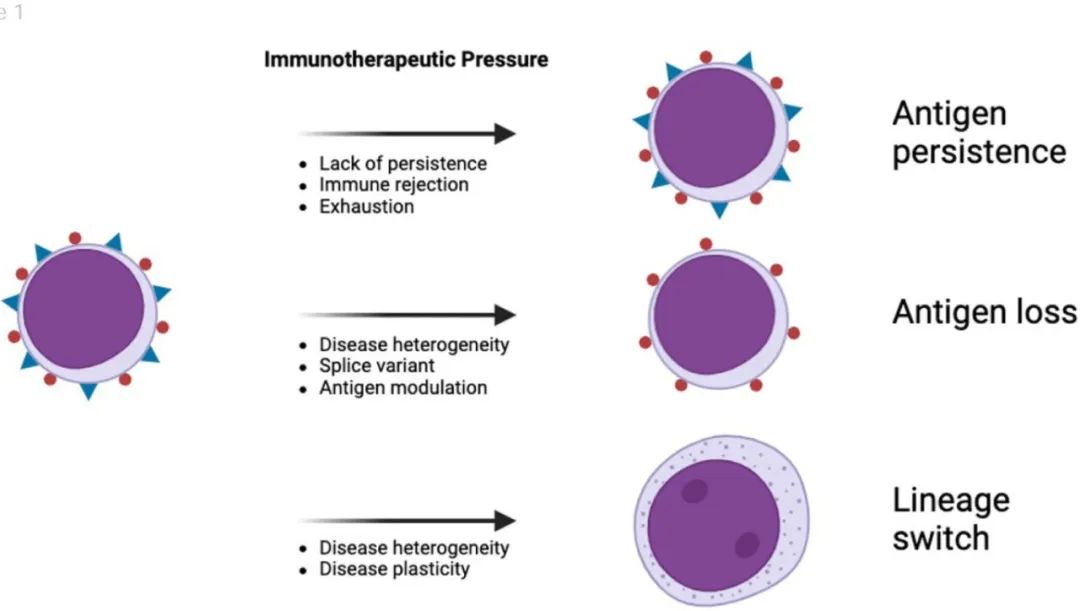
在选择治疗免疫治疗后复发的最优方案时,复发的免疫表型模式对治疗决策至关重要,免疫治疗后复发可大致分为三种主要的免疫表型模式:CD19阳性复发、CD19阴性复发和谱系转换。
CD19 CAR-T治疗后的监测策略
CD19 CAR-T后监测包括骨髓和脑脊液的常规评估。腰椎穿刺通常为诊断性,由于对CAR有潜在的细胞毒性风险,因此无需同时进行鞘内治疗。可以在输注后早期更频繁地进行监测(例如在输注后的前6个月进行2-3次评估),并在缓解期>6个月的患者中间隔进行评估。
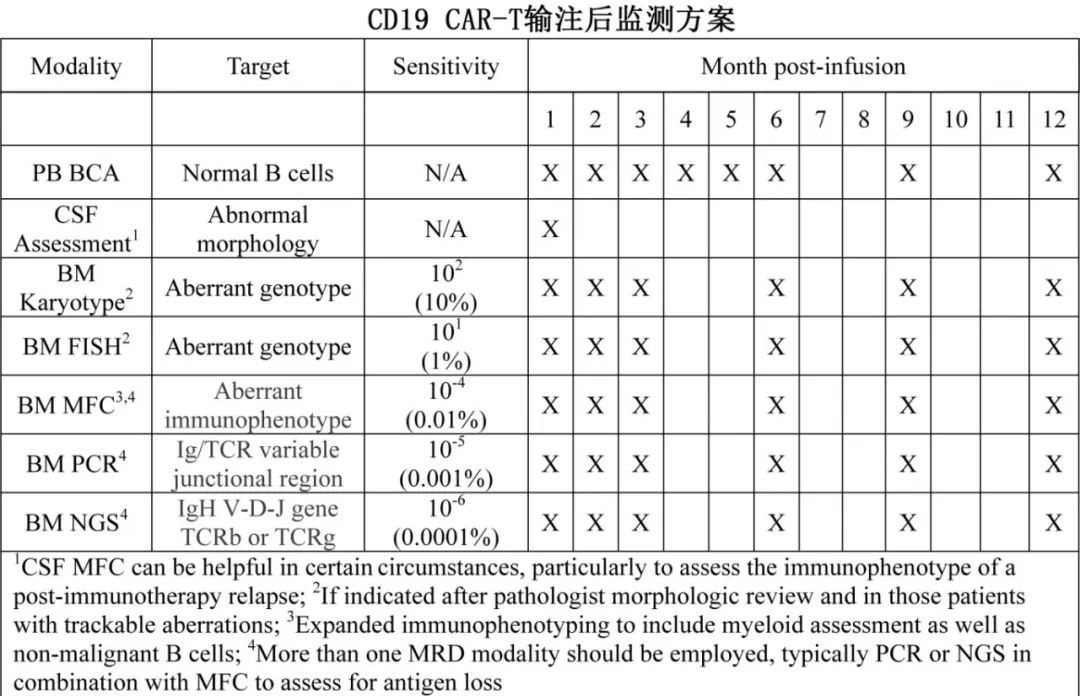
外周血B细胞再生障碍(B-cell aplasia,BCA)监测越来越多地用作B细胞靶向CAR-T细胞功能持久性的替代指标,并应在CAR-T后常规监测。早期BCA丢失(通常定义为输注后<6个月)是复发的先兆,可能需要更频繁的监测和/或干预。
使用clonoSEQ平台(Adaptive Biotechnologies)的二代测序(NGS)越来越多地应用于CD19 CAR-T后MRD评估。通过克隆跟踪B细胞和/或T细胞受体基因重排,clonoSEQ可提供比传统MFC或基于PCR的MRD评估更高的疾病检测灵敏度,任何阳性结果都是复发的直接预测因子。虽然目前仅被批准用于骨髓评估,但有关其在监测外周血中的作用的新数据也有所报道。最近对NGS-MRD监测在围HSCT期的回顾提供了clonoSEQ在B-ALL中最佳使用的额外认识。
免疫治疗后复发的B-ALL如何治疗
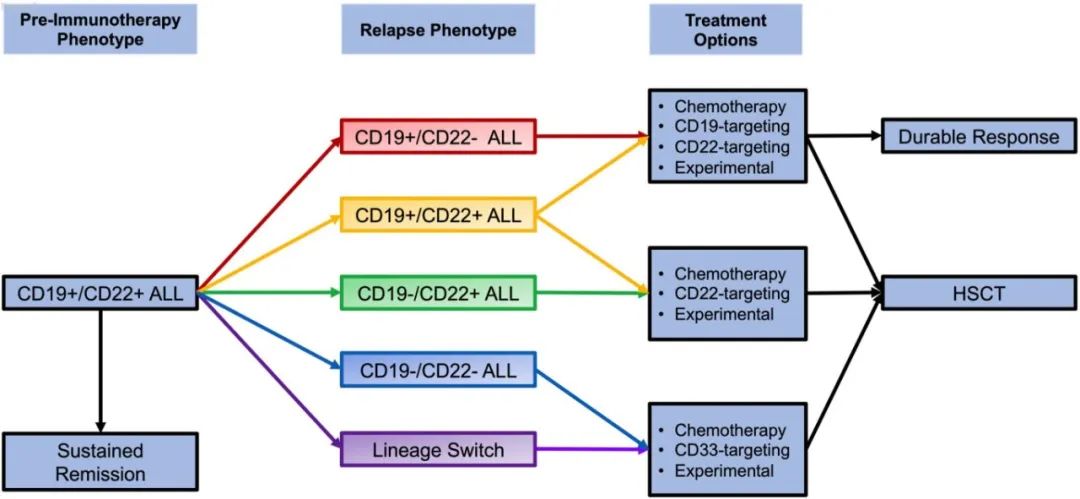
免疫治疗后CD19阳性复发的治疗
相关治疗建议总结如下:
-
在可行的情况下,应该建立适合于NGS-MRD跟踪的诊断克隆,以促进接受免疫治疗的复发或难治性患者的MRD连续跟踪
-
对于免疫治疗后复发的B-ALL患者,首选参加临床试验
-
CD19 CAR-T后应常规监测外周血BCA
-
对于晚期复发、CD19持续表达和/或髓外病变患者,应考虑CD19 CAR-T回输。
-
对于早期复发和对再输注反应可能性较低的患者,替代CAR-T细胞结构(例如CD22 CAR-T)或可提供更有利的反应,但可能需要重复单采和制备过程,对于高侵袭性患者具有挑战。此时减瘤极为重要,对于具有分子靶点的患者(例如Ph+疾病中的TKI),小分子抑制剂桥接治疗极具价值。但总的来说,“现成”免疫治疗方案可能是首选。
-
对于CD19持续表达且疾病负荷低的患者,应考虑使用现成的选择,如贝林妥欧单抗
-
对于疾病负荷高的患者,奥加伊妥珠单抗值得青睐
-
除非存在禁忌,免疫治疗后复发后获得缓解的患者都应进行HSCT
-
对于禁忌HSCT的患者,特别是早期BCA丢失的患者,正在研究其他的巩固策略,包括低剂量维持性化疗
免疫治疗后CD19阴性复发的治疗
相关治疗建议总结如下:
-
对于靶表达部分的患者,单抗原靶向可能不够,应考虑在研究性试验中采用联合抗原靶向策略或免疫治疗联合常规化疗
-
对于CD19阴性复发和CD22持续表达的患者,应考虑使用奥加伊妥珠单抗
-
也可以考虑试验性含CD22的CAR,特别是患有中枢神经系统疾病或窦性阻塞性综合征/静脉闭塞性疾病(SOS/VOD)高风险的患者
免疫治疗后谱系转换的诊断
LS是指白血病从一种谱系向另一种谱系的转变,其中典型的是B-ALL转为急性髓系白血病(AML),且保留原始克隆的细胞遗传学和/或分子特征。大约3%的CD19 CAR-T后复发为LS。贝林妥欧单抗后LS的发生率尚不清楚。LS是任何接受免疫治疗的B-ALL患者的风险,无论遗传学如何,但在具有KMT2A重排的白血病中富集。除此之外没有发现其他危险因素,并且在CD19 CAR-T输注后的早期和晚期都可发生LS。
诊断LS(特别是在免疫治疗的背景下)需要综合临床、形态学、免疫表型和细胞分子检查结果的综合方法。高怀疑指数和疾病演变的连续监测有助于LS的准确检测和表征。为了将LS与其他疾病(如治疗相关AML)区分开来,应采用多种MRD技术,包括NGS-MRD。在保留基线细胞遗传学和/或分子特征的情况下,白血病表现出表型改变的患者应考虑LS。
谱系转换的治疗
相关治疗建议总结如下:
-
鉴于其罕见性,尚未建立标准治疗,相关经验主要限于案例报道
-
除了全面的MFC,多模态MRD跟踪也可用于免疫治疗后检测,包括细胞遗传学和NGS-MRD,以检测和确认LS
-
除非禁忌,否则任何LS患者都应该进行靶向髓系强化治疗,对于CD33表达的患者,可以考虑加用gemtuzumab,但需要平衡VOD/SOS的风险
-
对于对初始挽救方案没有反应的患者,应考虑靶向髓系疾病的替代疗法,包括menin抑制剂和维奈克拉
-
LS后获得缓解的患者应选择HSCT,除非禁忌
-
部分患者可转换为混合表型急性白血病(MPAL),MPAL LS的治疗尚未明确。
流式细胞术和二代测序监测的作用

总结
免疫治疗后B-ALL复发面临复杂挑战,治疗和结局均受复发的免疫表型模式的影响。随着免疫治疗越来越多地进入前期,免疫治疗后复发的人群也会增加,并且复发患者的疾病情况也可能会发生变化。同样,随着免疫治疗变得更加广泛,免疫治疗后的复发可能会变得比单一抗原逃逸更复杂。同时出现CD19和CD22阴性的患者在MFC MRD鉴定和治疗策略方面都面临重大挑战。目前出现了用于MFC门控的替代抗原(例如B细胞抗原CD72, KMT2A重排中的NG2抗原)以及B-ALL患者的替代免疫治疗靶点,包括CD38、CD123和B细胞活化因子受体(BAFF-R),但这些靶点大部分仍处于研究阶段。总的来说,迫切需要建立前瞻性研究,以确定针对这一患者群体的最佳治疗方法。未来的方向应该优先考虑测试个性化免疫治疗策略,加强跨学科合作,并继续研究以优化这一具有挑战性的患者群体的结局。
参考文献
Lamble AJ,et al.How I treat post-immunotherapy relapsed B-ALL.Blood . 2024 Jul 24:blood.2024024517. doi: 10.1182/blood.2024024517.
作者:聊聊血液
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










未来的方向应该优先考虑测试个性化免疫治疗策略,加强跨学科合作,并继续研究以优化这一具有挑战性的患者群体的结局。
70
#免疫治疗# #B-ALL# #B细胞急性淋巴细胞白血病#
76