老年痴呆症致病蛋白Aβ42结构得以解析
2015-05-11 佚名 生物通
β-淀粉样蛋白(Aβ),39-43个氨基酸组成,是大脑皮质老年斑的主要成分。可溶性二聚体可以有效削弱突触结构和功能。这种二聚体是最小的突触毒性物质,是引起阿尔茨海默病的重要物质。APP序列断裂形成的Aβ是一种未确定功能的跨膜糖蛋白。APP可以被α-, β-γ-蛋白酶分解;Aβ由β-蛋白酶和γ-蛋白酶的连续作用分解产生。γ蛋白酶产生Aβ的C端,切断在APP跨膜区然后可以产生大量39-43个氨基酸的残
β-淀粉样蛋白(Aβ),39-43个氨基酸组成,是大脑皮质老年斑的主要成分。可溶性二聚体可以有效削弱突触结构和功能。这种二聚体是最小的突触毒性物质,是引起阿尔茨海默病的重要物质。
APP序列断裂形成的Aβ是一种未确定功能的跨膜糖蛋白。APP可以被α-, β-γ-蛋白酶分解;Aβ由β-蛋白酶和γ-蛋白酶的连续作用分解产生。γ蛋白酶产生Aβ的C端,切断在APP跨膜区然后可以产生大量39-43个氨基酸的残基亚型。最常见的残基亚型是Aβ40和Aβ42。两者之中,Aβ40更为常见,但是Aβ42与病情更相关。早发阿尔茨海默病被记录到Aβ42增加,这与APP的变化有关。
最近,美国伊利诺伊大学(UIC)的研究人员,确定了Aβ42蛋白的分子结构。相关研究结果发表在五月四日的《Nature Structural and Molecular Biology》杂志。
本文通讯作者、UIC化学教授Yoshitaka Ishii指出,弄清淀粉样纤维中Aβ42蛋白的物理结构,是了解“它是如何折叠不当,并聚集为有毒斑块”的关键所在。
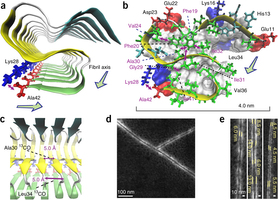
Ishii和他的同事们发现,在淀粉样纤维中的Aβ42蛋白,会形成三平面结构(称为β板片),它们以一种“S”型互相来回翻转板片。他们还发现,蛋白质上的最后一个氨基酸可在第一次S型翻转时,与一个氨基酸形成一种“盐桥”,从而使结构稳定。盐桥是带正电荷和负电荷的分子或一个分子各部分之间的一个键。
Aβ42的三维结构明显不同于Aβ40——化学性质相似、更丰富的一种蛋白质,也与阿尔茨海默病有关。Aβ40缺乏最后一个氨基酸,这个氨基酸携带形成盐桥所需的负电荷。
Ishii说:“这就解释了为什么Aβ42不与Aβ40相互作用,或将其招募到对神经细胞有毒性的斑块中。”
Ishii说:“Aβ42的结构特点和折叠表现,对阿尔茨海默病及其他神经退行性疾病的淀粉样蛋白蔓延,提供了一个新的视角。我们所设计的针对Aβ40的药物,可能对毒性更大的Aβ42蛋白不怎么有效。”
Aβ42蛋白的化学性质——尤其是它极端的厌水,为化学家和结构生物学家提出了一个严峻的挑战。Ishii说:“有许多实验室一直致力于这一问题,我的研究生Yiling Xiao阐明了它的结构,我对这项工作感到非常自豪。”Yiling Xiao是这项研究的第一作者。
原始出处:
Yiling Xiao,Buyong Ma,Dan McElheny,Sudhakar Parthasarathy,Fei Long,Minako Hoshi, Ruth Nussinov & Yoshitaka Ishii.Aβ(1–42) fibril structure illuminates self-recognition and replication of amyloid in Alzheimer's disease.Nature Structural & Molecular Biology, May 4, 2015.doi:10.1038/nsmb.2991
作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
小提示:本篇资讯需要登录阅读,点击跳转登录




#Aβ42#
48
#痴呆症#
34
#解析#
37
看看
133
#Aβ#
48