Cell:iPSC——家族性癌症研究新模型
2015-04-14 佚名 生物谷
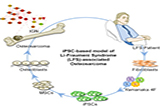
最近利用诱导多能干细胞技术对人类疾病进行体外建模已经成为一种可行方法。来自美国的科学家利用李弗劳明综合征病人的体细胞建立了诱导多能干细胞,并利用该细胞系向osteoblast方向分化,进行了相关基因表达分析,发现分化后的细胞系能够很好的模拟骨肉瘤的肿瘤特征。最近,相关研究成果发表在著名国际学术期刊 Cell。 研究人员从患有一种p53基因突变性家族疾病(李弗劳明综合征)的病人身上获得细胞进行
最近利用诱导多能干细胞技术对人类疾病进行体外建模已经成为一种可行方法。来自美国的科学家利用李弗劳明综合征病人的体细胞建立了诱导多能干细胞,并利用该细胞系向osteoblast方向分化,进行了相关基因表达分析,发现分化后的细胞系能够很好的模拟骨肉瘤的肿瘤特征。最近,相关研究成果发表在著名国际学术期刊 Cell。
研究人员从患有一种p53基因突变性家族疾病(李弗劳明综合征)的病人身上获得细胞进行了体外诱导培养,建立了诱导多能干细胞,并用该细胞探究了突变型p53在骨肉瘤发展过程中的作用。
研究人员诱导该种iPSC分化形成osteoblast(LFS OB细胞),发现osteoblast细胞具有骨肉瘤细胞的部分特征,包括成骨细胞分化缺陷以及成瘤能力。对该osteoblast细胞进行富集基因表达分析发现,其基因表达与病人肿瘤复发时间和生存率具有很强的相关性。进一步研究发现LFS OB细胞在骨生成过程中,其印记基因H19的表达发生损伤,不能正常上调。在LFS OB细胞中恢复H19表达会促进成骨分化并抑制LFS OB细胞的成瘤能力。通过结合人类印记基因网络进行功能基因组分析,研究人员发现H19能够通过印记基因网络中的DCN抑制LFS 相关的骨肉瘤形成。
总的来说,这项研究表明利用iPSC研究人类遗传性癌症综合征具有可行性,对于家族性癌症研究具有重要意义。
原始出处:
Dung-Fang Lee, Jie Su7, Huen Suk Kim, Betty Chang, Dmitri Papatsenko, Ruiying Zhao8, Ye Yuan, Julian Gingold, Weiya Xia, Henia Darr, Razmik Mirzayans, Mien-Chie Hung, Christoph Schaniel, Ihor R. Lemischka.Modeling Familial Cancer with Induced Pluripotent Stem Cells.Cell, April 9, 2015, 161(2):240-254.DOI: http://dx.doi.org/10.1016/j.cell.2015.02.045
作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言





#CEL#
26
#Cell#
28
#iPS#
32
#PSC#
28
#癌症研究#
30