病例分享 | 胸部SMARCA4缺失的未分化肿瘤与SMARCA4缺失的非小细胞肺癌诊断及鉴别诊断
2024-10-16 上海阿克曼病理 上海阿克曼病理
本文介绍 SMARCA4 缺失的未分化肿瘤和 SMARCA4 缺失的非小细胞肺癌,包括定义、临床特征、影像学、病理学、治疗预后及鉴别诊断等,强调两者差异。
SMARCA4缺失的未分化肿瘤是2021年第5版肺部肿瘤WHO分类中新增加的一种肿瘤实体,是临床上比较少见的恶性程度较高,侵袭能力较强的肿瘤,预后差,缺乏特异性分化,组织学上具有未分化形态和横纹肌样表型,往往被漏诊或误诊。有时与伴SMARCA4缺失的非小细胞肺癌鉴别诊断困难,虽然都存在SMARCA4缺失,但二者在临床特征、发病部位、组织学特点、免疫组化标记及治疗预后方面仍相差较大。
例 1
病史介绍
患者,男,69岁,颈部疼痛1周余,发现右肺占位病变5天为入院;1周前无明显诱因下逐渐出现颈部疼痛、转头时明显,无头晕、头痛,无恶心、呕吐等,起病后病情间歇性发作。平素身体健康。
辅助检查
颈椎MRI示:颈2棘突处异常信号影,考虑肿瘤并周围软组织肿胀;胸部CT示右肺上叶占位,胸腔少量积液,纵膈内稍大淋巴结;
增强CT检查示:1.右肺上叶不规则软组织肿块影,考虑肺癌可能;
大体所见
行CT引导下肺肿物穿刺活检术:
右肺肿瘤:灰白条索状不规则组织两条,长1.2-1.3cm,直径约0.1cm,全取。
镜下形态
低倍镜下差分化上皮样细胞呈多灶状、实性片状分布,局灶坏死;高倍镜下肿瘤细胞失黏附性呈圆形或椭圆形,核偏位,核仁明显,胞浆透明或红染或嗜酸,部分呈横纹肌样形态,细胞异型性明显,病理性核分裂像可见,未见角化,间质粘液样变,背景中散在少量炎细胞。
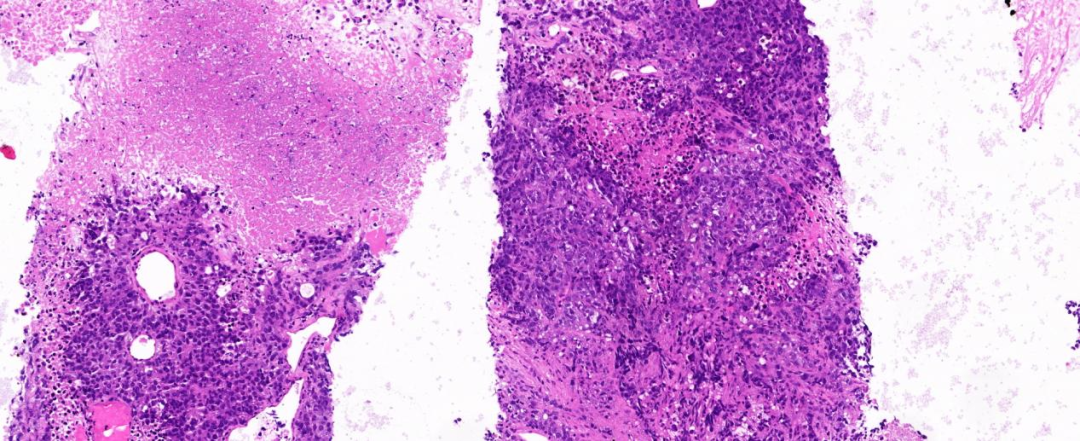
图1:低倍镜(10×),穿刺组织内上皮样细胞呈多灶状、实性片状分布,伴坏死;
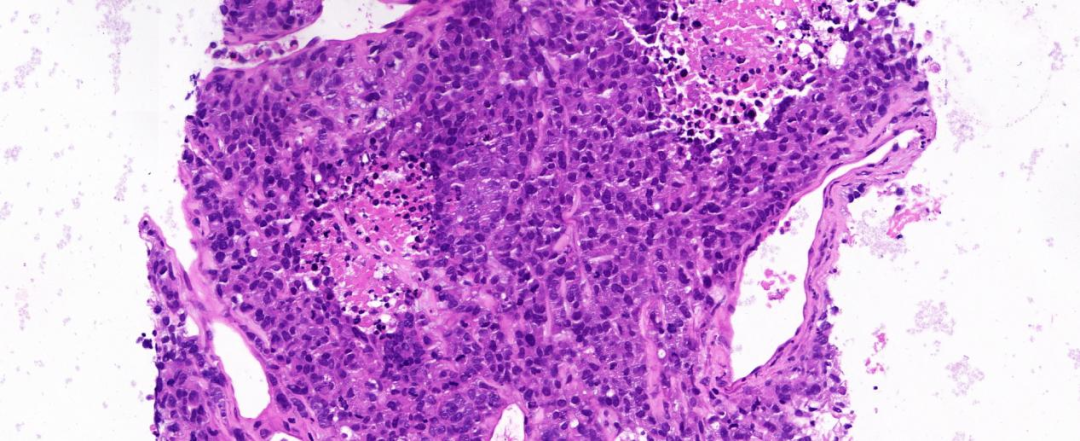
图2:中倍镜(20×),上皮样细胞排列松散、黏附性差,体积较大呈圆形或椭圆形;散在炎细胞浸润;
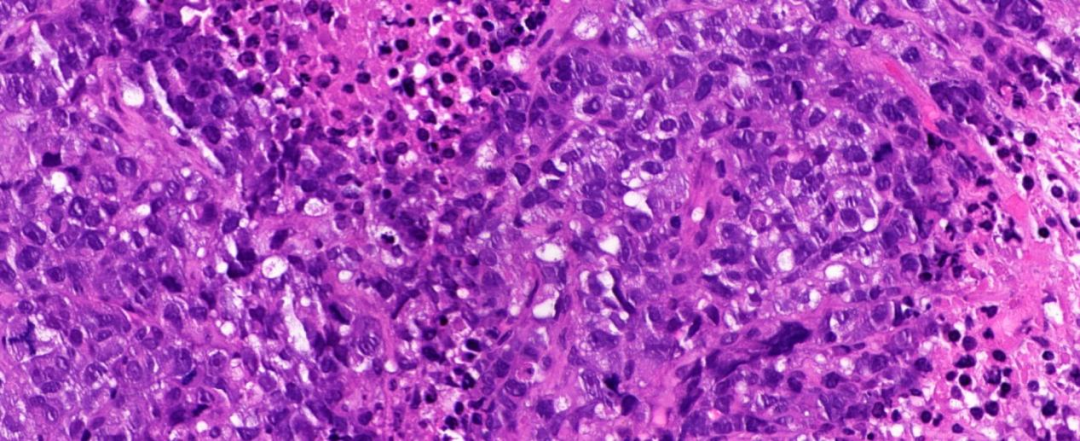
图3:高倍镜(40×),上皮样细胞泡状核,胞浆透明或红染或嗜酸,核浆比高;部分呈横纹肌样形态,细胞异型性明显,核分裂像多见,并可见病理性核分裂像;
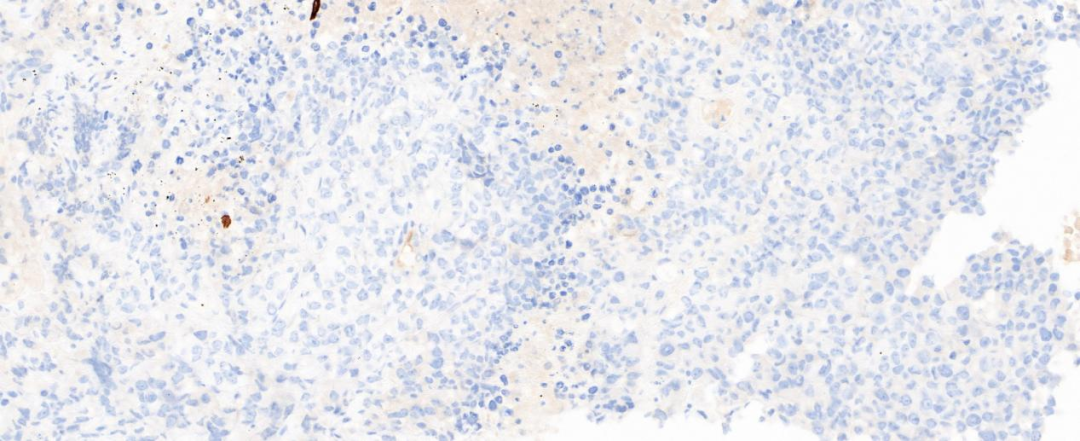
图4 肿瘤细胞CK7阴性(20×)
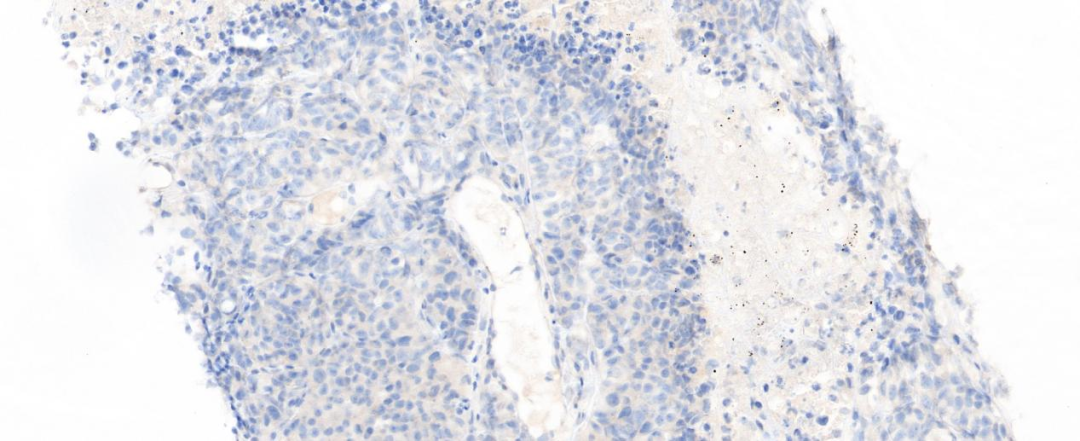
图5 肿瘤细胞TTF-1阴性(20×)
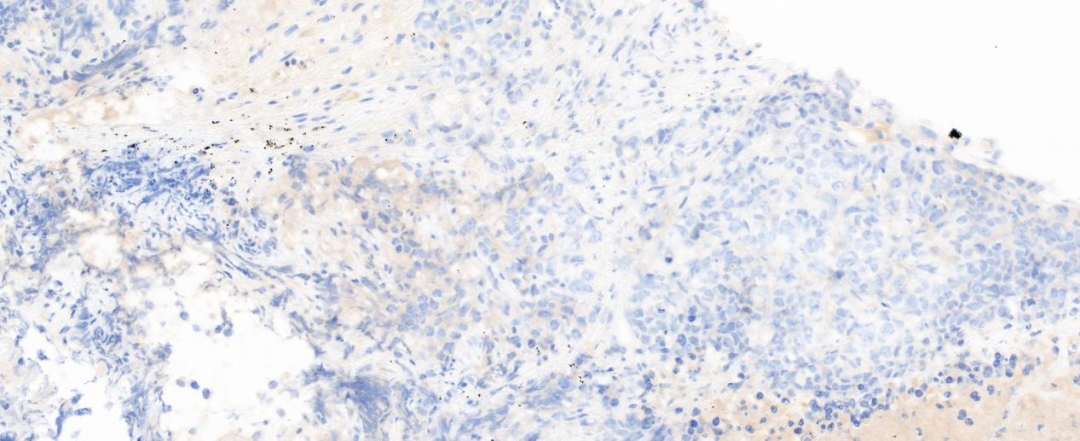
图6 肿瘤细胞NapsinA阴性(20×)
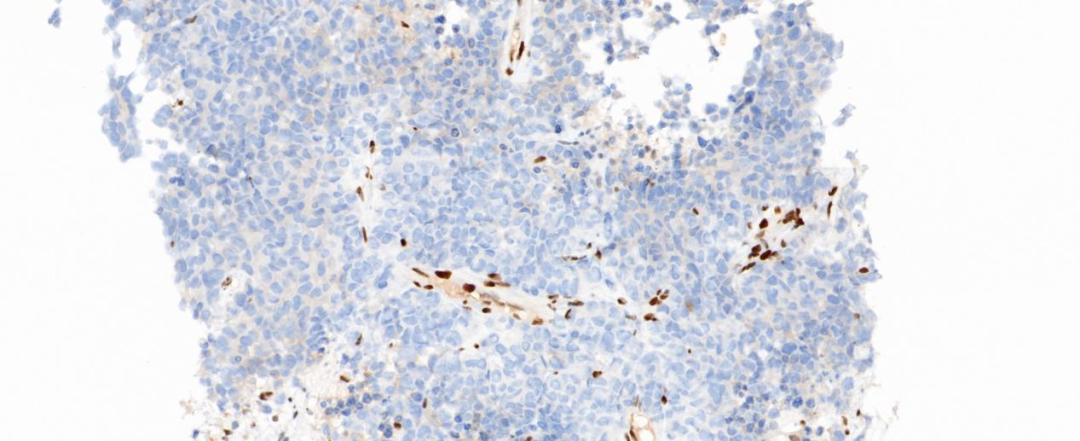
图7 肿瘤细胞BRG1核缺失表达,阳性对照为炎细胞及血管内皮细胞(20×)
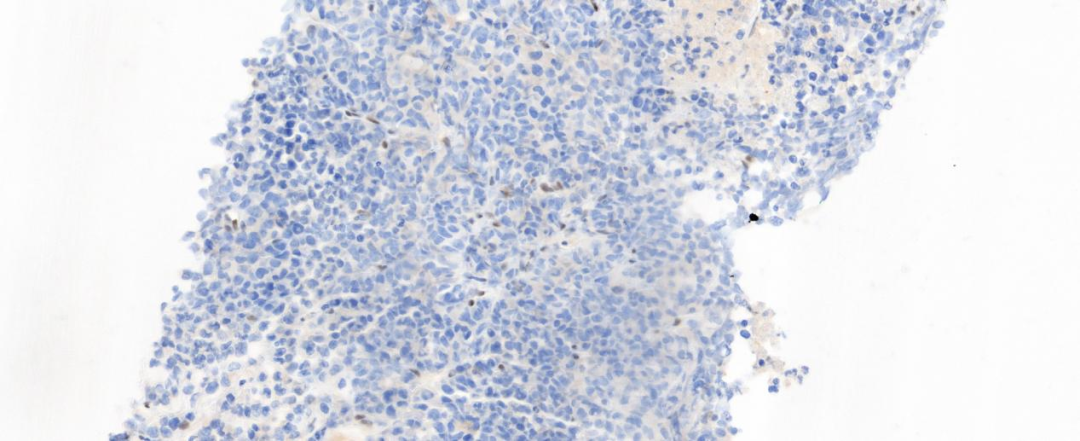
图8 肿瘤细胞BRM T核缺失表达(20×)
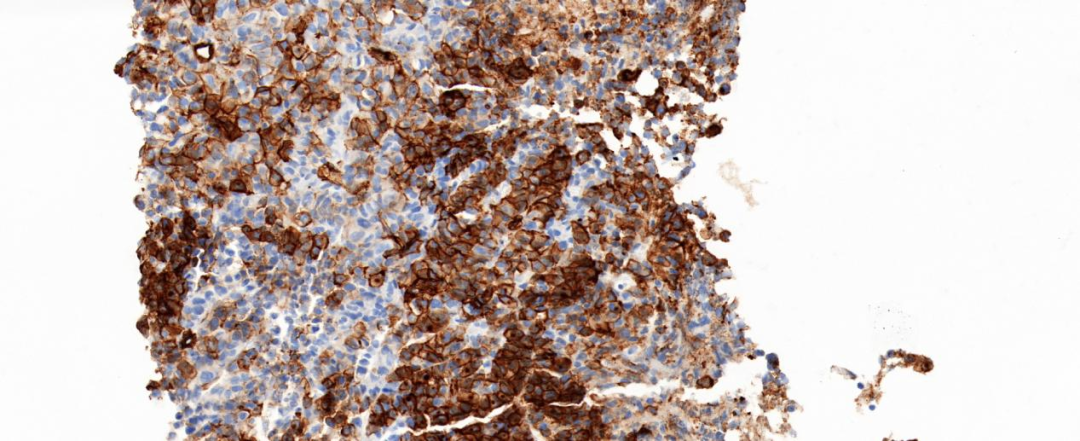
图9 肿瘤细胞表达CD34(20×)
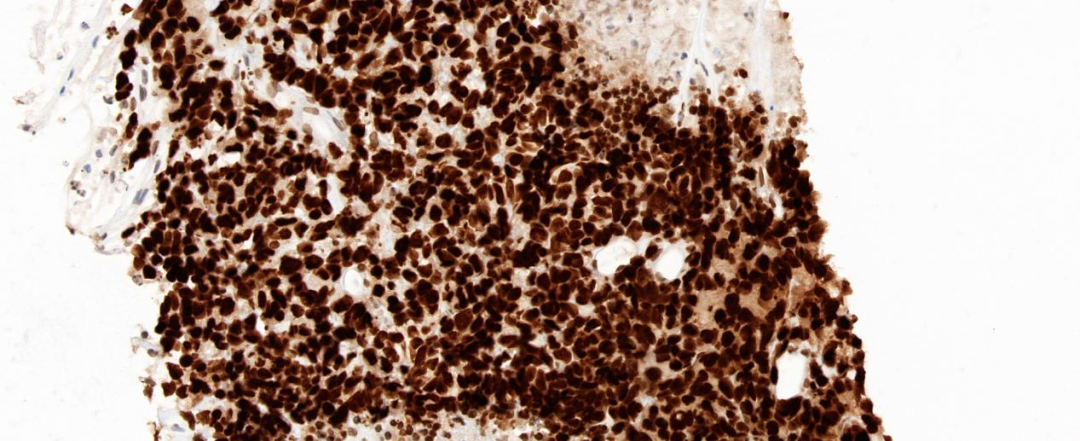
图10 肿瘤细胞表达SOX-2(20×)
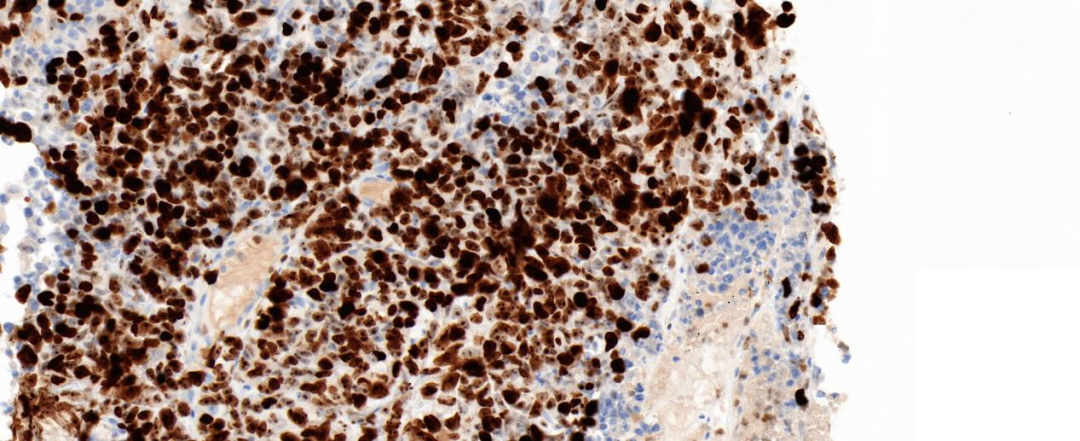
图11 Ki-67增殖指数约80%(20×)
免疫组化结果
肿瘤细胞灶性表达细胞角蛋白CK,肿瘤细胞不表达CK7、TTF-1、NapsinA、P40、CgA、CD56、Vim,表达SYN、CD34、SOX-2;CK8/18、INSM1和SALL4(灶+),INI-1(核+/无缺失),BRG1和BRM T(核表达弥漫缺失,内对照炎性细胞为核阳性);Ki-67阳性率约80%;
免疫标记物PD-L1(22C3)阳性肿瘤细胞TPS<1%
病理诊断
(右肺肿瘤)胸部SMARCA4缺失的未分化肿瘤(SMARCA4-UT)。
例 2
病史介绍
患者,男,61岁,以“咳嗽、咳痰半月”为主诉;
辅助检查
CT示:右肺下叶后基底段占位性病变。
胸部增强CT示:右肺下叶不规则软组织肿块,考虑肺癌伴阻塞性肺炎,右肺门淋巴结肿大,左肺门及纵膈多发小淋巴结。
PETCT检查示:
1.右肺下叶不规则软组织肿块影,局部代谢增高,考虑肺恶性病变(肺癌?)伴远端阻塞性肺炎;
2.纵膈7区及右肺门多发软组织结节影,代谢增高,疑多发淋巴结转移。
大体所见
右肺下叶切除标本:切除肺组织大小11×8×4.5cm,支气管长1cm,直径1.2cm,沿支气管切开肺组织,支气管黏膜光滑,距支气管断端2.5cm处可见一肿物大小5.0×4.0×3.5cm,肿物切面灰白、灰黄,实性,质稍韧,与周围肺组织分界不清,与支气管相通,距脏层胸膜最近距离约0.1cm,胸膜未见牵拉。周围肺组织多切面灰红质软,未见结节/肿物。肺门处查见淋巴结2枚,直径0.5-0.7cm。
镜下形态
低倍镜下可见多量不规则、管腔大小不一的异型腺样结构[即经典型腺癌形态],腺腔内可见炎性变性坏死灶;部分区肿瘤细胞呈实性片状、乳头状,分化较差;背景中大量淋巴细胞、浆细胞及中心粒细胞等急慢性炎细胞弥漫浸润,伴局灶淋巴细胞聚集及大片变性坏死灶;高倍镜下上皮细胞体积较大、胞质较丰富、异型性明显,可见核仁及病理性核分裂像;肿瘤细胞间可见微脓肿。肺泡腔内可见大量泡沫样组织细胞浸润。局灶可见类上皮样细胞组成的肉芽肿性炎改变。
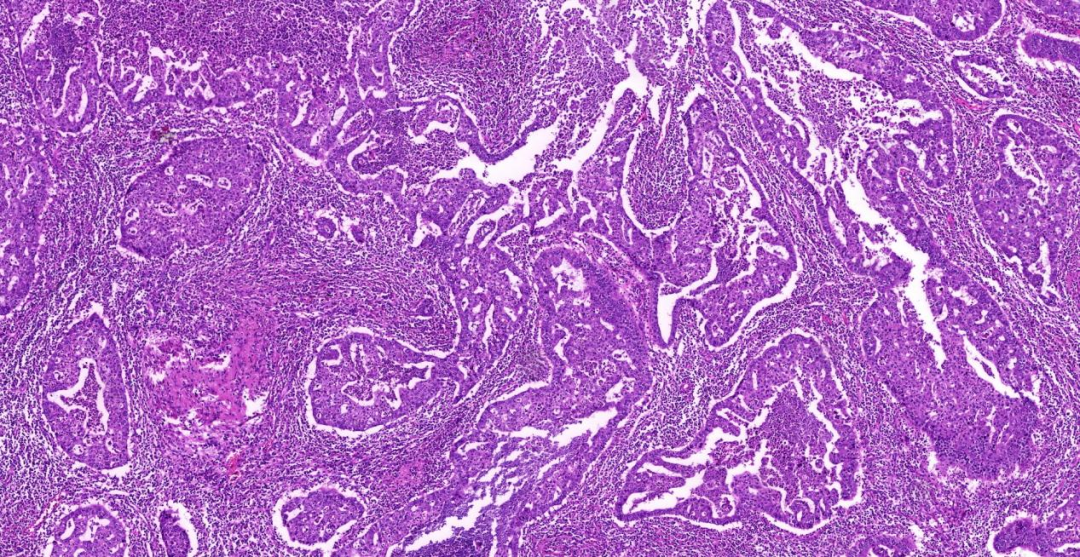
图1:低倍镜(5×),大量异型性明显的不规则的腺样结构;
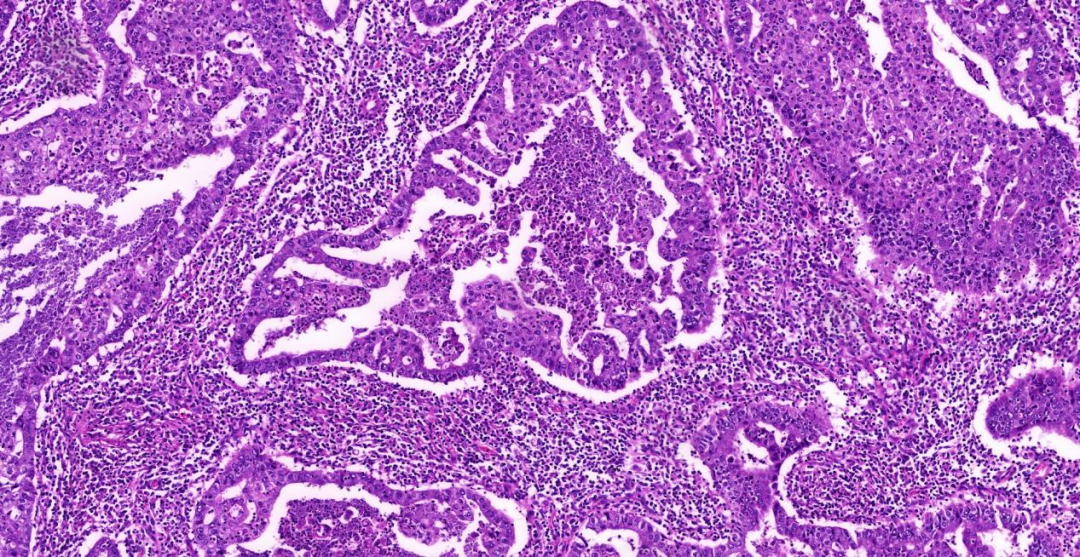
图2:中倍镜(10×),经典的腺癌形态,背景大量急慢性炎细胞浸润;
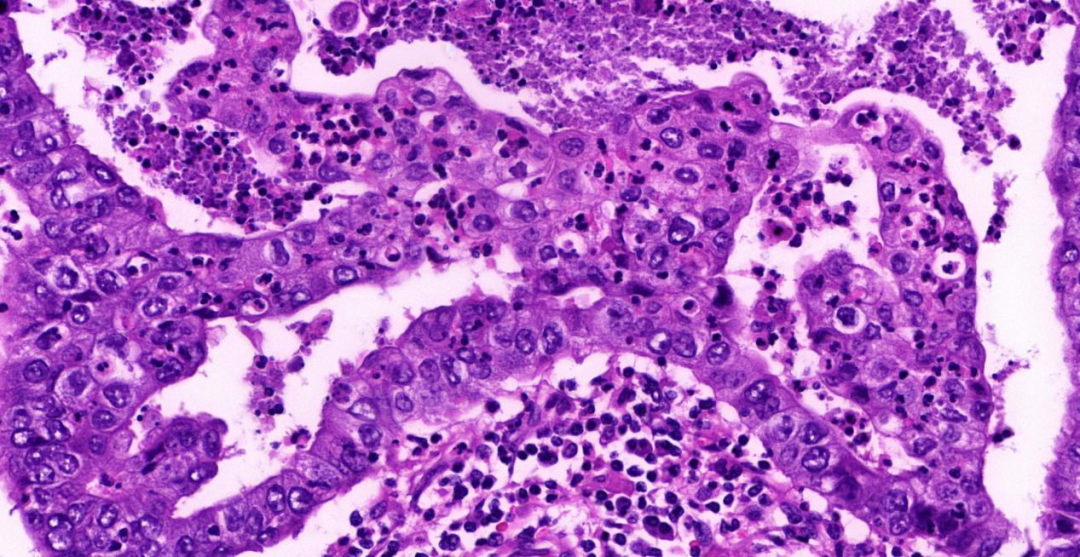
图3:高倍镜(20×),肿瘤细胞体积较大、胞质较丰富、异型性明显,可见核仁及病理性核分裂像;
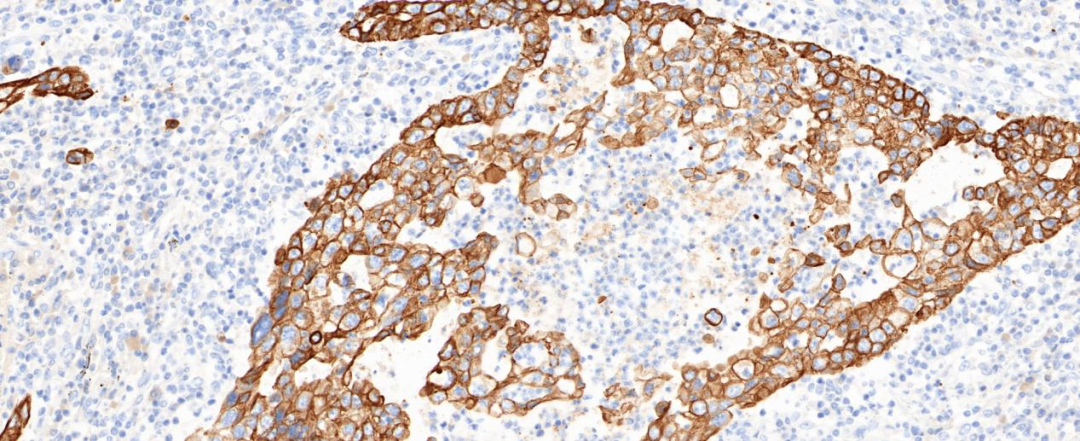
图4 肿瘤细胞CK阳性(20×)
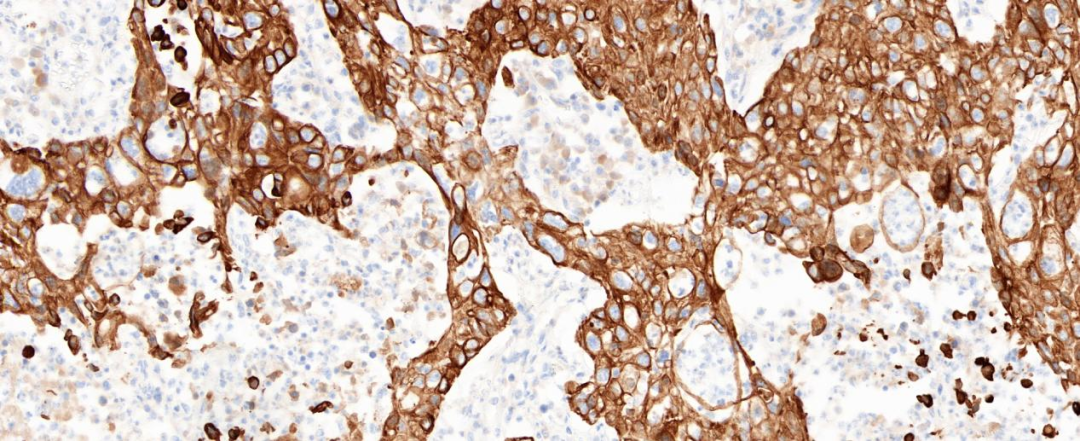
图5 肿瘤细胞CK7阳性(20×)
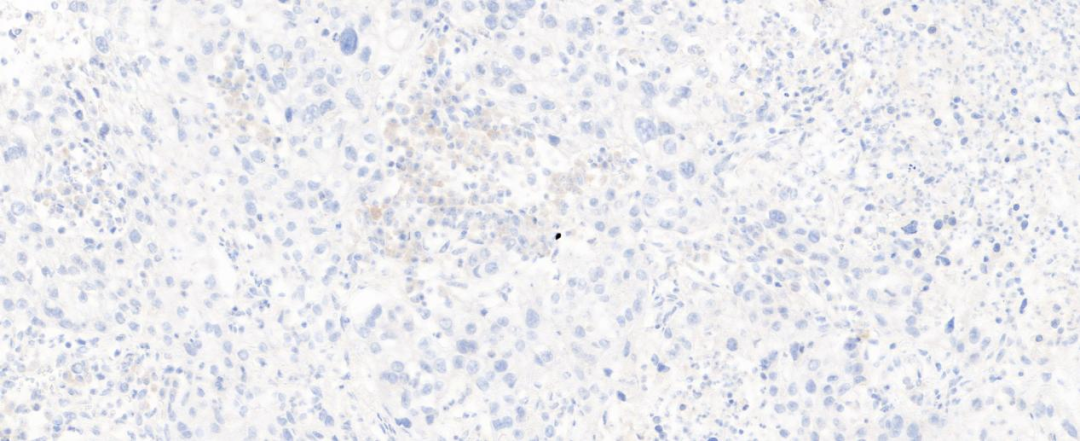
图6 肿瘤细胞TTF-1阴性(20×)
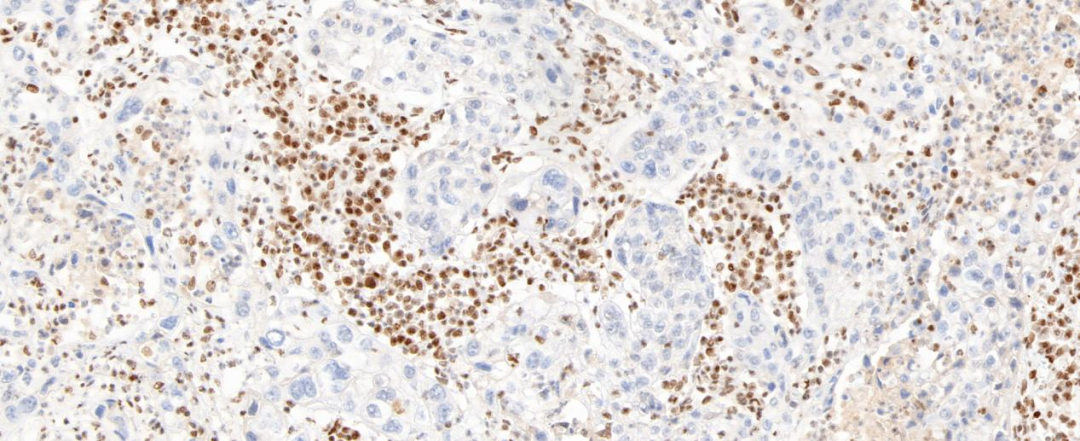
图7 肿瘤细胞BRG1核缺失表达,阳性对照为炎细胞(20×)
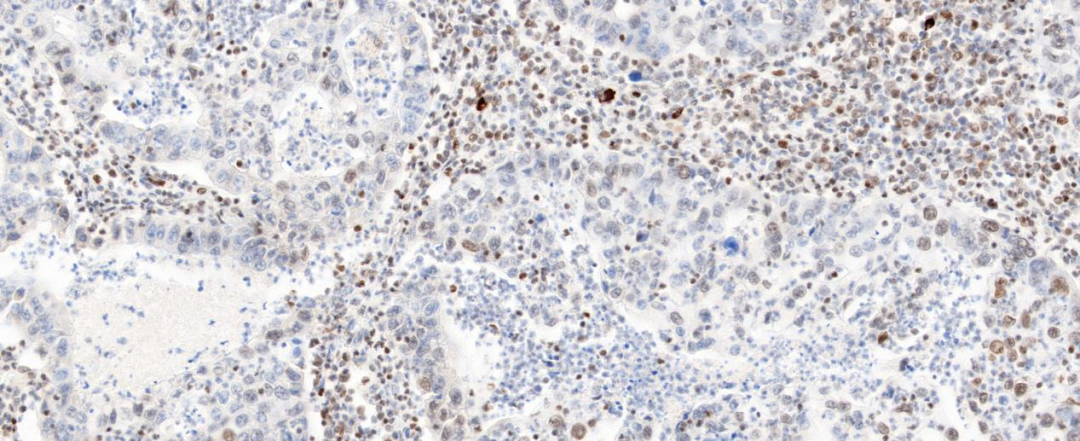
图8 肿瘤细胞BRM T核缺失表达(20×)
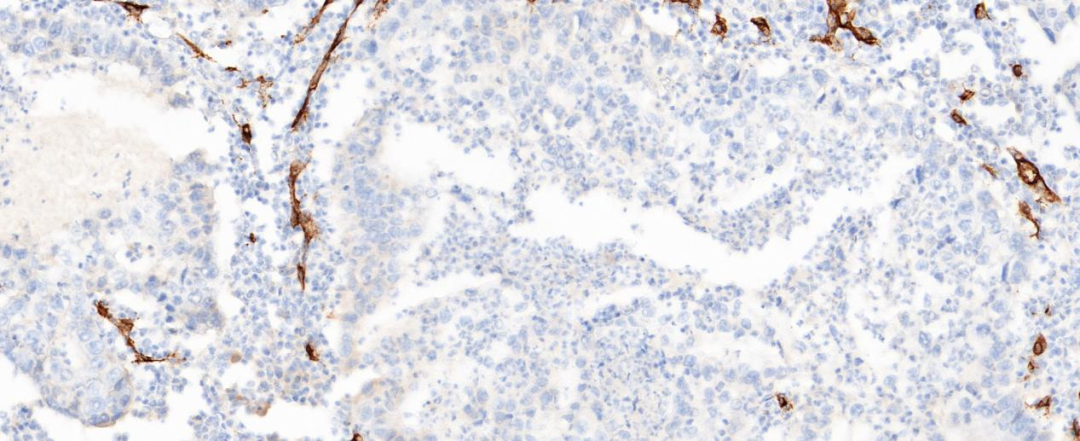
图9 肿瘤细胞CD34阴性(20×)
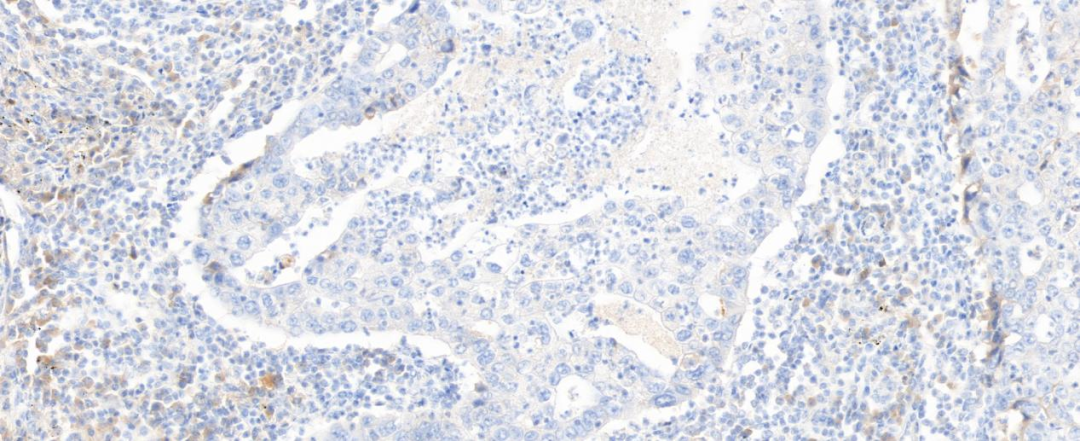
图10 肿瘤细胞SOX-2阴性(20×)
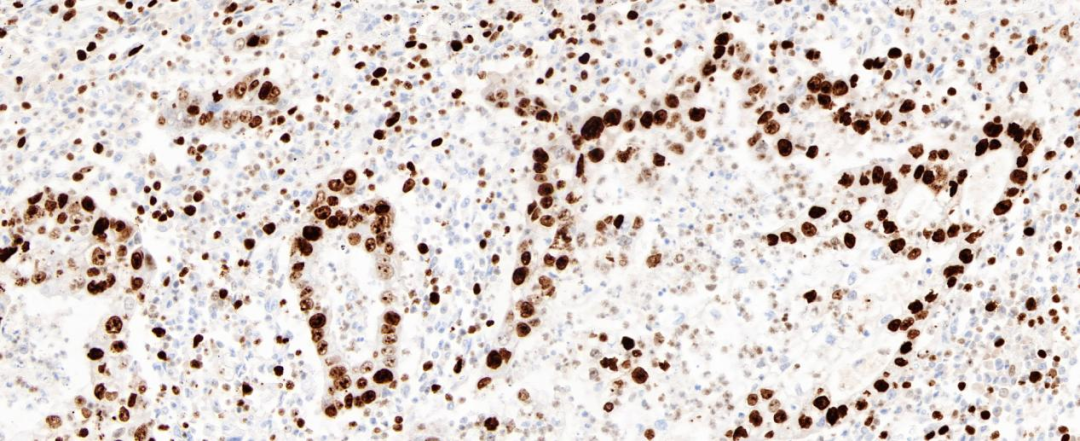
图11 Ki-67增殖指数约50%(20×)
免疫组化结果
肿瘤细胞表达细胞角蛋白CK、CK7,灶性表达SOX-2,不表达P40、TTF-1、Vimentin、NapsinA、P63、CD56、SYN、CK20、CDX-2、CD34和SALL4,BRG1和BRM T均核表达弥漫缺失(内对照为炎细胞和血管内皮细胞呈核弥漫阳性);INI-1核表达无缺失;CD34示血管内皮;Ki-67增殖指数约50%;P53约5%+;免疫标记物PD-L1(22C3)阳性肿瘤细胞数TPS:50%;PD-L1(SP263)阳性肿瘤细胞数TPS:30%;分子检测未检出ALK及EGFR基因突变。
病理诊断
(右肺下叶切除标本)SMARCA4缺失的非小细胞肺癌(腺癌,SMARCA4-dNSCLC)。支气管断端未见癌;未累及脏层胸膜;可见脉管内癌栓;未见神经侵犯;气腔播散(STAS)阴性;淋巴结内可见癌转移(肺门:0/2;2组:0/1;4组:1/8;7组:1/7;10组:0/2;11组:0/2;12组:0/6)。
讨 论
定义
胸部SMARCA4缺失的未分化肿瘤(SMARCA4-UT):是侵犯成人胸部的高级别恶性肿瘤,表现为未分化或横纹肌样表型和存在BAF染色质重塑复合物关键成员SMARCA4的缺失。2021年第5版肺部肿瘤WHO分类将SMARCA4-UT与NUT癌一起被归入“肺的其他上皮源性肿瘤”。
SMARCA4缺失的非小细胞肺癌(SMARCA4-dNSCLC):是临床罕见的肺原发高度恶性肿瘤,伴SMARCA4缺失,属于肺非小细胞癌罕见类型范畴,第5版肺部肿瘤WHO分类中未单独列出。
ICD-O编码:SMARCA4-UT:8044/3
临床特征
SMARCA4-UT好发于青年至中年人,年龄范围为27-90岁,平均年龄58岁,中位年龄48岁,大多患者有重度吸烟史,男性为主,种族倾向不明显。累及的部位主要为肺门或肺、纵膈、胸膜及胸壁等胸部部位,肺至少为局部累及。
临床表现主要有:咳嗽、咳痰、呼吸困难、上腔静脉综合征、体重减轻等。部分患者初诊时就已经发现淋巴结转移及胃肠道、腹盆腔等转移症状,也有转移到肝脏、肋骨、肾上腺、颞叶等部位的病例报道。
SMARCA4-dNSCLC:好发于中老年人,中位年龄约64岁,无明显性别差别,男性稍多,常常累及肺实质内,可累及胸壁。临床表现主要有:咳嗽、咳痰、痰中见血、胸闷气短等。患者大多临床症状明显而就诊,手术后常常较早发生淋巴结等器官转移。多项研究表明,SMARCA4-dNSCLC在中老年男性吸烟中多见,肿瘤体积较大,伴有胸膜或脉管侵犯。
影像学特征
SMARCA4-UT典型的影像学常常为边界不清的、体积较大的软组织肿块影,伴有压迫邻近结构症状。
SMARCA4-dNSCLC影像学主要为肺内团片状、斑片状边界不清的软组织高密度肿块影,多增强后不均匀强化,多累及胸膜。
病理学特征
01 大体特征
有文献报道,SMARCA4-UT肿块最大径范围1.5-11cm,平均直径5.1cm,肿物界不清,切面灰白、灰黄,质韧,紧靠脏层胸膜;SMARCA4-dNSCLC肿块最大径范围为2-6.5cm,平均最大径约4.2cm;肿物切面多灰黄、质中,部分见胸膜凹陷。
02 镜下表现
SMARCA4-UT:差分化上皮样细胞呈多灶状、岛状、实性片状分布,局灶坏死明显;肿瘤细胞排列松散、黏附性差,体积较大呈圆形或椭圆形,核偏位,核仁明显,泡状核,胞浆透明或红染或嗜酸,核浆比高;部分呈横纹肌样形态,细胞异型性明显,核分裂像多见,并可见病理性核分裂像,可有部分鳞状上皮分化及神经内分泌特征,但未见角化及细胞分化的证据(腺样、乳头状结构等)。少数病例肿瘤细胞呈梭形,间质粘液样变或纤维组织增生,背景中散在少量炎细胞。另文献报道,约5%的病例中可见差分化癌与分化较好的非小细胞癌(通常为腺癌)混合存在。
SMARCA4-dNSCLC:肿瘤细胞为上皮样或合体样,排列成片巢状或结节状,部分区域可见经典的腺癌形态,腺腔内可见炎性变性坏死灶;部分区肿瘤细胞呈实性片状、乳头状,分化较差,低黏附性;背景中大量淋巴细胞、浆细胞及中心粒细胞等急慢性炎细胞弥漫浸润,伴局灶淋巴细胞聚集及大片变性坏死灶;上皮细胞体积较大、胞质较丰富或嗜酸性呈横纹肌样、细胞异型性明显,可见核仁及病理性核分裂像;肿瘤细胞间见微脓肿。肺泡腔内可见大量泡沫样组织细胞浸润。局灶可见类上皮样细胞组成的肉芽肿性炎改变。
03 免疫表型
SMARCA4-UT:肿瘤细胞灶性表达或不表达细胞角蛋白CK,肿瘤细胞通常不表达CK7、TTF-1、NapsinA、P40、CgA、CD56,部分病例中Vim可阳性表达;也可以表达SYN、CK8/18、INSM1和干细胞标记物(CD34、SOX-2和SALL4),Claudin-4为阴性表达,INI-1(核+/无缺失),最具特征性的是BRG1和BRM T核表达弥漫缺失(内对照炎细胞为核阳性);P53蛋白常常过表达;Ki-67增殖指数阳性率可达80%;
SMARCA4-dNSCLC:肿瘤细胞弥漫表达CK、CAM5.2、HepPar1和CK7,灶性或不表达SOX-2,部分病例表达P40、P63,通常不表达TTF-1、Vim、NapsinA、CD56、SYN、CK20、CDX-2、CD34和SALL4,BRG1和BRM T均核表达弥漫缺失(内对照为炎细胞和血管内皮细胞呈核弥漫阳性);INI-1核无缺失;CD34示血管内皮;Ki-67增殖指数阳性率范围20%-80%;
分子遗传学
SMARCA4-UT:可检测到SMARCA4基因突变及TP53突变,常伴有KRAS、STK11和/或KEAP1基因突变,高肿瘤突变负荷,个别病例有TSC2、ROS1及ATM突变。
SMARCA4-dNSCLC:检测到SMARCA4基因突变(无意或框内缺失的双等位基因);还发现其他的驱动基因突变,如TP53、KRAS、STK11、KEAP1、NF1等,而肺癌发生主要的EGFR、ALK、ROS1等基因突变通常不相关。
治疗与预后
SMARCA4-UT临床上恶性程度较高、侵袭性较强,中位总生存期3个月-6个月。手术为主,放化疗治疗不明显,蒽环类药物化疗有效,需多种免疫抑制剂联合应用。SMARCA4-dNSCLC手术切除为主,辅以药物治疗,但目前没有统一的标准治疗方案,免疫检查点抑制剂(ICIs)可能对该病治疗有效;其中位生存期约为40个月,相比之下,SMARCA4-UT预后更差。
鉴别诊断
(1)低分化神经内分泌癌(NEC):NEC分化差时需要鉴别,NEC除了表达上皮标记物外还表达神经内分泌标记物(如CgA,CD56,SYN及INSM1),可见到P53突变表达和RB蛋白的缺失表达,SMARCA4蛋白几乎无缺失表达即核阳性,以上各点可以与SMARCA4-UT和SMARCA4-dNSCLC相鉴别。
(2)上皮样间皮瘤:部分上皮样间皮瘤中也可以见到SMARCA4核缺失表达,但形态学上多以乳头状、腺样为主,且表达间皮肿瘤标记物(如MC、D2-40、CR、WT-1及CK5/6),以上可以与SMARCA4-UT和SMARCA4-dNSCLC相鉴别。
(3)NUT癌:NUT癌多发生于身体中线部位,形态学上可见到鳞状分化,且可表现为突然的角化,发生在胸部纵膈时要与SMARCA4-UT相鉴别,前者免疫组化NUT核弥漫阳性且存在分子遗传学NUT基因重排,SMARCA4蛋白核阳性表达。
(4)经典型肺腺癌:形态学有时很难将SMARCA4-dNSCLC分开,但前者SMARCA4蛋白核阳性表达,至少为部分阳性,TTF-1和NapsinA阳性。分子检测也可以将二者分开。SMARCA4-UT中CK、TTF-1和NapsinA一般阴性,干细胞标记物(CD34、SOX-2和SALL4)阳性,Ki-67增殖指数可达80%,可以鉴别二者。
(5)恶性黑色素瘤:多发生于皮肤黏膜等浅表部位,很少发生于内脏器官,恶性黑色素瘤的免疫组化具有特异性表达黑色素标记物S-100、HMB45、PNL-2和MelanA,且存在BRAF基因突变,但SMARCA4蛋白核弥漫阳性表达,可以鉴别SMARCA4-dNSCLC和SMARCA4-UT。
(6)淋巴瘤:淋巴瘤在免疫组化上可以将SMARCA4-dNSCLC和SMARCA4-UT鉴别,淋巴瘤不表达上皮标记物如CK、CK5/6及CK8/18,但表达LCA、T淋巴细胞(如CD3,CD5,CD4,CD7,CD8)和或B淋巴细胞标记物(如CD20,CD79a,PAX-5,CD19),且存在BCR或TCR基因重排阳性。
(7)其他SWI/SNF复合体缺失的肿瘤转移到肺或胸膜:由于肺是全身多种肿瘤的常见转移部位,且SMARCA4缺失型肿瘤可见于全身各器官,因此在诊断时综合考虑临床、影像及免疫组化结果和患者病史进一步排除其他部位的转移性肿瘤如妇科、鼻咽部、消化道等。
*本文(包括图片)均为作者投稿, 仅供行业交流学习用,不作为医疗诊断依据。
参考文献
[1]朱培培,李新星,刘佳涵,杜秀銮,苏海燕,王坚.SMARCA4缺失性肿瘤的临床病理学特征[J].中华病理学杂志,2022,51(8):792-798.
[2]吴方君,肖伟进,彭然,等.胸部SMARCA4缺失的未分化肿瘤22例临床病理分析[J].临床与实验病理学杂志,2022,38(08):948-952.
[3]李少玲,武春燕,张莉萍,黄焰,吴伟,张伟,侯立坤.SMARCA4缺失性非小细胞肺癌127例临床病理学特征及预后分析[J].中华病理学杂志,2023,52(7):665-670.
[4]眭玉霞,晋龙,郭国栋,罗敏,秦晓英,游立圣,陈灵锋.SMARCA4缺失性非小细胞肺癌临床病理学分析[J].中华病理学杂志,2021,50(12):1366-1368.
[5]赵汝楠,邹宜覃,陈鸿远,等. 伴有SMARCA4缺失的非小细胞肺癌9例临床病理分析[J]. 中国肺癌杂志,2022,25(8):575-582.
[6]赵静,陆一凡,江涛,等.伴SMARCA4缺失的非小细胞肺癌5例临床病理学特征[J].临床与实验病理学杂志,2024,40(05):515-519.
[7]邢碧桐. 胸部SMARCA4缺失的未分化肿瘤与低分化癌临床病理特征比较研究[D].中国医科大学,2024.
[8]李媛, 谢惠康, 武春燕. WHO胸部肿瘤分类(第5版)中肺肿瘤部分解读[J]. 中国癌症杂志, 2021, 31(7): 574-580.
作者:上海阿克曼病理
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#非小细胞肺癌# #SMARCA4缺失# #未分化肿瘤#
0