「早期」非小细胞肺癌驱动基因突变阳性率不逊于「晚期」,且显著富集MET ex14跳突
2024-10-27 苏州绘真医学 苏州绘真医学
本研究确定早期非小细胞肺癌中主要驱动变异发生率,与晚期相似,MET 外显子 14 跳跃突变在早期富集,证实生物标志物检测价值,利于免疫治疗选择、临床试验及复发管理。
早期(ES)非小细胞肺癌(NSCLC)的确诊率约为30%。首选的治疗方法是手术,但相当比例的患者会出现复发。新辅助和辅助化疗的临床获益有限。ES-NSCLC的治疗方案正在迅速发展,包括靶向治疗和免疫治疗在内的精准医学近年来进入了新辅助治疗和辅助治疗的临床实践。然而,关于ES-NSCLC的分子特征以及癌基因成瘾对确定治疗的影响,目前仅有少量数据。本研究在单中心连续队列中确定了肺癌主要驱动变异的发生率。1122例患者进行了分子检测,其中ES-NSCLC 368例,晚期NSCLC 754例。在早期和晚期之间,可干预变异的发生率相似。ES-NSCLC显著富集MET外显子14跳跃突变,并且BRAF p.(V600E)突变的发生率较低。根据可干预变异来评估PD-L1表达水平,携带EGFR、KRAS、MET变异和基因融合的晚期肿瘤的PD-L1表达水平高于相应的早期肿瘤。综上所述,这些结果证实了生物标志物检测在ES-NSCLC中的价值。虽然ES-NSCLC已获批准的靶向疗法仍然有限,但确定可作为治疗的靶点可改善患者对免疫疗法的选择,有利于纳入临床试验,并使患者在疾病复发时更快开始治疗。
研究背景
肺癌是第二大常见癌症,也是全球癌症相关死亡的主要原因之一。在美国,据估计每天约有350人死于肺癌,81%的病例与吸烟相关。在欧洲,肺癌占总死亡人数的20%。
总体而言,约80-85%的病例由非小细胞组织学组成,腺癌是最常见的组织类型。大多数非小细胞肺癌(NSCLC)确诊时已处于晚期或转移期,预后较差,5年生存率约为4-5%。随着对肺癌基因组学认识的不断深入,肺癌的治疗模式发生了巨大的变化,精准医学时代已到来,包括靶向治疗和免疫治疗。特别是,相当大比例的NSCLC携带可作为治疗靶点的癌基因突变,这些突变可驱动癌症的发生和进展。其中一些可干预变异可被已批准的药物靶向,主要包括以下癌基因:EGFR、KRAS、ALK、BRAF、ROS1、MET、HER2、RET和NTRK1/2/3。NSCLC中致癌驱动基因的频率在人群和性别中存在差异。例如,在亚洲人和高加索人中,EGFR常见可干预突变的发生率分别约为47%和16%。考虑到癌基因依赖(即具有可干预变异的肿瘤)的晚期和转移性NSCLC可以从批准的靶向治疗中获益,上述癌基因的分子检测对于这种肿瘤是必需的。
与晚期和转移期类似,精准医学最近进入并改善了早期(ES)NSCLC的临床管理。根据美国癌症联合委员会(AJCC)TNM分期,约30%的病例被诊断为ES-NSCLC,指的是病理分期为I~IIIA的肿瘤。手术是主要的治疗方式,直到最近,术后的标准治疗还是以铂类为基础的双药俩联合化疗。然而,手术切除的肿瘤的长期生存率仍然很低,5年生存率为5.4%,I期和III期的总生存率分别为90%至12%。迄今,有EGFR外显子19缺失或外显子21 p.(L858R)突变的IB-IIIA期切除的NSCLC可从奥希替尼(第三代EGFR酪氨酸激酶抑制剂[TKI])辅助治疗中获益。根据3期随机ADAURA试验的结果,奥希替尼辅助治疗已获得美国食品药品管理局(FDA)和欧洲药品管理局(EMA)的批准。与安慰剂相比,奥希替尼辅助治疗提供了显著的总生存期(OS)获益。在整个纳入研究的人群中,奥希替尼组和安慰剂组的5年生存率分别为88%和78%,与肿瘤分期以及是否接受辅助化疗无关。此外,阿替利珠单抗(程序性死亡受体配体-1[PD-L1]抑制剂)辅助治疗进入了IB-IIIA期切除ES-NSCLC的临床实践。III期Impower010研究表明,与单纯化疗相比,辅助免疫治疗在无病生存期(DFS)方面有获益。详细而言,据报道,在PD-L1肿瘤比例评分(TPS) >1%的II-IIIA期肿瘤中,阿替利珠单抗改善了OS,而在PD-L1 TPS >50%的II-IIIA期肿瘤中,阿替利珠单抗获益最大。FDA批准阿替利珠单抗用于PD-L1表达水平> 1%的II-IIIA期肿瘤的辅助治疗,EMA批准阿替利珠单抗用于PD-L1表达水平> 50%且无EGFR突变和ALK重排的高危肿瘤。同样,根据Keynote-091研究,程序性细胞死亡受体1(PD-1)抑制剂帕博利珠单抗已被批准用于IB-IIIA期NSCLC的辅助治疗。无论PD-L1状态和肿瘤基因组检测情况如何,与安慰剂相比,帕博利珠单抗均显著延长了DFS。
在新辅助治疗方面,CheckMate 816试验促使FDA和EMA批准纳武利尤单抗联合铂类化疗用于PD-L1表达水平大于1%的IB-IIIA期NSCLC患者。事实上,与肿瘤PD-L1表达水平<1%的患者相比,这一联合治疗在肿瘤PD-L1表达水平≥1%的患者中提供了更大的无事件生存获益。与单独化疗相比,纳武利尤单抗+化疗在病理完全缓解和主要缓解方面均显示出益处。
此外,已经批准用于转移性NSCLC的特异性TKIs和免疫检查点抑制剂(ICIs)的不同临床试验目前正在进行中,用于ES-NSCLC的新辅助和辅助治疗。考虑到肺癌监测项目在临床实践中越来越广泛,预计在未来几年将有更多的患者被诊断为ES-NSCLC。然而,关于ES肿瘤的分子格局,包括发生率和不同于EGFR的癌基因成瘾对治疗确定和预后的影响,只有很少的数据可用。例如,除了EGFR和ALK变异外,免疫治疗对ES肿瘤的益处尚未得到评估。在转移性肿瘤中,除KRAS外,癌基因依赖性肿瘤不能从免疫疗法中获益。因此,为了更好地确定治疗,将完整的分子特征扩展到ES-NSCLC也是合理的。据研究者所知,只有Muthusamy等人证明了在切除的早期肺腺癌中,与给予免疫治疗相比,多基因检测在成本效益方面的价值。事实上,他们使用了真实世界的临床基因组数据库,并报告了与晚期相似的癌基因依赖性肿瘤的发生率,这些肿瘤可能对ICI无应答。
在这种情况下,本研究旨在确定和比较在一个连续的单中心队列中,肺癌主要的驱动基因变异的发生率,包括早期和晚期肺腺癌。本研究结果可以进一步支持ES肿瘤生物标志物检测策略的有效性,从而推动新治疗策略的确定。
研究方法
本研究纳入了腺癌(ADC)、腺鳞癌(ADC-SCC)和非特指型NSCLC(NOS)(表1)。根据最新的AJCC-TNM分期,肿瘤分为早期或晚期。研究者分析了与临床相关的EGFR、BRAF、KRAS、MET外显子14跳跃的基因突变,以及涉及ALK、ROS1、RET和NTRK1/2/3的基因重排。对手术切除、活检组织和细胞块的福尔马林固定石蜡包埋(FFPE)样本或Papanicolaou染色涂片进行分子分析。对于基因突变,根据随时间变化的临床实践模式,采用不同的技术进行了分子检测。对于2020年采集的样本,采用MALDI-TOF技术进行EGFR、KRAS和BRAF突变分析,而MET外显子14跳跃突变通过直接Sanger测序进行检测。对2021至2022年收集的样本,采用二代测序(NGS)技术进行分子分析。对于基因融合和PD-L1,免疫组织化学(IHC)检测PD-L1(抗体克隆号SP263)、ALK、ROS1、NTRK1/2/3的表达水平。采用荧光原位杂交(FISH)检测RET基因重排,确认ROS1和NTRK阳性IHC检测结果,并在IHC结果不确定的情况下评估ALK基因重排。
研究结果
研究人群:
患者的临床病理特征见表1。早期和晚期肿瘤在年龄、性别和组织学类型方面无显著差异。对于ES肿瘤,几乎所有病例的手术标本都进行了分子检测。
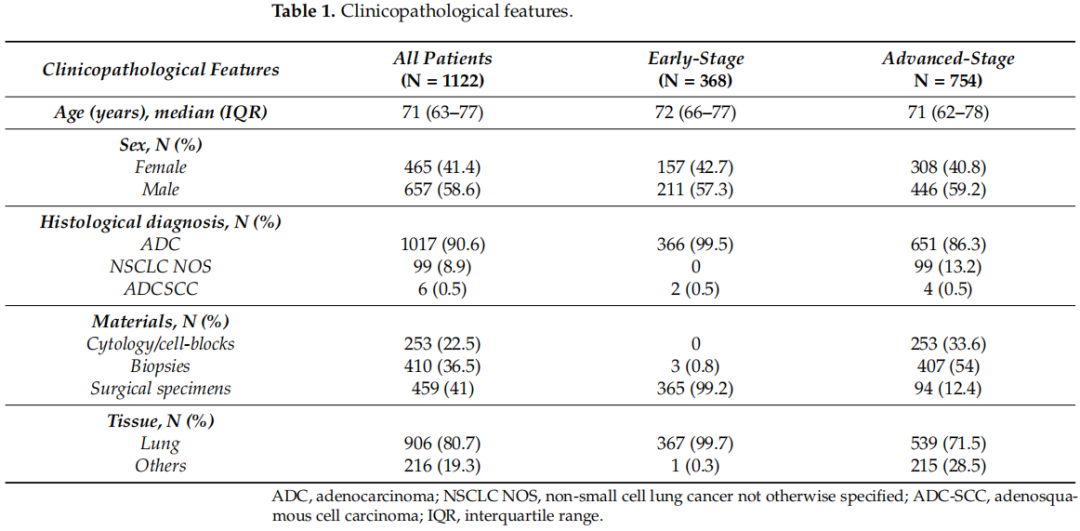
表1
基因变异:
所分析的基因突变和重排的发生率在晚期和早期NSCLC之间存在差异(图1)(p = 0.005)。简而言之,BRAF p.(V600E)变异和MET外显子14跳变在两组之间存在显著差异。BRAF p.(V600E)变异在晚期NSCLC中更为普遍,而MET外显子14跳变在ES-NSCLC中更为普遍。其他变异没有显示出显著的差异。表2报告了可干预基因变异发生率的详细信息。
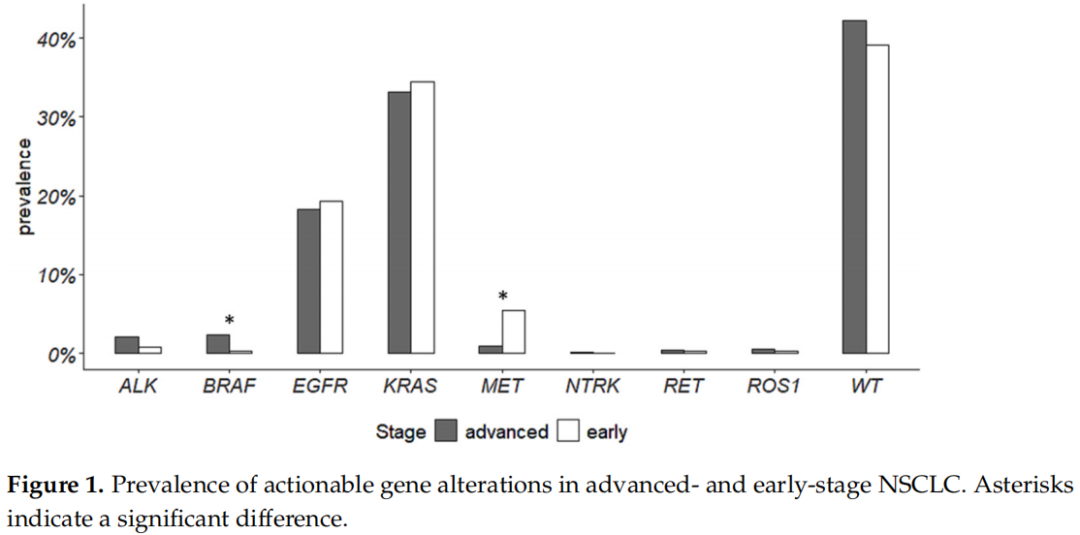
图1
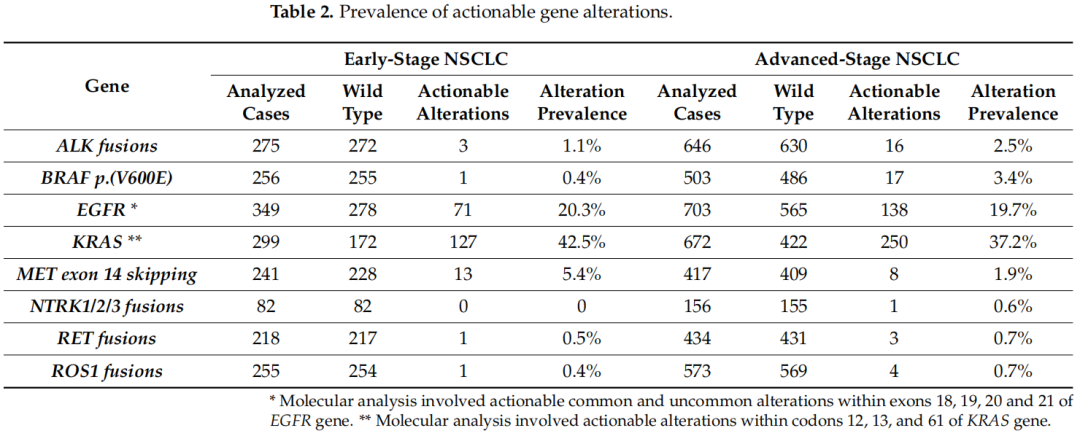
表2
表3报告了不同类型EGFR突变的发生率。关于KRAS突变,在ES-NSCLC中,40%的KRAS突变病例携带p.(G12C)突变,相当于所分析的所有ES病例的17%。在晚期NSCLC中,37%的KRAS突变病例有p.(G12C),相当于所有分析的晚期病例的14%(图2)。
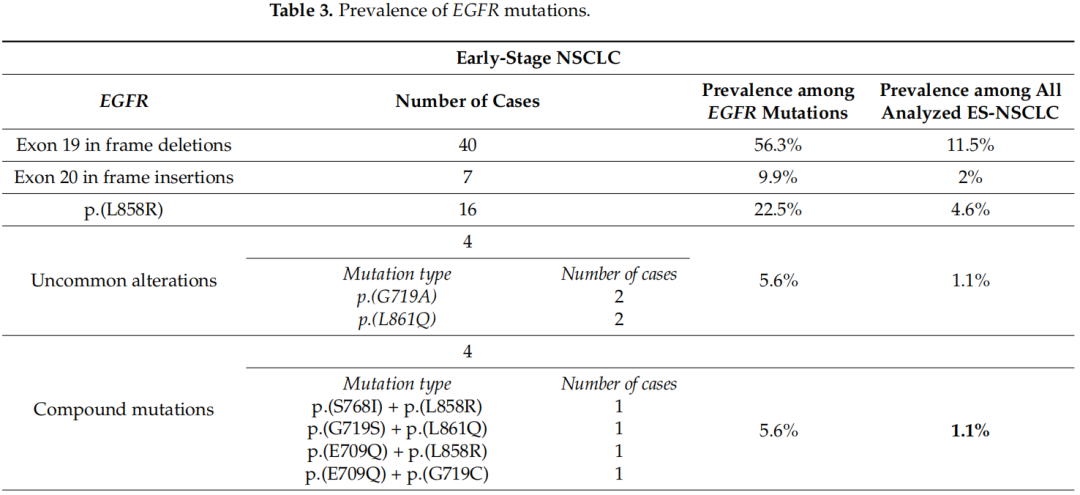
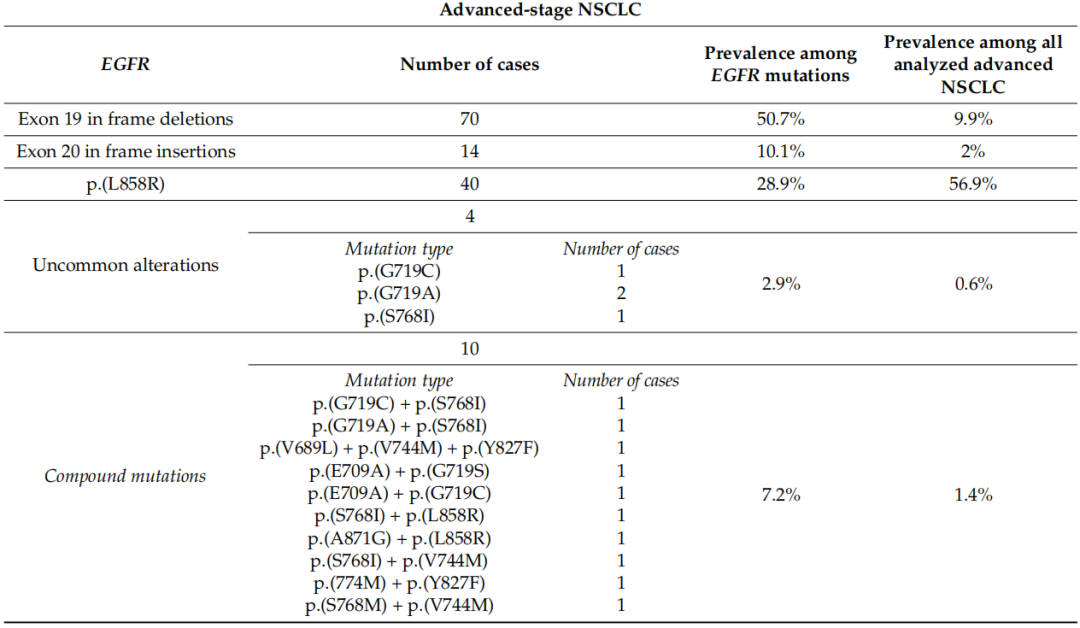
表3
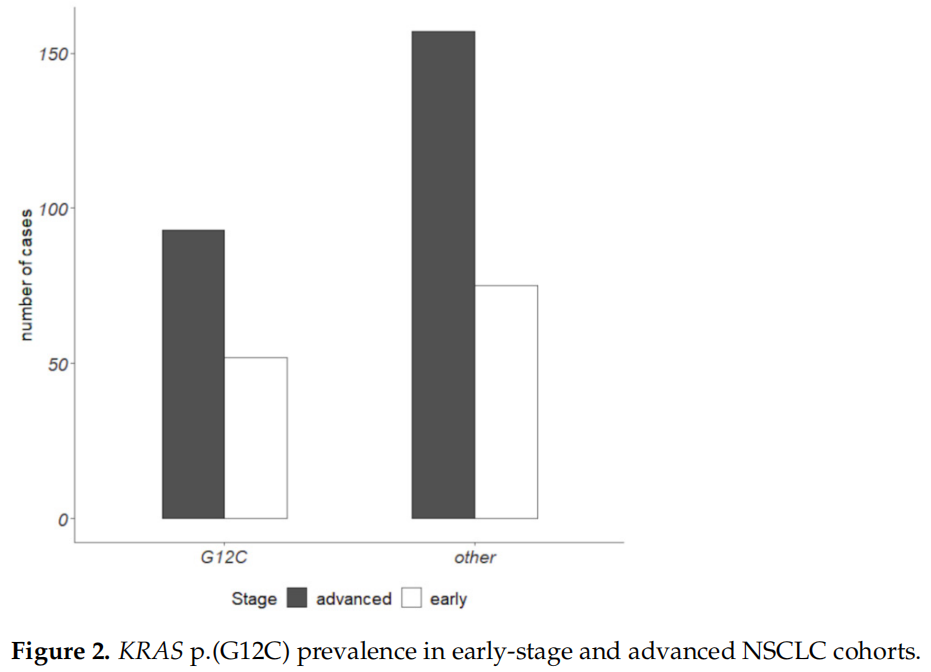
图2
LUAD TCGA队列中早期肿瘤中可干预变异的发生率:
LUAD(肺腺癌)TCGA队列中分析的总共470例为早期病例,研究者考虑将其用于计算可干预变异的发生率(图3)。可干预的EGFR变异的发生率为10.5%,KRAS为29.4%,MET为2.1%,ALK为1%,RET为0.4%,ROS1为1.3%,NTRK为0.2%。由于IIIB期和IV期病例数量较少,因此未与晚期肿瘤进行比较。

图3
PD-L1表达水平:
在ES和晚期NSCLC中评估PD-L1表达水平与可干预变异的关系。在EGFR、KRAS和MET突变的情况下,晚期NSCLC中PD-L1的表达高于ES-NSCLC(图4)。
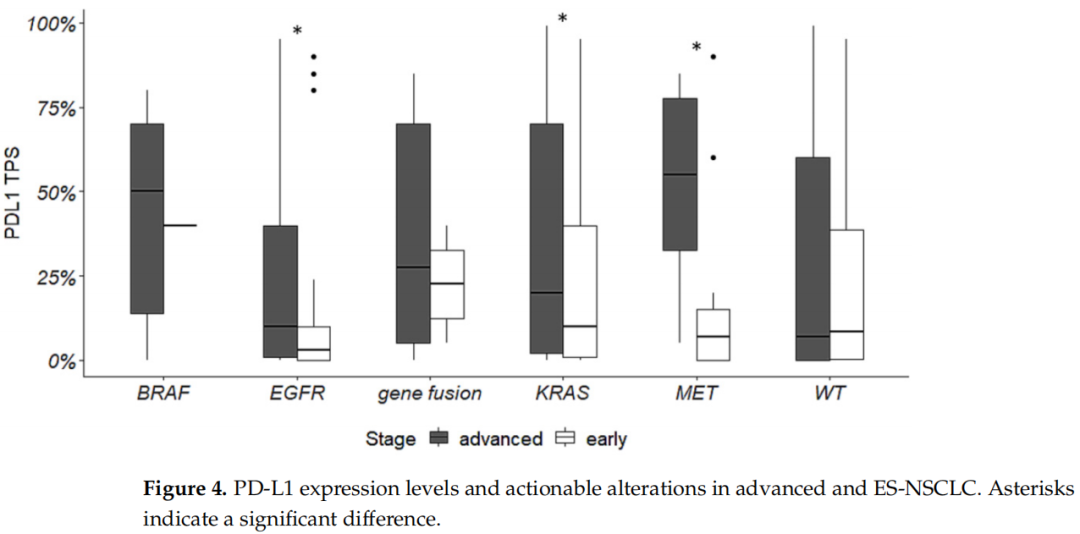
图4
此外,研究者发现在ES-NSCLC中,与EGFR野生型相比,EGFR突变型肿瘤中PD-L1的表达水平较低(p=0.02),而在其他可靶向变异的肿瘤中没有观察到差异。另一方面,在晚期NSCLC中,与野生型肿瘤相比,BRAF (p = 0.009)、KRAS (p = 0.0001)、MET(p = 0.02)突变肿瘤和携带基因融合的肿瘤(p = 0.03)的PD-L1表达水平更高。
讨 论
ES-NSCLC约占肺癌病例的30%。多年来,根据肿瘤分期和临床特征,手术联合新辅助或辅助化疗一直是标准治疗。然而,疾病复发率很高(30-50%),尤其是对于已切除的III期肿瘤。近年来,随着精准医学进入临床实践,ES-NSCLC的新辅助和辅助治疗都发生了变化。迄今为止,评估EGFR和ALK基因中可干预变异以及评估PD-L1表达水平是ES-NSCLC常规评估的一部分,以便选择适合接受EGFR TKI或免疫检查点抑制剂治疗的患者。
关于ES-NSCLC中其他可作为靶点的罕见变异的发生率和作用的数据很少。本研究在一个连续的单中心队列中证实,ES和晚期NSCLC中主要驱动变异的发生率相当。值得注意的是,研究者发现MET外显子14跳跃变异(在ES-NSCLC中富集)和BRAF p.(V600E)突变(在晚期NSCLC中富集)存在显著差异。Muthusamy等人此前在2022年报告了类似的结果。他们在包含6,697例NSCLC(包括1,177例早期肿瘤)的队列中估算了可干预变异的发生率。在ES-NSCLC中,他们报告的可作为治疗靶点的EGFR变异的发生率为16.1%,KRAS为41.7%,BRAF p.(V600E)为1.5%,MET外显子14跳跃变异为3.1%,ALK重排为1.8%,RET为1.1%,ROS1为0.6%,以及NTRK为0。与本研究相比,他们发现仅在ES-NSCLC的KRAS突变和晚期NSCLC的ALK基因融合中显著富集,但他们报告在晚期肿瘤中MET外显子14跳跃变异的发生率较低(2.1%),BRAF p.(V600E)的发生率较高(2.3%)。总体而言,他们的研究结果与本研究结果一致,即使在本研究的队列中,KRAS突变和ALK融合均未达到统计学显著性(图1)。另一方面,在LUAD TGCA队列的早期肿瘤中,可干预变异的发生率与本研究和Muthusamy的研究均不同。例如,在ES LUAD TGCA队列中,EGFR变异的发生率为10.5%,而在本研究和Muthusamy的研究中,EGFR变异的发生率分别为20.3%和16.1%(图3)。这些差异可能由几个原因引起,首先是人群特征、规模和数据收集。Muthusamy等引用了一个从数百个医疗中心收集数据的临床基因组数据库,他们的ES-NSCLC人群主要由白种人组成,也包括其他种族(亚洲人、黑种人或非裔美国人等)。TCGA数据来自世界各地的多个站点,包含了不同的种族,数据集具有极大的异质性。本研究数据来自一个中心,仅纳入了主要来自同一地理区域的白种人患者。众所周知,在人群中,可干预变异的发生率可能不同。此外,在上述研究中使用了不同的分子检测方法。Muthusamy等使用了杂交捕获NGS检测试剂盒,TCGA数据来自全外显子组测序,而本研究使用热点质谱分析和基于扩增子的NGS检测试剂盒检测基因突变,使用FISH和IHC检测基因融合。此外,TCGA数据来自新鲜冷冻的肿瘤组织,而在本研究和Muthusamy的研究中,都使用了FFPE肿瘤组织,从而实现了肿瘤组织的富集。分子检测方法和生物材料的类型可影响基因变异的检测。
ES-NSCLC中MET外显子14跳跃突变的发生率高于晚期NSCLC,值得进一步研究。在之前的一项研究中,Recondo等报道在ES-NSCLC中,MET外显子14跳跃突变的发生率为2.8%,而在本研究中,这一发生率为5.4%。MET外显子14跳跃突变已被批准用于预测转移性NSCLC患者对TKI的应答情况,但关于ES-NSCLC的有趣病例报告也已发表。例如,Fu和合作者报告了1例IIIA-N2期肺腺癌病例,该病例的MET外显子14跳跃突变呈阳性,在新辅助治疗中接受了savolitinib(赛沃替尼,一种MET TKI)治疗。患者术后病理缓解率为50%,最终病理分期为pT1cN0M0。同样地,Wang和合作者报道了一个局部晚期NSCLC病例,该病例携带MET外显子14跳跃突变,接受克唑替尼新辅助治疗后达到了完全病理缓解。有趣的是,描述的病例由于术后短期停用克唑替尼而发生快速转移,在克唑替尼再激发后获得持久的完全缓解。这不仅强调了新辅助MET TKI的潜在疗效,也强调了术后长期靶向治疗的重要性。
除了MET,越来越多的证据表明,对于早期肺癌,新辅助和辅助靶向治疗是可行的。奥希替尼已被批准用于可切除的EGFR突变型ES-NSCLC的辅助治疗,目前正在评估其在新辅助治疗中的应用。事实上,初步数据已经证明了奥希替尼新辅助治疗可切除的EGFR突变NSCLC的安全性和可行性。然后,如ALINA试验的期中分析所示,携带ALK重排的完全切除ES-NSCLC可从ALK TKI阿来替尼(alectinib)辅助治疗中获益。据报道,无论是在II-IIIA期NSCLC中,还是在治疗人群的意向中,阿来替尼与化疗相比均有显著的DFS获益。阿来替尼作为新辅助治疗的可行性也有报道。关于其他靶向疗法对ES-NSCLC的疗效,由于某些变异类型罕见,目前仍缺乏来自临床试验的结论数据。然而,有证据表明靶向治疗对癌基因依赖的ES-NSCLC有效。例如,Goldman及其合作者最近报道了1例IB期KIF5B-RET融合阳性NSCLC患者接受selpercatinib(塞普替尼,一种RET TKI)新辅助治疗后,达到了病理完全缓解。同样,Chen和合作者描述了一例新型LDLR-ROS1融合阳性的IIIA-NSCLC患者,该患者接受克唑替尼作为辅助治疗,并获得了29个月的无复发生存期。BRAF p.(V600E)突变在ES中比在晚期NSCLC中更罕见。然而,Liu等报道了一例接受BRAF和MEK抑制剂新辅助靶向治疗,并随后接受根治性手术切除的IIIA期p.(V600E)肺腺癌患者达到了显著病理缓解。现有数据虽然是初步的,但支持在日常实践中需要更完整的分子表征。
此外,尽管ICI近期被批准用于新辅助和辅助治疗,但人们对其用于癌基因依赖的ES-NSCLC仍有一些担忧。明确不同的分子变异如何以及在多大程度上影响PD-L1表达水平和免疫治疗应答对于更好地理解肿瘤基因谱和改善患者临床结局至关重要。总体而言,疾病晚期可能比早期更容易表达PD-L1已被广泛证实。此外,在本研究队列中,研究者发现有EGFR、KRAS和MET外显子14跳跃变异的晚期NSCLC患者的PD-L1表达水平高于ES-NSCLC患者。在ES-NSCLC队列中,与野生型肿瘤相比,只有在有EGFR突变的情况下,PD-L1表达水平非常低,而在晚期肿瘤中,PD-L1在携带BRAF p.(V600E)、KRAS和MET外显子14跳跃变异和基因融合的病例中显著表达。这些结果与之前的报道一致,支持了本研究结果。同样,Schoenfeld及其合作者在一个大型肺腺癌队列中发现,KRAS和MET的变异与PD-L1的高表达显著相关,而EGFR突变与PD-L1表达的低水平相关。基因变异直接影响PD-L1的预测价值。在转移性肿瘤中,据报道,在有可作为治疗靶点的驱动改变(KRAS突变除外)的肿瘤中,ICI的临床活性较低,但在某些病例中,它们可诱导肿瘤消退。在这种情况下,对于有可干预变异的患者,建议在考虑免疫治疗之前进行靶向治疗和化疗。关于ES-NSCLC,Su等评估了驱动突变对ICI+化疗新辅助治疗结局的影响。11例患者中3例复发;其中2例携带EGFR激活突变[p.(L858R)和第20外显子插入突变],1例携带MET第14号外显子跳跃突变。虽然ICI对EGFR突变肿瘤的有效性较低是众所周知的,但目前尚不清楚MET外显子14跳跃突变的存在如何影响早期和晚期NSCLC的免疫治疗应答。在晚期背景下,回顾性研究表明MET外显子14变异的肿瘤比KRAS突变以外的癌基因成瘾的肿瘤更能从免疫治疗中获益。然而,它们的疗效仍低于野生型肿瘤。在MET外显子14跳跃阳性的ES-NSCLC中,评估包括ICI和TKI在内的联合治疗的有效性也可能是有趣的。
总体而言,即使在PD-L1高表达的情况下,ICI对癌基因依赖性肿瘤的疗效下降仍在研究中。然而,具有最常见可干预变异的肿瘤通常具有较低的肿瘤突变负荷以及“冷”和免疫抑制的肿瘤微环境。因此,研究者推测,在这些病例中,PD-L1的表达可能不依赖于免疫细胞和肿瘤细胞之间的相互作用,而更有可能继发于其他癌基因途径(如JAK/STAT)的激活。尽管目前仍有有限的证据,但确定癌基因依赖的ES-NSCLC可以以更高效、更经济的方式指导临床决策。避免对癌基因依赖肿瘤进行无效的免疫治疗,可以保护患者免受不必要的副作用,并降低治疗费用。
除了确定新辅助治疗和辅助治疗方法外,ES-NSCLC的多基因检测对疾病复发也有价值,并且疾病复发是一个常见事件。诊断时有分子结果的患者从复发到开始一线治疗的时间更短。这可能对临床结局产生重要影响,但尚未评估早期分子检测对ES-NSCLC总生存期的影响。
现行指南建议对晚期NSCLC进行广泛的分子检测,但越来越多的证据表明其在ES-NSCLC中也有价值。即使目前批准用于ES-NSCLC的强制性生物标志物只有EGFR、ALK和PD-L1,使用NGS panels而不是单一基因检测更具成本效益。考虑到奥希替尼是ES-NSCLC唯一获批的靶向疗法,因此这些肿瘤的完整分子特征仍然会受到国家卫生系统报销政策的阻碍。在这种情况下,有必要推动临床试验和多中心研究,以更好地确定常见和罕见的可作为治疗靶点的癌基因变异在ES-NSCLC中的治疗作用。
总之,在这项研究中,研究者描述了ES和晚期NSCLC的队列特征,报告了相似的可干预变异发生率。这些结果证实了多基因检测在ES-NSCLC中的价值和便利性,ES-NSCLC的诊断和治疗模式正在迅速发展。确定癌基因依赖的ES-NSCLC(占病例的相当大比例)有助于改善患者对免疫治疗的选择,促进患者参与关于可靶向治疗的罕见变异的临床试验,并更好地管理疾病复发。
生物标志物检测策略可以改善ES-NSCLC患者的管理。在本研究中,研究者证实了与晚期肿瘤相似,相当比例的ES肿瘤具有可靶向变异。此外,MET外显子14跳跃突变在早期患者中比在晚期患者中更常见,因此支持进一步研究MET抑制剂在新辅助治疗和辅助治疗中的疗效。虽然ES-NSCLC的现行诊断流程仅需要评估EGFR状态、ALK融合和PD-L1表达水平,但对其他罕见的、可干预变异进行分析可以改善临床实践。正如已经报道的,除KRAS突变外,存在癌基因变异不利于对免疫检查点抑制剂产生应答。因此,ES-NSCLC的完整分子特征有助于优化患者的免疫治疗选择。发现癌基因依赖的ES-NSCLC还可以促进患者参与临床试验,并改善疾病复发的管理。
参考文献:
Bruno, R.; Poma, A.M.; Panozzi, M.; Lenzini, A.; Elia, G.; Zirafa, C.C.; Aprile, V.; Ambrogi, M.C.; Baldini, E.; Lucchi, M.; et al. Early-Stage Non-Small Cell Lung Cancer: Prevalence of Actionable Alterations in a Monocentric Consecutive Cohort. Cancers 2024, 16, 1410. https://doi.org/10.3390/cancers16071410

作者:苏州绘真医学
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#非小细胞肺癌# #生物标志物#
0