AUC 0.94!全球首个胃癌片段组学大型早筛研究登陆Genome Med
2024-06-15 测序中国 测序中国
浙江省肿瘤医院程向东教授、苏丹教授、俞鹏飞教授团队联合宁波市第二医院陈平教授团队与世和基因合作,将世和MERCURY cfDNA片段组学技术的应用拓展至胃癌早筛,AUC达0.937。
导语
胃癌是全球范围内导致癌症相关死亡的第三大原因[1]。根据国家癌症中心的统计,2022年我国胃癌新发病例35.87万例,死亡26.04万例[2]。然而,目前胃镜筛查仅覆盖高风险人群,缺乏适用于一般风险人群的高可及性筛查手段。近年来,多项研究证实了cfDNA片段组学技术在早期癌症筛查中的可行性[3-6],但其在胃癌早筛中的临床证据仍有待进一步确认。
浙江省肿瘤医院程向东教授、苏丹教授、俞鹏飞教授团队联合宁波市第二医院陈平教授团队与世和基因合作,将世和MERCURY cfDNA片段组学技术的应用拓展至胃癌早筛(DECIPHER-GC),AUC达0.937。研究结果于近日发表在中科院JCR 1区期刊Genome Medicine。

研究亮点
01 全球首个:
基于cfDNA片段组学技术的大型胃癌早筛研究,为MERCURY技术应用于肿瘤早筛提供了新证据。
02 稳健性好:
湿试验流程均在浙江省肿瘤医院内部完成,模型性能优异,独立验证稳定,AUC超0.972,院内落地可行性高。
03 重复性高:
外部队列独立验证(宁波市第二医院),AUC接近0.937,可重复性高,稳定性强。
研究方法
该研究从浙江省肿瘤医院招募并筛选出416例参与者,其中包括183例I、II期胃癌,23例慢性胃炎和210例健康人,按照招募时间的先后分为训练集和独立验证集。外部验证集来源于宁波市第二医院,包括47例I、II期胃癌,5例慢性胃炎和44例健康人。三个数据集中,I期胃癌占比分别为77%、77%、74%。湿实验和特征生成工作均在浙江省肿瘤医院内部完成。收集参与者血浆cfDNA样本并进行低深度WGS测序,从中提取SNS、NCP、CNV和FSP四种cfDNA特征,用于构建和验证MERCURY cfDNA胃癌早筛模型。
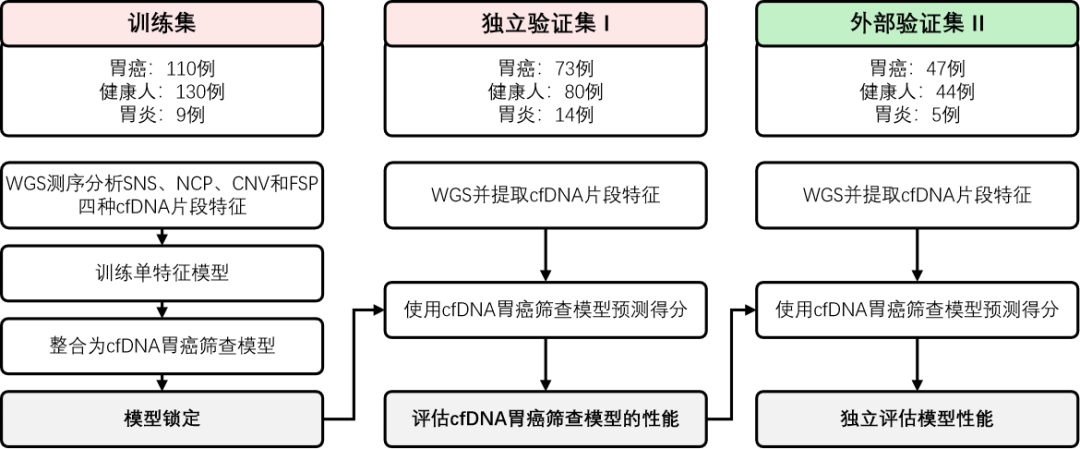
图 1. 该研究设计流程概况
研究结果
训练集中,四种cfDNA片段特征的AUC在0.834到0.912之间,特征叠加后AUC提升至0.962。使用Youden指数确定cut-off值为0.715并锁定模型,此时MERCURY cfDNA胃癌早筛模型敏感性为88.2%,特异性92.1%。
独立验证集中,模型的AUC为0.972,敏感性91.8%,特异性91.5%。外部验证集中,模型的AUC为0.937,敏感性87.2%,特异性89.8%。
该模型可精准识别早期胃癌,对I期胃癌的敏感性在独立验证集和外部验证集中分别为91.1%和85.7%,对II期胃癌的敏感性在两个验证集中也均高于91%。
此外,该模型在排除慢性胃炎方面也有较好的表现,独立验证集中,其特异性为78.6%,而在外部验证集中达到了100%。
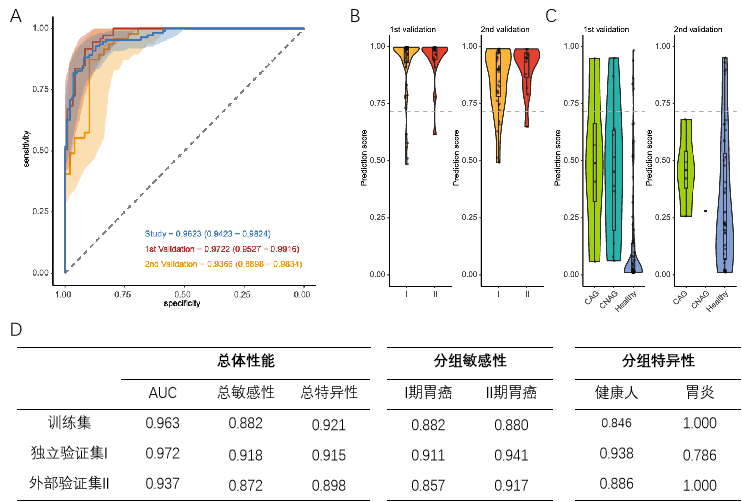
图 2. cfDNA胃癌早筛模型在不同数据集中的性能
结 语
该研究首次报导了cfDNA片段组学模型用于胃癌筛查的性能,拓展了世和MERCURY技术的适用范围,为一般风险人群的胃癌筛查提供了高准确性、低侵入性、高可及性的筛查方法。
基于MERCURY cfDNA片段组学技术,世和基因开发了多癌种早筛产品世和鹰眼CanScan®。该产品仅需一管外周血即可筛查包括肺癌、肝癌、肠癌、胃癌、食管癌、乳腺癌等多种高发癌种,模型在独立验证中的敏感性超87%,特异性达98%,溯源准确性为92%,相关研究已在2024年AACR会议上进行口头报告。世和鹰眼CanScan®目前已取得欧盟CE认证,美国FDA突破医疗器械认定,检测性能达国际领先水平。
参考文献
[1.] Sung H, et al. CA Cancer J Clin. 2021;71(3):209-249. doi:10.3322/caac.21660.
[2.] Han BF, et al. Journal of the National Cancer Center 2024;4(1):47-53. doi:10.1016/j.jncc.2024.01.006.
[3.] Cristiano S, et al. Nature. 2019;570(7761):385-389. doi:10.1038/s41586-019-1272-6.
[4.] Bao H, et al. Mol Cancer. 2022;21(1):129. doi:10.1186/s12943-022-01594-w
[5.] Wang S, et al. Am J Respir Crit Care Med. 2023;207(9):1203-1213. doi:10.1164/rccm.202109-2019OC
[6.] Zhang X, et al. Hepatology. 2022;76(2):317-329. doi:10.1002/hep.32308
[7.] Yu P, et al. Genome Med. 2024;16(1):79. doi:10.1186/s13073-024-01352-1
作者:测序中国
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#胃癌# # cfDNA片段组学#
7