Nature Cell Biology:效果秒杀端粒酶,最新研究揭示T细胞可通过全新机制延长自身端粒,防止衰老
2022-09-18 王聪 “生物世界”公众号
抗原呈递细胞(APC)通过细胞外囊泡(EV)向 T 细胞转移端粒,从而使 T 细胞免于衰老并促进长期免疫记忆。这种不依赖端粒酶的新机制,有助于开发出延长免疫系统寿命的新方法。
我们身体内的免疫细胞始终处于高度警戒状态,时刻准备与病原体作斗争。为了有效发挥作用,它们需要在体内持续工作数十年。此前,学术界普遍认为,免疫细胞通过激活端粒酶活性来延长端粒,从而延长寿命、延缓衰老。
然而,T 细胞等免疫细胞在对抗病原体的过程中需要大量克隆扩增,从而导致端粒损耗,而仅仅通过端粒酶难以弥补这些损耗。因此,我们对于衰老 T 细胞上如何形成的,以及 T 细胞除了激活端粒酶外,是否还有其他途径来逃避衰老并维持长期免疫记忆仍有相当的认知差距。
近日,伦敦大学学院的 Alessio Lanna 教授团队在 Nature Cell Biology 期刊发表了题为:An intercellular transfer of telomeres rescues T cells from senescence and promotes long-term immunological memory 的研究论文。
该研究发现,抗原呈递细胞(APC)通过细胞外囊泡(EV)向 T 细胞转移端粒,从而使 T 细胞免于衰老并促进长期免疫记忆。这种不依赖端粒酶的新机制,有助于开发出延长免疫系统寿命的新方法,帮助人们活得更健康、更长寿,并且还可能有助于癌症和痴呆等疾病的临床治疗。

免疫系统为什么会衰老?
众所周知,真核生物细胞的每条染色体末端都包含着一种被称为端粒(Telomere)的结构,它是一段 TTAGGG 高度重复系列与蛋白质组成的复合体。端粒的存在有两个作用:一是保护染色体上的基因编码区并防止它们被破坏。二是作为一个生命时钟,控制着细胞可以分裂的次数。细胞每分裂一次,端粒就会缩短一点。一旦端粒消耗到一定程度,细胞就会进入衰老状态并死亡。
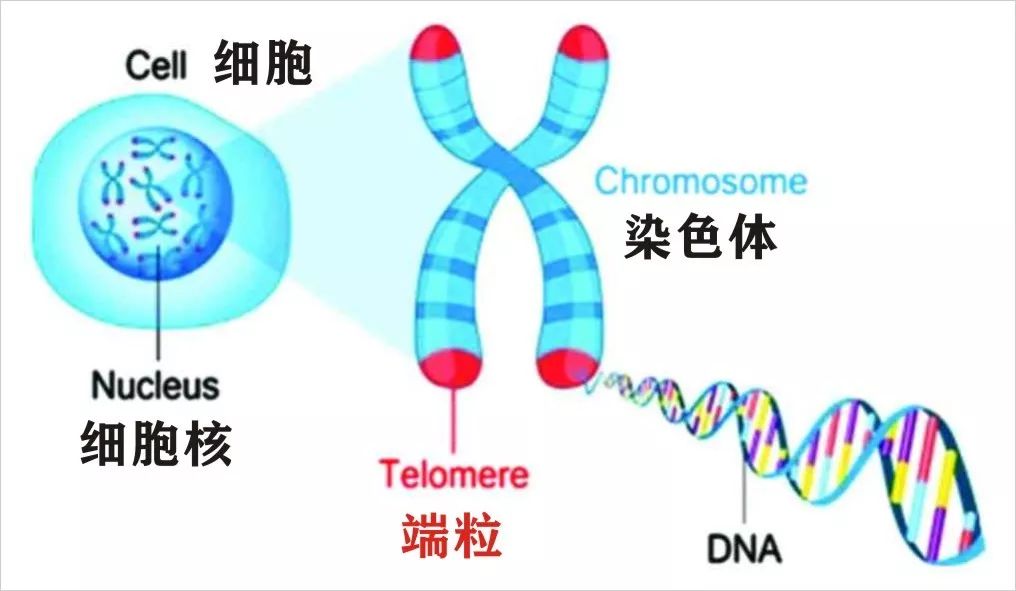
T 细胞作为一种重要的免疫细胞,也也和其他细胞一样,随着细胞分裂,其端粒会越来越短。一旦端粒短到一定程度,T 细胞就会停止分裂并进入衰老状态,从而导致免疫系统不再有效运行,进而导致慢性感染、癌症以及死亡的发生。因此,端粒损耗也是衰老的重要标志之一。
出乎意料的新发现
端粒酶是一种 DNA 合成酶,专门用于维持干细胞、免疫系统细胞以及胎儿组织、生殖细胞中的端粒。但在其他细胞中不发挥作用,导致细胞的端粒损耗。
但即使在端粒酶活跃的免疫细胞中,持续的免疫反应也会导致端粒酶的进行性失活,从而导致端粒缩短,直至免疫细胞衰老、死亡。
在这篇最新论文中,研究团队对 T 细胞对抗外来微生物感染的反应进行了研究。他们发现,不同免疫细胞之间存在着由细胞外囊泡(Extracellular Vesicles,EV)介导的端粒转移反应。
具体来说,由 B 细胞、树突状细胞或巨噬细胞组成的抗原呈递细胞(APC)可以作为端粒供体细胞,通过细胞外囊泡(EV),向 T 细胞转移端粒。接受端粒转移的 T 细胞变得长寿且具有记忆和干细胞属性,使得 T 细胞能够长期保护宿主免受致命感染。
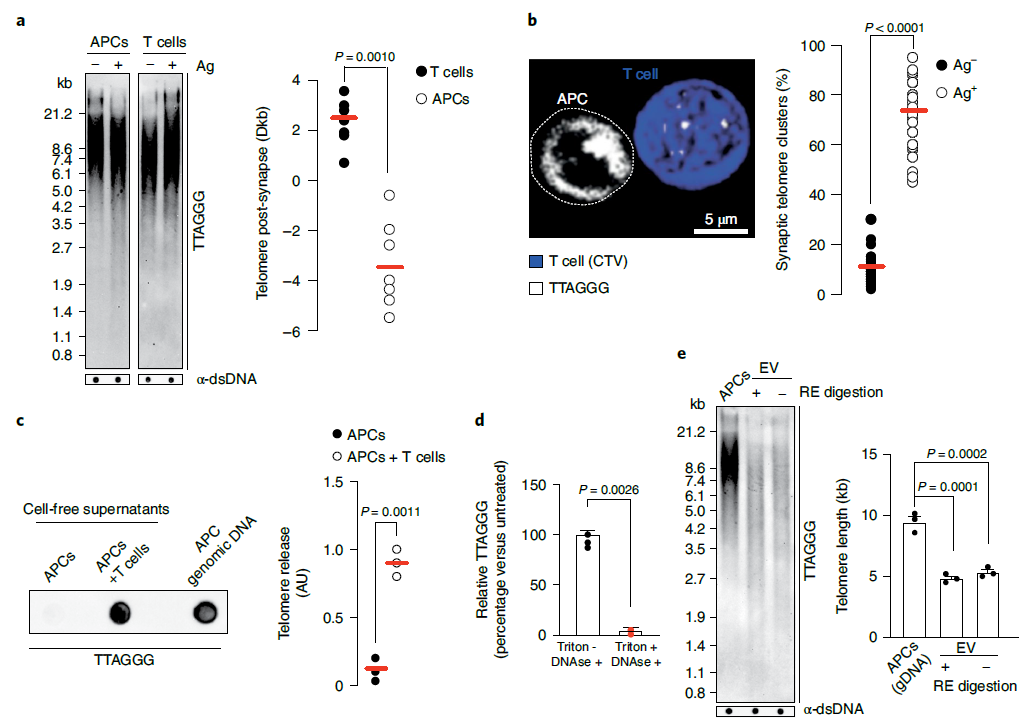
从机制上来说,一些 T 细胞通过独立于端粒酶作用从抗原呈递细胞(APC)获取端粒囊泡来延长端粒。与这些 T 细胞接触后,抗原呈递细胞(APC)降解端粒蛋白复合体(Shelterin)以提供端粒,这些的端粒被端粒修剪因子 TZAP 切割,然后转移到免疫突触处的细胞外囊泡(EV)中。这些携带了端粒的细胞外囊泡被称为端粒囊泡,其中还携带了 Rad51 重组因子,该重组因子帮助端粒与 T 细胞的染色体末端融合,将端粒平均延长了3000个碱基对,这一端粒延长效果是端粒酶带来的延长的30倍之多。
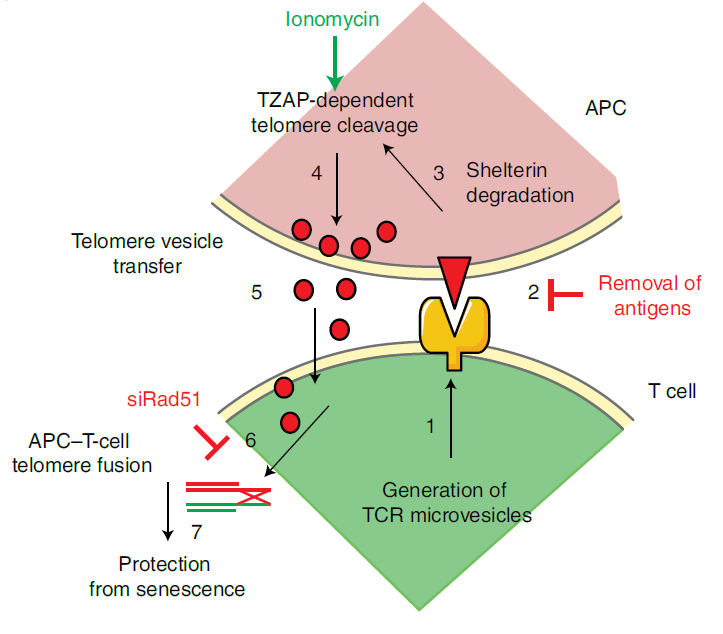
研究团队表示,这项研究为端粒和端粒酶的研究做出了重要补充,表明了免疫细胞之间可以通过端粒转移来调节端粒长度,更关键的是,这些发现提示了我们,可以仅仅通过转移端粒实现减缓甚至治愈衰老。
利用新机制抗衰老
在发现了这种新的免疫细胞抗衰老机制后,研究团队进一步确定了可以从血液中纯化这种端粒细胞外囊泡,并且把它们添加到 T 细胞中时,可以在人类和小鼠的免疫系统中呈现出抗衰老活性。
实现结果显示,在人类细胞和小鼠中,这种纯化的细胞外囊泡制剂可以单独给药或与疫苗联合给药,延长免疫系统的保护时间,从而避免再次疫苗接种的需求。
总的来说,该研究发现了一种能够减缓甚至可能阻止免疫细胞自然衰老的新机制,利用这种新机制,有望开发出延长免疫系统寿命的新方法,帮助人们活得更健康、更长寿,并且还可能有助于癌症和痴呆等疾病的临床治疗。

Alessio Lanna
该研究的领导者 Alessio Lanna 教授表示,端粒已经被研究了40多年,这些年来,一直认为细胞内只有端粒酶这一种途径来延长和维持端粒长度。而这项最新研究发现了一种全新的端粒延长机制,这种机制能够不依赖端粒酶而发挥作用,而且作用效果要远超端粒酶。
原始出处:
Lanna, A., Vaz, B., D’Ambra, C. et al. An intercellular transfer of telomeres rescues T cells from senescence and promotes long-term immunological memory. Nat Cell Biol (2022). https://doi.org/10.1038/s41556-022-00991-z.
作者:王聪
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#Bio#
60
#Cell#
58
#CEL#
51
#Nat#
53