J Clin Oncol:免疫治疗时代,临床试验进行中期无效性分析是否合理?
2018-07-03 肿瘤资讯编辑部 肿瘤资讯
随机试验设计的一个重要特征是中期无效性分析,如果研究结果显示试验组劣于或不可能优于标准治疗组时,提前终止试验。但是当试验组可能存在延迟效应时,中期无效性分析的合理性则受到质疑。近期,《JCO》发表的一项研究评估了在存在延迟效应时,中期无效性分析是否合理,并进行了一些改进建议。
随机试验设计的一个重要特征是中期无效性分析,如果研究结果显示试验组劣于或不可能优于标准治疗组时,提前终止试验。但是当试验组可能存在延迟效应时,中期无效性分析的合理性则受到质疑。近期,《JCO》发表的一项研究评估了在存在延迟效应时,中期无效性分析是否合理,并进行了一些改进建议。
背景:在临床试验开展过程中,如果试验组不优于甚至可能劣于标准治疗组,那么正式的中期无效性分析可以让研究者提前结束研究,这就可以减少接受无效治疗的患者人数(如果研究仍在入组)或让患者尽早停止用药。因此,在随机临床试验设计时通常都包括了中期无效性分析。然而,当研究药物存在延迟治疗效应时,开展中期无效性分析可能会降低研究发现真正有效试验治疗的能力(如研究的统计效能降低)。显然,在进行早期中期分析时,可能在随机后还没有表现出治疗效果时,出现终点事件,研究更有可能因为无效而错误的提前终止。
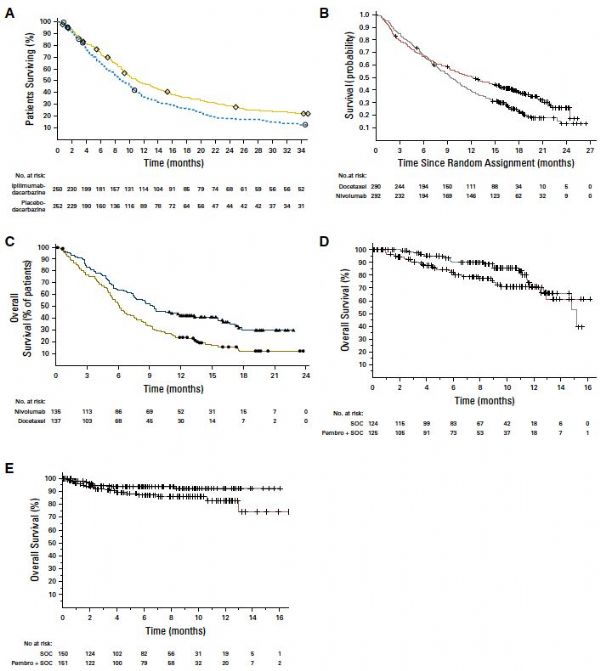
随着免疫检查点抑制剂的引入,延迟效应在研究设计时变得更为重要。生物学机理和经验性的证据均提示免疫治疗可能需要几个月后才会显示出获益,这有别于直接作用于癌细胞的化疗药物。如下图1A显示了伊匹木单抗+达卡巴嗪对比安慰剂+达卡巴嗪用于初治转移性黑色素瘤,两组的OS曲线开始重叠,在4个月之后才开始分离。此外,试验组也有可能最初劣于标准治疗组,之后优于,如图1B显示了CheckMate057研究中纳武利尤单抗对比多西他赛用于经治晚期非鳞非小细胞肺癌,这种情况更多见于试验药物和目前的标准治疗相比。虽然免疫治疗中延迟效应很常见,但也不是绝对现象,如图1C显示了纳武利尤单抗对比多西他赛用于经治肺鳞癌,并没有显示出明显的延迟效应。最后,免疫治疗并不是在所有情况下都有效,如图1D和1E显示了帕博利珠单抗用于多发性骨髓瘤的OS结果,两个研究均因阴性的中期分析结果提前终止。
图1. 一些免疫治疗研究中的OS结果
目前已经关注到,在免疫治疗研究中应用中期无效性分析可能会降低统计效能,因此在BMS开展伊匹木单抗研究时,直接省去了中期无效性分析。本文在具有延迟治疗效应的研究中,模拟了目前常用的不同类型的中期无效性分析可能带来的获益和风险,同时引入了一个新的中期无效性分析规则。
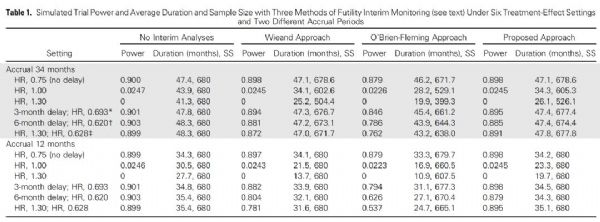
方法:研究者对在统计设计时计划进行中期无效性分析的研究进行模拟。首先选择了一项Chen等设计的研究,随机1:1分配入组680例患者,入组时为34个月(按计划入组),计划进行最终分析的时间为达到512个事件数时。研究无失访数据。如果加快入组速度,则有可能增加无效性分析的负性结果(会因为延迟效应,在早期出现更高比例的事件),研究者考虑了自然入组时间为12个月。如果治疗没有延迟效应,当最终分析在第一个患者入组后的47个月左右进行时(如果入组时间为12个月)研究有90%的把握检测HR 为0.75。假定标准治疗组为指数级,中位生存期为12个月,则两组的曲线对比见下图2A。Chen等在研究设计时考虑了3个月的延迟效应。众所周知,延迟效应会降低试验的效能(如从上面的90%降低为72%)。为了更好的区分中期无效性分析的负性结果,研究设计时降低了HR值(至0.693),当没有无效性分析时,试验仍有90%的效能(图2B)。作者同时考虑了6个月延迟效应的情况(则H值为0.62,图2C),以及试验组在前3个月时劣于对照组(HR为1.30),然后超过对照组(3个月后HR为0.630,图2D)。
图2.假定的生存曲线(黄色试验组,蓝色对照组)
此外在免疫治疗临床试验时,还存在一种可能是部分患者会被治愈。这在标准化疗的研究中不常见,因此要做合理的时间内达到预期的事件数,需要增大样本量。假定在上述研究中,如果没有延迟效应,标准治疗组和试验组的治愈率分别为20%和30%,为了在合理的随访时间内,研究仍然有90%的检验效能,则样本量需增加至800,最终分析仍是在达到512例终点事件数时。
研究者评估了2个常用的中期无效性分析和1个更新设计的中期无效分析。第一个为Wieand规则,推荐在出现一般的预期事件数时,如果观察到的HR>1(即试验组劣于对照组),判断为无效终止试验。第二个规则更为激进,是基于O’Brien-Fleming b消耗函数,即分别在1/3事件数HR>0.998或2/3事件数HR>0.913时终止试验。研究者提议的新的无效性规则(Proposed approach)是对Wieand规则进行了部分修改,即在随机至少3个月后,出现至少50%的预期事件数和2/3的预测事件数时,HR>1则仍为试验无效。这一分析方法是为了确保终点事件在延迟效应以外出现,从而可靠的评估试验是否无效。
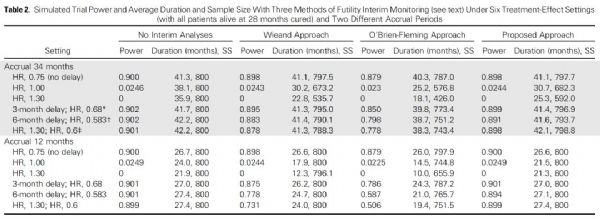
结果:当两组均无治愈患者时,模拟的结果见下表1,假定入组时间为34个月,表上半部分第1行的结果显示没有延迟效应时(图1A),试验有90%的检验效能,这种情况下,Wneand和新提议的中期分析规则都不会降低检验效能,而O’Brien-Fleming规则会降低2%的检验效能。表2-3行显示了当试验组无效时,中期无效性分析的优势。表4-6行直接评估了延迟效应时的情况,这时候O’Brien-Fleming规则会大大降低检验效能,而出现3个月,6个月或交叉效应时,Wneand规则会分别降低1%,2%和3%的检验效能。如果实际入组时间为12个月(表1下半部分),则中期无效性分析的获益会更少(第8-9行),Wneand和O’Brien-Fleming规则均会大大降低检验效能(第10-12行),尤其是出现交叉效应时,O’Brien-Fleming规则会使检验效能从90%降低至54%。而新提议的规则则仍然保持可接受的检验效能。当考虑到部分患者会被治愈时,评估结果见下表2。
结论和讨论:选择合适的中期无效性分析规则需要权衡患者安全性和公共健康考量。一方面,如果试验组无效,那么就希望可以减少暴露的患者数;另一方面,如果新的方案有效,则希望最大化发现获益。常用的中期无效性分析在没有治疗延迟效应时,可以取得最优化的结果,但如果存在治疗延迟则可能会降低检验效能。本研究中,研究者提出了一个新的规则,即通过延迟中期分析的时间,直到有足够的数据可以代表预期治疗效果时进行中期分析,可以重新达到安全性和降低统计效能之间平衡。最后,研作者建议,虽然在存在延迟效应时,需要甚至选择中期无效性分析,但是选用合适的规则仍然可以帮助我们减少无效治疗暴露的患者数,而不降低发现有效治疗方案的潜能。
原始出处:
Edward L. Korn,et al.Interim Futility Monitoring Assessing Immune Therapies With a Potentially Delayed Treatment Effect.J Clin Oncol.June 27, 2018.
作者:肿瘤资讯编辑部
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
小提示:本篇资讯需要登录阅读,点击跳转登录






#Oncol#
66
了解一下.谢谢分享!
121