FDA批准全球首个RSV mRNA疫苗mRESVIA(mRNA-1345)上市
2024-06-03 生物制品 生物制品
Moderna公司于5月31日宣布,其呼吸道合胞病毒(RSV)mRNA疫苗mRESVIA(mRNA-1345)已获得美国食品药品监督管理局(FDA)的批准,用于60岁及以上的成年人,旨在预防由RSV引
Moderna公司于5月31日宣布,其呼吸道合胞病毒(RSV)mRNA疫苗mRESVIA(mRNA-1345)已获得美国食品药品监督管理局(FDA)的批准,用于60岁及以上的成年人,旨在预防由RSV引起的下呼吸道疾病(RSV-LRTD)。此次批准是Moderna公司继其首款mRNA疫苗之后,获得的第二项重要批准。
mRESVIA疫苗是首个以单剂量预充式注射器形式提供的RSV疫苗,这为老年人提供了便利的接种方式。详细见:NEJM:mRNA-1345 疫苗对老年人呼吸道合胞体病毒感染的有效性和安全性

美国疾病预防控制中心(CDC)的一个专家咨询委员会计划在6月对该疫苗的适用性和目标受众进行投票表决。Moderna预期该委员会将对这款疫苗给出与其他类似产品相同的建议。一旦获得CDC的正面评价,Moderna的疫苗将有机会与葛兰素史克和辉瑞的疫苗竞争。这两家公司在去年秋季于美国推出了他们各自的疫苗产品,尽管辉瑞的疫苗销量暂时落后于葛兰素史克,但两者的销售额都达到了数亿美元。
mRESVIA是一种针对RSV的mRNA疫苗,它包含编码RSV表面表达的稳定前融合F糖蛋白的mRNA序列。F糖蛋白是病毒进入宿主细胞并引发感染的关键蛋白,并且其前融合构象是产生强效中和抗体的关键靶标。在RSV的A型和B型亚型中,F蛋白的结构高度保守。mRESVIA疫苗采用了与Moderna COVID-19疫苗相同的脂质纳米颗粒(LNPs)技术。
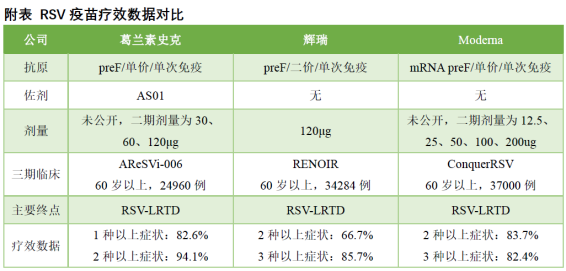
美国FDA此前已授予mRESVIA疫苗快速通道资格和突破性疗法认定,旨在帮助60岁及以上的成年人预防RSV引起的下呼吸道疾病(RSV-LRTD)和急性呼吸疾病(ARD)。此次批准是基于关键的ConquerRSV研究的中期分析结果,该研究是一项随机、双盲、安慰剂对照的临床试验,涉及来自22个国家的约3.7万名60岁或以上成年人。研究成功达到了所有主要疗效终点。当RSV-LRTD定义为至少两种症状时,安慰剂组有55例患者,而mRNA-1345组只有9例,显示出83.7%的疫苗效力;当定义为至少三种症状时,疫苗效力为82.4%。此外,mRNA-1345显示出良好的安全性,大多数不良反应为轻度或中度。
实在是不容易,从概念验证、临床试验,再到获批上市,关关难过,可以说RSV疫苗的开发才更像是一个正常mRNA疫苗上市所需要走过的路径和花费的时间。
-
最早,Moderna是和默沙东共同合作开发RSV mRNA疫苗,项目名为mRNA-1172,采用的是默沙东的脂质纳米颗粒进行递送,于2019年进入临床1期。 -
2021年8月3号,Moderna开发的mRNA-1345获得FDA的快速通道。 -
2022年,Moderna公布了一项关于mRNA-1345的1期临床数据,旨在评估mRNA-1345在年轻人(18-49岁)和老年人(65-79岁)中的安全性和免疫原性。总体来说,mRNA-1345在两组人群中均具有良好的耐受性。不同剂量的mRNA-1345 (50ug、100ug及200ug)在两组人群中具有相当的免疫原性,相比安慰剂组,均可触发明显的针对RSV-A/B的中和抗体滴度。 -
2022年2月2号,mRNA-1345 3期临床试验正式启动。 -
2023年1月30号,基于良好的3期临床数据,FDA授予mRNA-1345突破性疗法认定。 -
2023年12月14号,The New England Journal of Medicine正式刊登发表Moderna ConquerRSV 研究小组开发的 mRNA-1345 三期临床数据。这是一项随机的、双盲、安慰剂对照、临床2/3期试验,共招募35541名老年人受试者(60岁以上),注射1剂50 ug mRNA-1345,预防至少2种RSV相关的下呼吸道感染症状的效率为83.7%,预防至少3种RSV相关的下呼吸道感染症状的效率为82.4%,预防RSV相关的急性呼吸道感染效率为68.4%。此外,对于RSV-A/B两种毒株均具有免疫保护效果。详细见:NEJM:mRNA-1345 疫苗对老年人呼吸道合胞体病毒感染的有效性和安全性 -
2023年7月5号,Moderna已正式向欧洲、瑞士、澳洲及美国的药监局提交营销授权申请(marketing authorization applications)或者生物制剂许可申请(BLA)。
在2023年5月,美国食品药品监督管理局(FDA)对葛兰素史克公司的RSV疫苗Arexvy给予了市场准入许可,紧接着在6月,辉瑞制药的双价RSV疫苗Abrysvo也获得了批准。这两款疫苗的上市显著推动了葛兰素史克与辉瑞的销售额增长。根据这两家公司2023年第三季度的财务报告,辉瑞的Abrysvo实现了3.75亿美元的销售额,而葛兰素史克的Arexvy在同一时期则达到了7亿英镑的销售额,折合美元约为8.9亿。详细见:FDA已批准辉瑞呼吸道合胞病毒(RSV)二价疫苗 Abrysvo(RSVpreF,PF-06928316)上市、NEJM:婴儿注射nirsevimab预防RSV所致住院
中国目前还没有RSV疫苗获得批准上市,但国内在RSV疫苗的研发上正持续加速。Moderna的mRNA RSV疫苗的批准上市不仅标志着mRNA技术在新冠疫苗之外的重大突破,也为mRNA技术在更广泛领域的应用奠定了坚实的基础。
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#FDA# #Moderna# #呼吸道合胞病毒(RSV)# #RSV疫苗# #mRNA-1345#
12