Nature:科学家发现调控CD8+T细胞在肿瘤组织中定居的重要转录因子
2017-12-18 MedSci MedSci原创
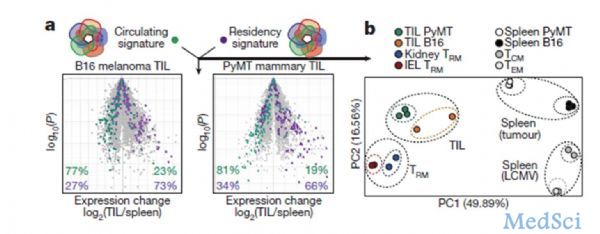
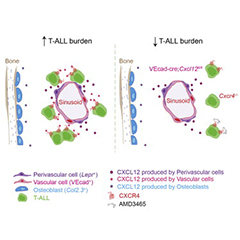
组织记忆性CD8+T(TRM)细胞通常存在于病原发生的部位,在这些部位他们精确、快速、高效的进行保护性免疫应答反应。
作者:MedSci
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言





#Nat#
36
#转录#
27
#D8+T#
38
#科学家发现#
0
#转录因子#
33