Circulation:射血分数保留型心衰的心肌基因表达特征!
2021-01-12 MedSci原创 MedSci原创
射血分数保留型心衰(HFpEF)占所有HF的一半,但仍缺乏有效的治疗方法。因缺乏心脏组织的分子分析,目前对心肌生物学的了解仍有限。
射血分数保留型心衰(HFpEF)占所有HF的一半,但仍缺乏有效的治疗方法。因缺乏心脏组织的分子分析,目前对心肌生物学的了解仍有限。
Hahn等收集了41例HFpEF患者、30例射血分数降低型心衰(HFrEF)患者和24例对照的右心室活检样本,予以RNA测序,分析了组间转录组差异、共患病的影响,以及通路富集的差异基因表达。
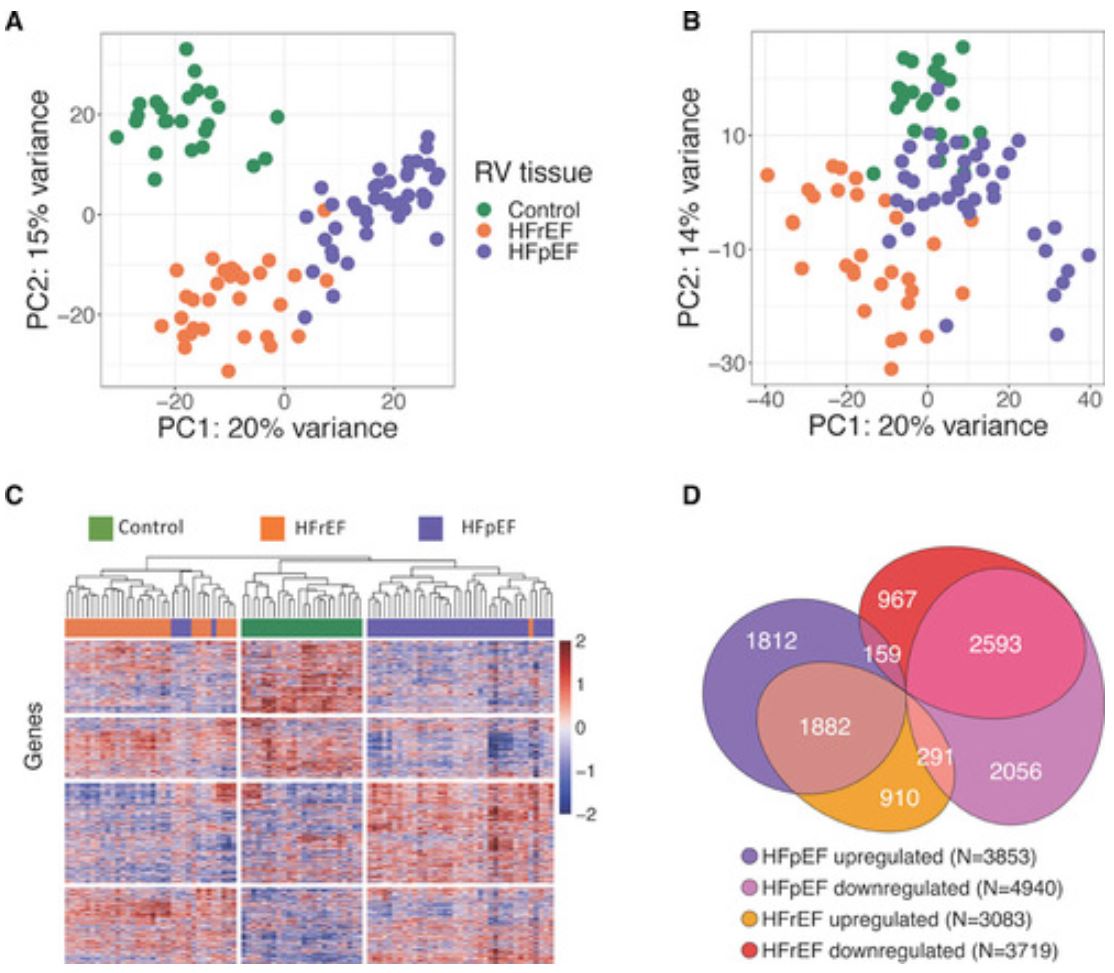
HFpEF患者多为女性(59%)、非裔美国人(68%)、肥胖个体(中位体重指数 41)和高血压(98%)、NYHA3级或4级(65%);HFpEF患者几乎都采用袢利尿剂治疗,70%的患者既往因心衰住过院。主成分分析可以最小的重叠将HFpEF与HFrEF和供体对照分开,且根据体重指数、性别、年龄、糖尿病或肾功能校正后这一情况仍持续存在。分层聚类确认了群分离。
HFpEF组和HFrEF组之间的转录差异
与供体对照相比,HFpEF组有近一半的基因发生了显著改变(1882个上调,2593个下调),这些基因在HFrEF组有相同的改变方向;然而,在HF组之间有5745个基因发生了独特的改变。
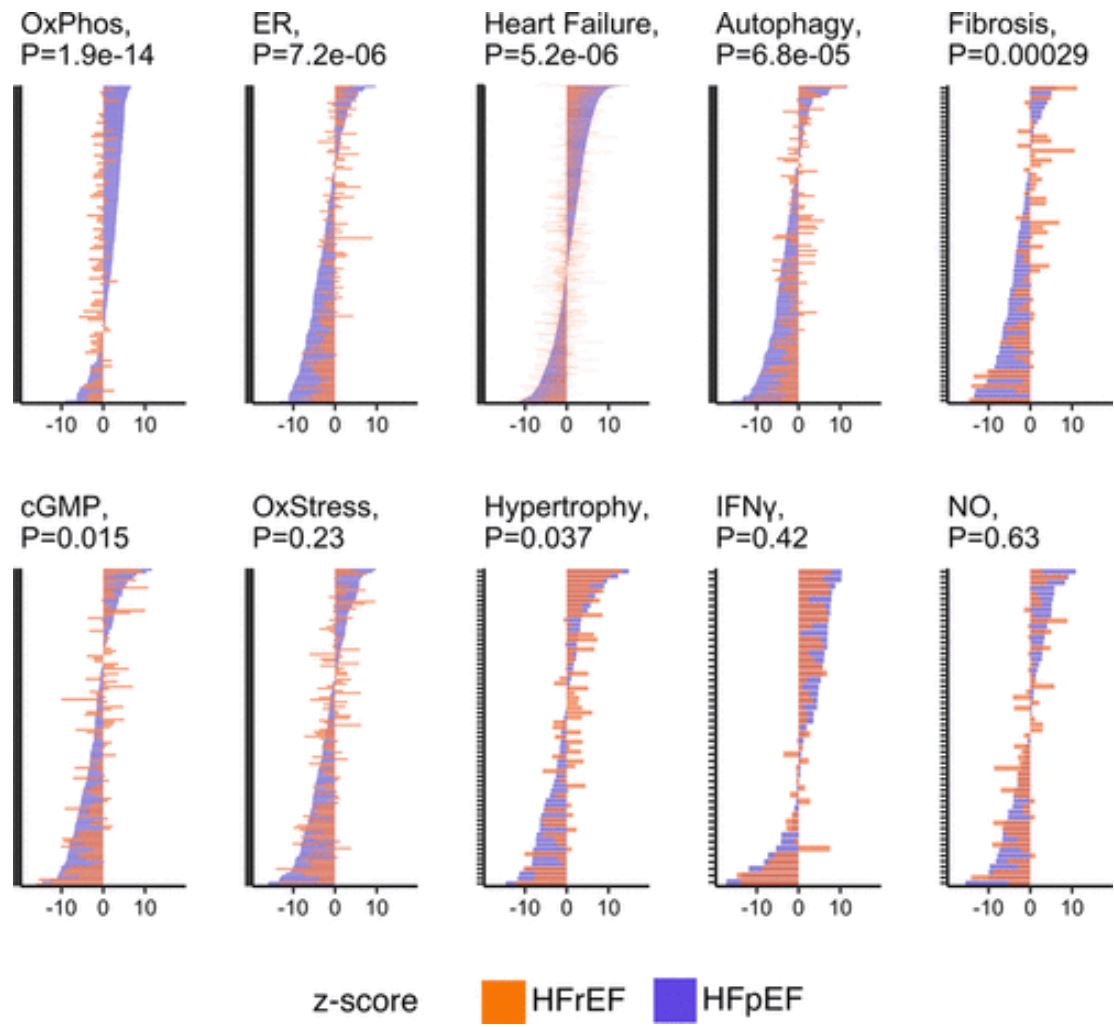
HFpEF组和HFrEF组在信号通路上的基因表达差异
与对照相比,HFpEF中特异性上调的基因富集于线粒体三磷酸腺苷合成/电子传递通路,该通路基因在HFrEF组中下调。HFpEF组特异性下调基因富集于内质网应激、自噬和血管生成。体重指数的差异在很大程度上解释了HFpEF组上调的基因,然而,无论是这种还是更广泛的共患病校正,都没有改变下调基因富集的通路。
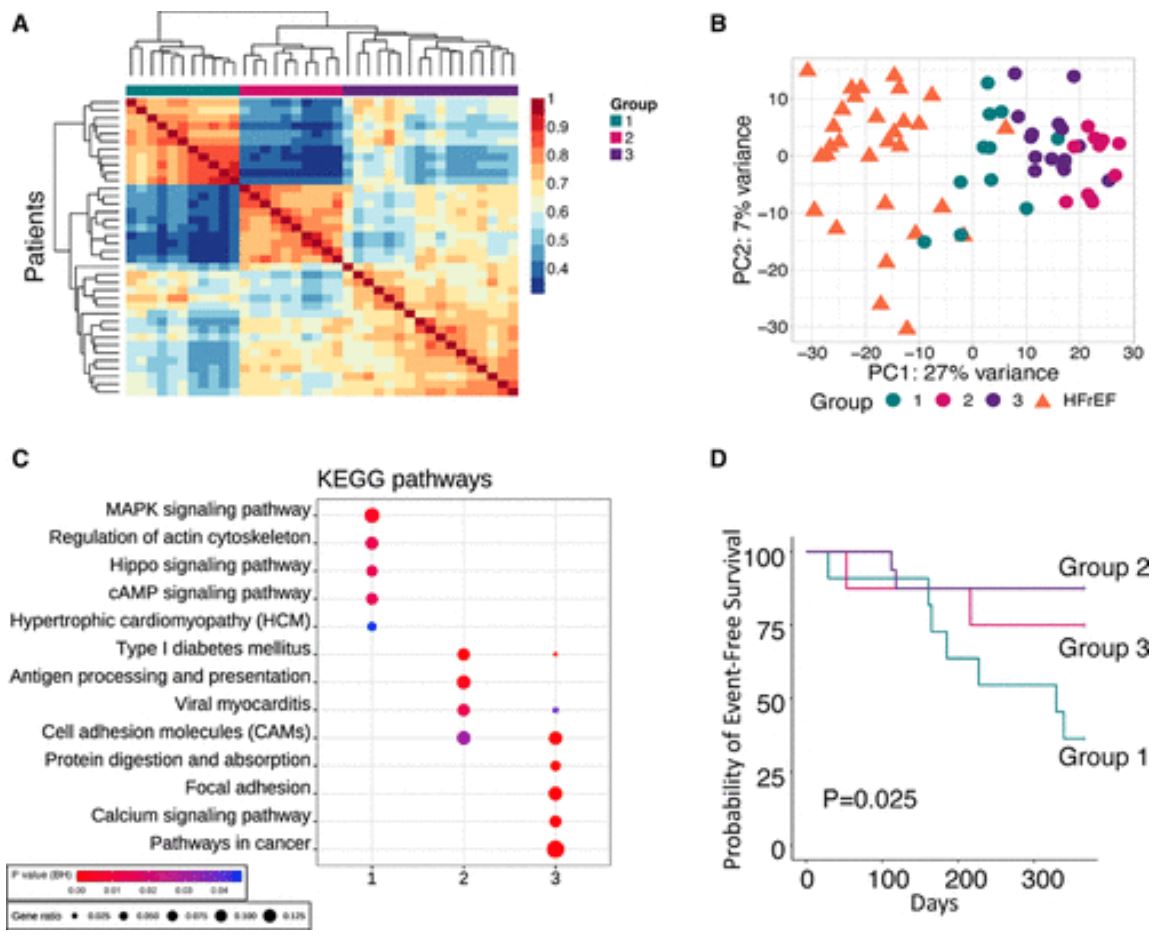
HFpEF转录组的3个亚群
非负矩阵因子分解鉴定出了3个HFpEF转录组亚群,它们具有独特的通路和临床相关性,包括与HFrEF高死亡率最相关的一组,以及一组以较小心脏女性为主的促炎症信号。
综上所述,HFpEF表现出具有特定临床特征和预后的独特的广泛转录组特征和分子亚群。该数据为精准治疗提供了新的信号靶点。
原始出处:
Virginia S. Hahn, et al. Myocardial Gene Expression Signatures in Human Heart Failure With Preserved Ejection Fraction. Circulation. 2021;143:120–134
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







学习了👍
99
#射血分数保留#
111
#射血分数保留型心衰#
105
#心衰#这个研究有价值,接下来还应该分析#蛋白质组学#差异
248
#基因表达#
104