Alzheimer's & Dementia:最新研究揭示DNA甲基化在阿尔茨海默症中的关键作用
2023-03-06 测序中国 测序中国
阿尔茨海默症(AD)是一种起病隐匿的进行性发展的神经退行性疾病,以渐进性记忆障碍、认知功能障碍、人格改变以及语言障碍等神经精神症状为主要特征。
阿尔茨海默症(AD)是一种起病隐匿的进行性发展的神经退行性疾病,以渐进性记忆障碍、认知功能障碍、人格改变以及语言障碍等神经精神症状为主要特征。AD的病理、生理机制复杂,发病机制目前仍不清楚,其病理特征是β-淀粉样(Aβ)斑块和神经原纤维缠结(NFT)。近年来,科研人员在探究AD神经病理学的分子机制、开发各种预防及检测Aβ斑块和NFT方法等方面取得了巨大进展,但典型AD的病因学,特别是晚发性AD(LOAD)至今仍然未阐明。
脑区域的脆弱性是AD神经病理发展的一个显著特征,其中,海马旁回(PHG)区域是最早受影响和最脆弱的大脑区域之一。最近研究表明,PHG(以及内嗅皮层(ER))是AD中表观基因组和转录组变化最大的区域,因此研究PHG的多组学有可能揭示AD的关键分子机制。
近日,美国西奈山伊坎医学院的研究团队在Alzheimer's & Dementia上发表了题为“Genome-wide methylomic regulation of multiscale gene networks in Alzheimer's disease”的文章。研究团队确定了270个与AD临床、病理特征以及全基因组基因表达变化相关的差异甲基化区域(DMR),并进一步定义了基因水平的总甲基化评分(OMS),以量化DMR对每个基因、每种蛋白质的影响。该研究为未来多维度数据集成提供了一个框架,并可能为AD 药物研发发现新靶点。

文章发表在Alzheimer's & Dementia
研究团队首先分析了与AD神经病理学相关的全基因组甲基化改变,对西奈山脑库(MSBB)队列中201例人死后对照组、轻度认知障碍(MCI)和AD大脑样本的PHG区域组织进行分析。经过严格的质量控制,196个PHG样本中有776,508个CpG位点被保留用于下游分析。
研究团队分析了甲基组学差异与斑块平均密度(PLQ_Mn)的关联,这是量化AD神经病理学的关键标准之一。在AD和健康正常对照(NL)大脑之间确定了13,755个差异甲基化位置(DMP),约70%的DMP位于基因组特征附近,表明其在转录中起潜在调节作用。值得注意的是,高甲基化DMP附近的基因在神经元和突触功能上富集,这些功能在AD中经常被下调;低甲基化DMP附近的基因则在免疫系统过程等途径富集,这些途径通常在AD中被激活。上述结果表明,AD患者甲基化水平的改变与功能相关。
为了解AD中甲基化CpG位点的空间组织,研究团队使用滑动窗口算法(comb-p)识别具有高度相关性的相邻CpG位点区域,并将DMR定义为一个基因组区域。结果显示,共发现270个明显的DMR,染色体1和11最多(27个DMR),染色体9和21最少(2个DMR);DMR平均甲基化水平与PLQ-Mn之间显著相关。
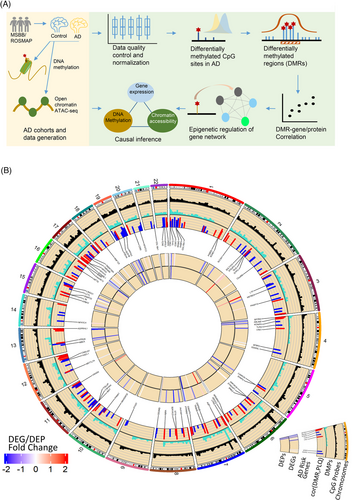
图1. AD相关DMR的研究设计和鉴定概述。
DNA甲基化是转录后调控基因表达的关键组成部分之一。研究团队探究了DMR作为一个整体对每个基因的mRNA或蛋白质表达变化的影响程度,使用方差分解分析量化了所有DMR对每个基因的贡献(图2)。结果显示,在23,201个mRNA的表达水平变化中,平均有34%与DMR有关。有趣的是,DMR对蛋白质表达变异的影响更大,可解释平均39%的蛋白质表达变异。
为总结受甲基化影响的基因,研究团队根据方差分解分析得出的甲基化贡献对基因进行排名,共鉴定了3,449个潜在的甲基化调节基因(MRG)和2,632个潜在的甲基化调节蛋白(MRP)。在1,345个常见基因中,有601个在AD与NL中发生了显著变化,其中多数(589个)在AD中表达变化的方向与NL相同,并参与了神经和突触以及免疫反应等功能途径和生物过程。
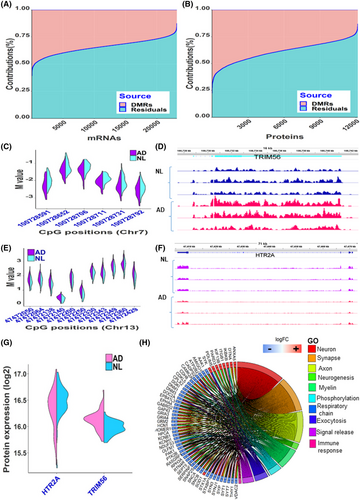
图2. 甲基化对基因表达的贡献。
由于DMR和基因表达特征之间、不同DMR之间存在复杂的相互作用,研究团队开发了一种新的统计方法“OMS”来量化对基因和蛋白质表达的净甲基化效应。阴性OMS(OMS[−])表示由甲基化引起的基因表达降低的净效应,阳性OMS(OMS[+])表示由甲基化引起的基因表达增加的净效应;OMS(0)表示没有甲基化影响;一个模块的OMS是该模块中所有基因的mRNA-OMS的总和。
研究团队计算了基因和基因模块水平的OMS,并评估了基因模块OMS、模块相关性评分(RS)与AD之间的相关性,使用mRNA-OMS和蛋白质-OMS表示甲基化在mRNA和蛋白质水平上对基因表达的总体影响。结果显示,模块RS与模块mRNA-OMS(−)以及模块RS与模块mRNA-OMS(+)之间存在显著相关性,表明甲基化在调节AD神经病理学基础基因共表达模块方面起着至关重要的作用。
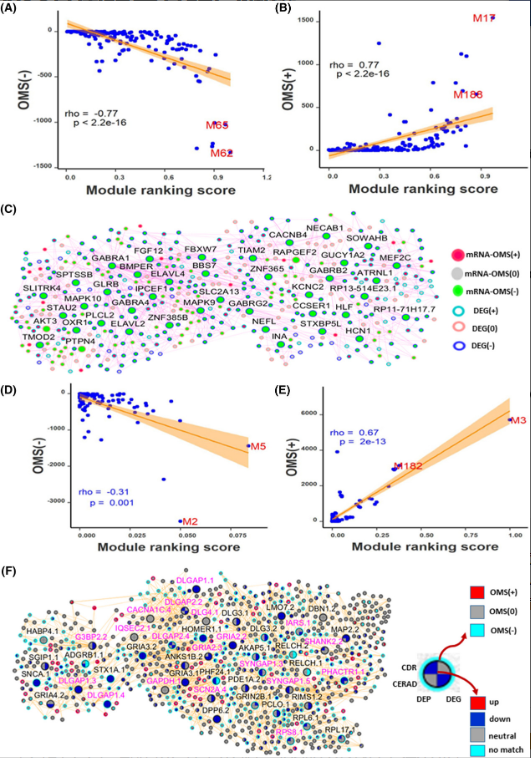
图3. 对MSBB PHG队列MEGENA共表达网络的基因模块的总体甲基化影响。
此外,研究团队分析了基因网络关键驱动因子(KD)的表观遗传调控,对先前预测的PHG区域贝叶斯因果基因网络中的关键驱动基因(KDG)进行排名。结果显示,1454个KDG中有774个与DMR相关,其中517个为mRNA-OMS(-),257个为mRNA-OMS(+)。当分为阳性和阴性组时,KDG评分与其mRNA-OMS显著相关。进一步,研究团队检测了KDG下游基因的甲基化水平,发现KDG评分与下游基因的mRNA-OMS相关。上述结果表明了甲基化在调节初级网络KD及其下游基因中的深远作用。
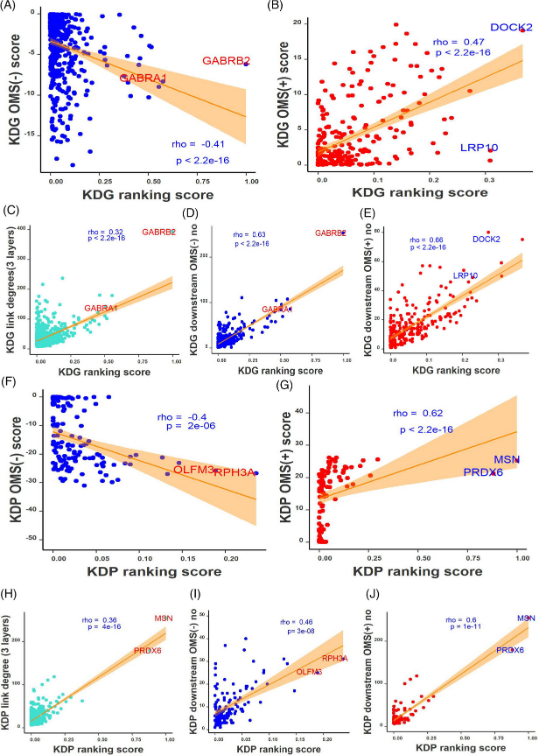
图4. OMS与MSBB队列中PHG区域贝叶斯因果网络中KD的关系。
最后,研究团队使用两种方法(方差分解和直接相关)评估了甲基化对基因表达的影响,观察到两种方法获得的基因表达特征有显著的重叠(图3)。例如,在MSBB队列中,通过方差分解分析得到的约50%mRNA特征和超60%的蛋白质特征出现在直接相关分析的基因列表中,独立验证队列ROSMAP中同样观察到类似的结果。这些方法相互协作证明了DNA甲基化对人类大脑中大量基因的表达具有调节作用。
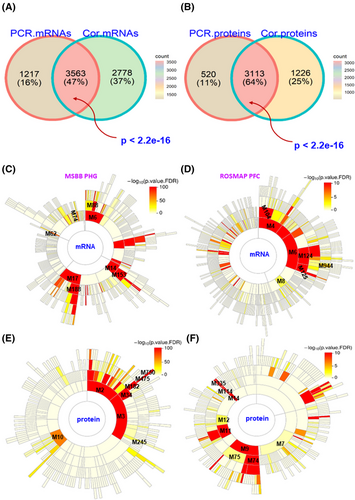
图5. 整合甲基组对基因表达的影响。
综上所述,研究团队首先证明了AD相关的DNA甲基化水平变化的存在,从而进一步鉴定了DMR,揭示了与AD神经病理学相关的甲基组学变化,并开发了一种新的指标OMS,以量化甲基化对每个基因和每种蛋白质的影响。该研究为分析DNA甲基化与基因/蛋白质表达之间的关系提供了一种新方法,并强调了表观遗传机制在AD等人类疾病中的重要性。
作者:测序中国
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言