Nature Biomedical Engineering:靶向线粒体自噬,清除大脑“垃圾”,治疗阿尔茨海默病
2022-01-09 小柯生命 小柯生命
随着全球老龄化加深,阿尔茨海默病经济负担持续增加,2020年已达3050亿美元。目前65岁以上老年人中约11%患有阿尔兹海默症,85岁以上的老年人患病比例高达到42%
随着全球老龄化加深,阿尔茨海默病经济负担持续增加,2020年已达3050亿美元。目前65岁以上老年人中约11%患有阿尔兹海默症,85岁以上的老年人患病比例高达到42%。淀粉样蛋白(Aβ)和微管相关蛋白(Tau)的积累被认为是阿尔兹海默症的主要病理机制,但是针对该机制的药物开发确困难重重。目前阿尔兹海默症研究急需发现新的治疗机制。
2022年1月6日,挪威奥斯陆大学方飞(Evandro Fei Fang)课题组与澳门大学路嘉宏课题组合作,在 Nature 子刊 Nature Biomedical Engineering 上发表了题为:Amelioration of Alzheimer’s disease pathology by mitophagy inducers identified via machine learning and a cross-species workflow 的研究论文。
该研究通过基于机器学习筛选海量小分子,发现2个先导小分子化合物(lead compounds)具有治疗阿尔茨海默病潜力。

温州医科大学第一附属医院谢成龙、澳门大学庄旭旭、德睿智药牛张明、挪威奥斯陆大学艾瑞雪为本文共同第一作者,挪威奥斯陆大学方飞与澳门大学路嘉宏为共同通讯作者。
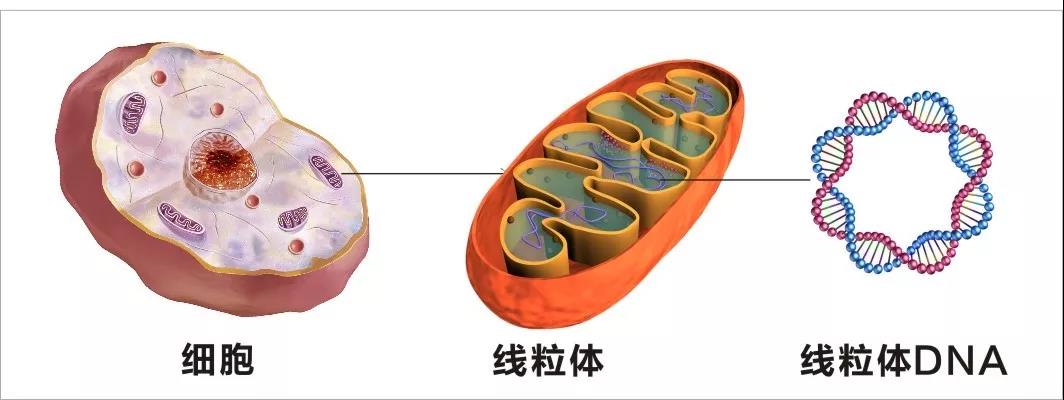
方飞课题组于2019年在 Nature Neuroscience 上发表论文证明线粒体清除机制受损在阿尔茨海默病发病过程中扮演关键角色。线粒体自噬(Mitophagy)是细胞进化过程中产生的一种通过自噬选择性清除受损线粒体的机制;及时清除损伤的线粒体对维持细胞正常生理功能具有重要作用。阿尔茨海默病患者的神经元中, 当β-淀粉样蛋白1-42寡聚体和微管相关蛋白积累时, 线粒体发生损伤,轻微损伤的线粒体通过分裂融合, 保证部分子代线粒体内部环境的稳定;严重损伤的线粒体则通过被自噬体包被, 以选择性线粒体自噬方式予以清除。当此功能受阻时, 神经元中出现显着的线粒体运输、动力学异常等功能障碍, 导致阿尔茨海默病病理改变加重。因此,增强线粒体自噬可以抑制β-淀粉样蛋白1-42寡聚体和微管相关蛋白聚集,并逆转阿尔茨海默病模型中的认知缺陷。对线粒体自噬的调控可能为阿尔茨海默病的治疗提供新方法。但是目前线粒体自噬激活剂稀少,尤其缺少安全的线粒体自噬激活剂:本身不造成健康线粒体损伤。因此,需要更高效的激动剂发现方案。
现代药物研发耗资巨大,包括化合物的生物活性筛选环节。发现先导化合物后,科学家依据经验进行药物设计及化合物合成,分子生物学家测试化合物活性,反复优化和筛选,最终发现临床候选化合物,这一过程往往需要10-20年。然而仅有12%可以最终得到FDA认证。如今随着各种相关数据的积累,通过人工智能技术(artificial intelligence, AI)进行药物的虚拟筛选有望代替传统的活性筛选方法,不仅可以加速中间步骤,而且大幅度降低研发成本,同时提高药物筛选精确性。
方飞团队及其合作方致力于前期应用AI高效低成本筛选,后期进行传统湿实验室验证(细胞,线虫和小鼠)提高筛药准确性,两部分的结合可以加速药物的研发,这种设计思路不仅可以应用在阿尔茨海默病中,还可以应用在各种医学领域等,为其他课题组提供了更多的启发。
该研究中,一种新的AI技术建立并应用药物筛选:基于机器学习每个分子的一维,二维与三维信息进行了表征学习。预训练的数据来自ChEMBL和ZINC的共一千九百万小分子数据。预训练表征模型综合考虑了分子的各个维度的信息,其中包括了一维的序列信息(SMILES),二维的分子拓扑相似性和三维的空间信息等。基于预训练模型所获得向量,天然小分子结构多样性大,是药物发现的良好来源。澳门大学路嘉宏课题组长期聚焦于中药来源的天然小分子自噬调控剂的发现和药理活性研究,建立了包含生物碱,黄酮,萜类等多类型化合物的天然小分子的化合物库。
该研究团队对澳门大学天然小分子数据库中共3724个天然小分子进行了聚类与过滤。共18个天然小分子进入湿实验室验证阶段。该研究使用人类HeLa细胞模型,线虫以及小鼠动物模型验证这些小分子化合物的自噬诱导能力。研究人员最后获得2个先导小分子化合物山奈酚和丹叶大黄素:能够在人体细胞,线虫,和小鼠神经系统中诱导显着自噬。此外,研究人员发现山奈酚和丹叶大黄素对阿尔茨海默病小鼠神经退行性改变有非常显着改善作用,包括抑制阿尔茨海默病病理学病症(细胞外β-淀粉样沉积物,细胞内Aβ1-42,以及微管相关蛋白的聚集)和增强学习记忆能力。

该研究获得国际同行正面评价。国际阿尔茨海默病研究权威、美国麻省理工学院大脑与认知科学系教授蔡立慧(Li-Huei Tsai, MIT)指出:“此研究使用前沿的机器学习算法成功发现新神经元线粒体自噬诱导剂,应用计算机筛选候选药物,再使用细胞、秀丽隐杆线虫和表达人类 P301L Tau 蛋白的小鼠模型的多个系统中验证,最终发现2种小分子化合物山奈酚和丹叶大黄素。值得注意的是,这些线粒体自噬诱导剂能有效改善神经元功能,减少了阿尔茨海默病相关病理变化,并在动物模型中增强了学习记忆能力。因此,该研究通过计算机药物筛选,并通过多系统验证,从而确定了有效的线粒体自噬诱导剂。此外,他们的研究说明了线粒体自噬在神经元的保护作用和改善记忆功能方面的治疗价值。’’
挪威科技大学(NTNU)国际脑科学研究权威 Menno Witter 教授认为,“这是一篇令人印象深刻的多学科论文,方飞团队非常有说服力地展示了筛选治疗神经退行性疾病药物的新方法。此方法基于人工智能初步筛选候选化合物,化合物能在细胞和动物模型中,诱导受损线粒体的清除。众所周知,线粒体自噬功能异常与衰老关系密切。此项研究中,作者最终发现2种化合物可以诱导线粒体自噬,并改善动物模型的记忆功能。尽管,还需要对药物特异性进行进一步的研究,但现有成果提供了一个非常有前景的针对神经退行性变和衰老的治疗途径。’’
总之,该研究建立了一种基于AI融合多维分子信息的虚拟筛选算法,成功筛选出多个自噬诱导剂结合生物学实验验证提高了AI筛选治疗阿尔兹海默症的准确性。该研究一步证实增强自噬机制在阿尔茨海默病治疗中的潜力,同时为快速开发阿尔茨海默病药物提出了一种基于AI的可行方案。
原始出处:
Xie, C., Zhuang, XX., Niu, Z. et al. Amelioration of Alzheimer’s disease pathology by mitophagy inducers identified via machine learning and a cross-species workflow. Nat Biomed Eng (2022). https://doi.org/10.1038/s41551-021-00819-5.
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#Nat#
128
#Engin#
134
#Bio#
85
#DIC#
0
#线粒体自噬#
149