Haematologica:郝牧/邱录贵团队揭示抗骨髓瘤细胞免疫治疗新靶点LILRB4及作用机制
2024-06-04 聊聊血液 聊聊血液
该研究首次创新性地提出靶向LILRB4可以实现同时靶向肿瘤细胞和免疫抑制微环境,是理想的MM治疗策略。
LILRB4转化医学研究
多发性骨髓瘤(MM)是严重威胁中老年人群健康的发病率第二位的血液肿瘤。近二十年来,蛋白酶体抑制剂(PIs)、免疫调节剂(IMiDs)、CD38单抗等新药和自体造血干细胞移植(ASCT)的广泛应用,使得MM从一个中位总生存仅2~3年的致死性肿瘤逐渐演变成中位总生存达8~10年的可控性惰性疾病[1, 2]。尽管免疫靶向治疗显著提高了MM患者疗效,但治疗后复发仍然难以避免,并且部分患者疾病进展迅速,治疗疗效差,总生存时间短于两年,被定义为超高危患者[3, 4]。因此,解析MM患者疾病进展的原因、早期发现预后差的超高危患者、并寻找新的细胞免疫治疗靶点对于提高MM患者疗效具有重要意义。
近日,中国医学科学院血液病医院(中国医学科学院血液学研究所)郝牧研究员/邱录贵教授团队在血液学权威期刊《Haematologica》发表了题为“LILRB4 represents a promising target for immunotherapy by dual targeting tumor cells and myeloid-derived suppressive cells in multiple myeloma”的文章。该研究首次创新性地提出靶向LILRB4可以实现同时靶向肿瘤细胞和免疫抑制微环境,是理想的MM治疗策略。

研究结果
该研究首先通过单细胞转录组测序分析发现总生存期短于24个月的超高危MM患者骨髓中显著富集一群高表达LILRB4的高侵袭性MM细胞C4亚群,高表达MM相关的增殖和耐药基因,具有复杂的染色体异常改变和高突变负荷,具有骨髓瘤起始肿瘤细胞亚群的特征。C4肿瘤细胞亚群比例高的MM患者相较于低比例的患者,其生存期显著缩短。基因特征分析显示髓系免疫检测点分子LILRB4是C4肿瘤细胞亚群特征性基因。对初诊MM患者骨髓样本流式细胞术检测,结果表明LILRB4在未成熟浆细胞和MM细胞上的表达水平均显著高于正常浆细胞,并且发现MM骨髓微环境中MDSCs也表达高水平的LILRB4。功能学实验表明过表达LILRB4可促进MM细胞的增殖、克隆形成、增加肿瘤侵袭能力,降低MM细胞对蛋白酶体抑制剂的敏感性。另一方面,LILRB4高表达MM细胞可诱导MM微环境中髓系免疫抑制细胞MDSCs的生成、抑制T细胞抗肿瘤活性,共同促进了MM免疫抑制微环境的形成;同时骨髓微环境细胞与MM细胞的共培养又可进一步上调MM细胞LILRB4的表达,加剧微环境的免疫抑制程度。研究进一步设计构建靶向LILRB4的STAR(Synthetic T cell receptor and antigen receptor,嵌合T细胞受体和抗原受体)-T细胞[5],验证LILRB4靶点在MM细胞免疫治疗中的有效性。体内和体外实验研究结果显示:靶向LILRB4 STAR-T细胞治疗对MM细胞系、患者原代肿瘤细胞和微环境中MDSCs细胞均显示出特异性杀伤效果。
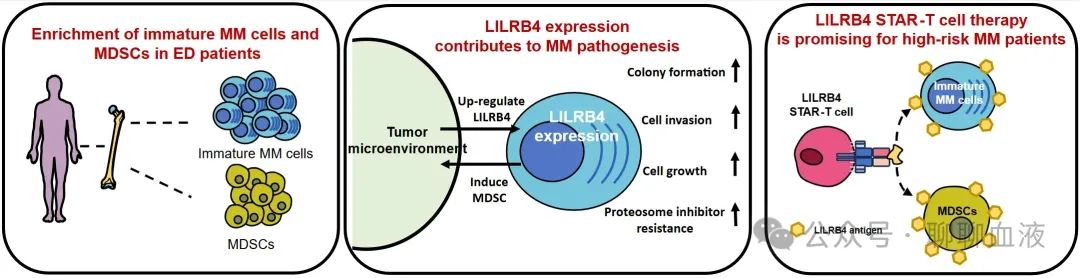
综上,本研究结果表明髓系免疫检测点分子LILRB4高表达于MM细胞侵袭性肿瘤亚群,通过直接促进肿瘤细胞生长,抑制T细胞抗肿瘤活性等共同介导MM的发生和发展。该研究首次创新性地提出靶向LILRB4可以实现同时靶向肿瘤细胞和免疫抑制微环境,是理想的MM治疗策略。
中国医学科学院血液病医院(中国医学科学院血液学研究所)郝牧研究员、邱录贵主任医师和清华大学医学院林欣教授为本文共同通讯作者。中国医学科学院血液病医院(中国医学科学院血液学研究所)博士研究生龚莉欣和博士研究生孙浩为共同第一作者。该研究受到国家自然科学基金重点项目和中国医学科学院医学与健康科技创新工程项目的支持。
参考文献:
[1] COWAN A J, GREEN D J, KWOK M, et al. Diagnosis and Management of Multiple Myeloma: A Review [J]. Jama, 2022, 327(5): 464-77.
[2] BAZARBACHI A H, AL HAMED R, MALARD F, et al. Relapsed refractory multiple myeloma: a comprehensive overview [J]. Leukemia, 2019, 33(10): 2343-57.
[3] SONNEVELD P, AVET-LOISEAU H, LONIAL S, et al. Treatment of multiple myelomawith high-risk cytogenetics: a consensus of the International Myeloma Working Group [J]. Blood, 2016, 127(24): 2955-62.
[4] RÍOS-TAMAYO R, SÁINZ J, MARTÍNEZ-LÓPEZ J, et al. Early mortality in multiple myeloma: the time-dependent impact of comorbidity: A population-based study in 621 real-life patients [J]. American journal of hematology, 2016, 91(7): 700-4.
[5] LIU Y, LIU G, WANG J, et al. Chimeric STAR receptors using TCR machinery mediate robust responses against solid tumors [J]. Science translational medicine, 2021, 13(586).
作者:聊聊血液
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#多发性骨髓瘤# #免疫治疗# #LILRB4#
10