J Exp Med:线粒体是肺动脉高压血管生成模式的主要决定因素
2024-09-28 刘少飞 MedSci原创
当前重点在于评估这些变化,以阐明PAH在年轻动物中的存在及其成年后的发展。此外,跟踪年龄相关的肺形态变化将有助于揭示肺血管生成逐渐受损与PAH表型严重程度之间的紧密关联。

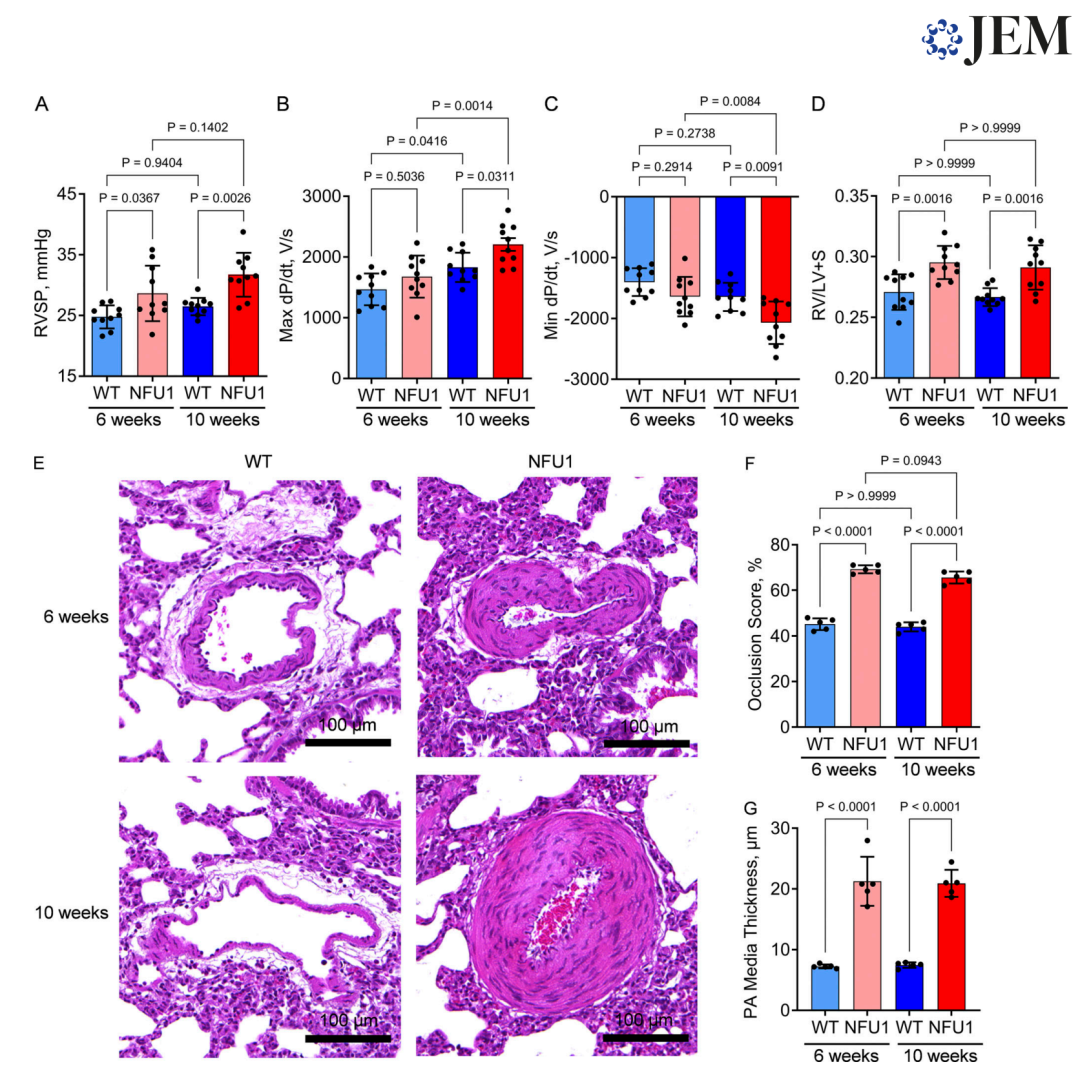
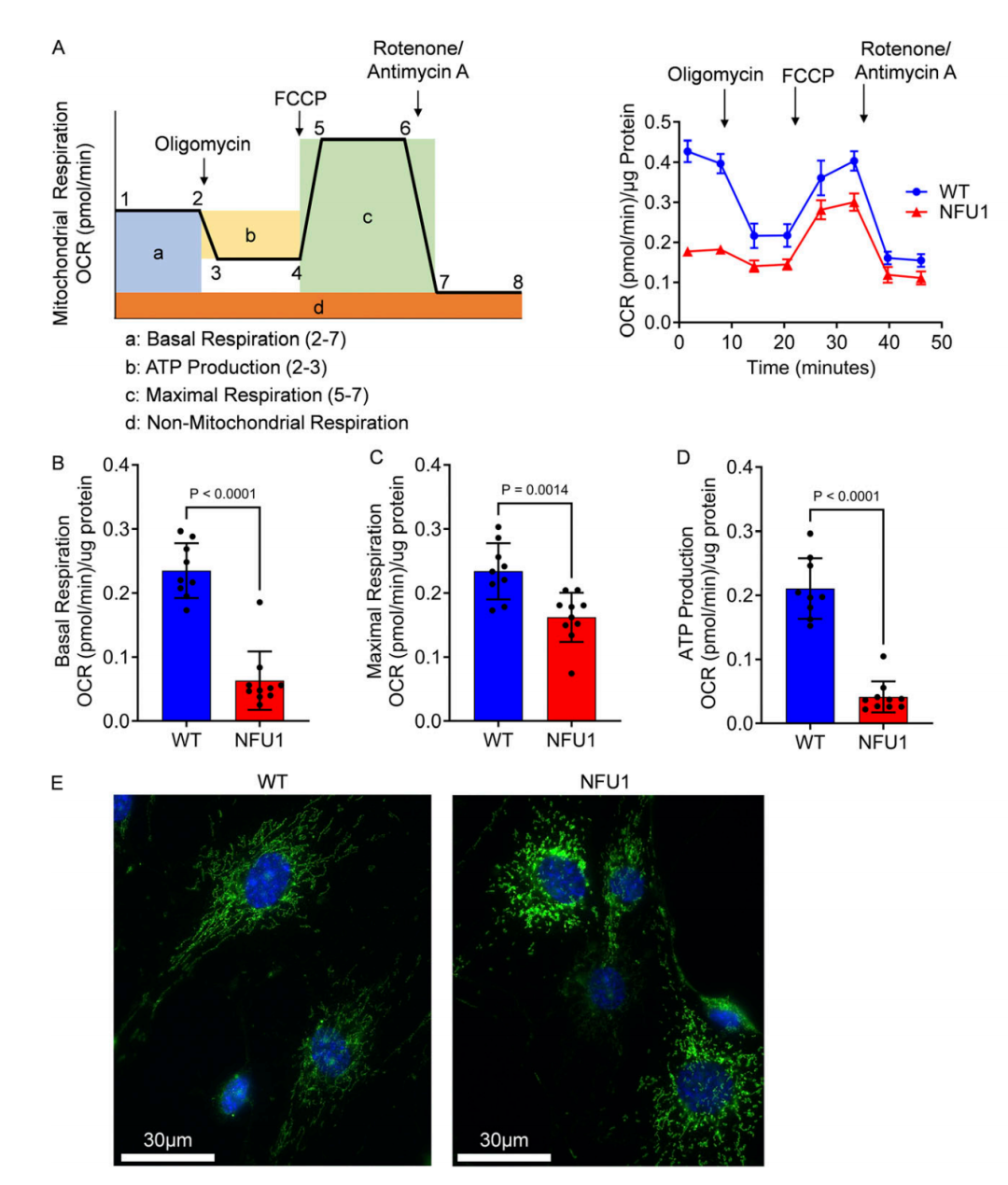
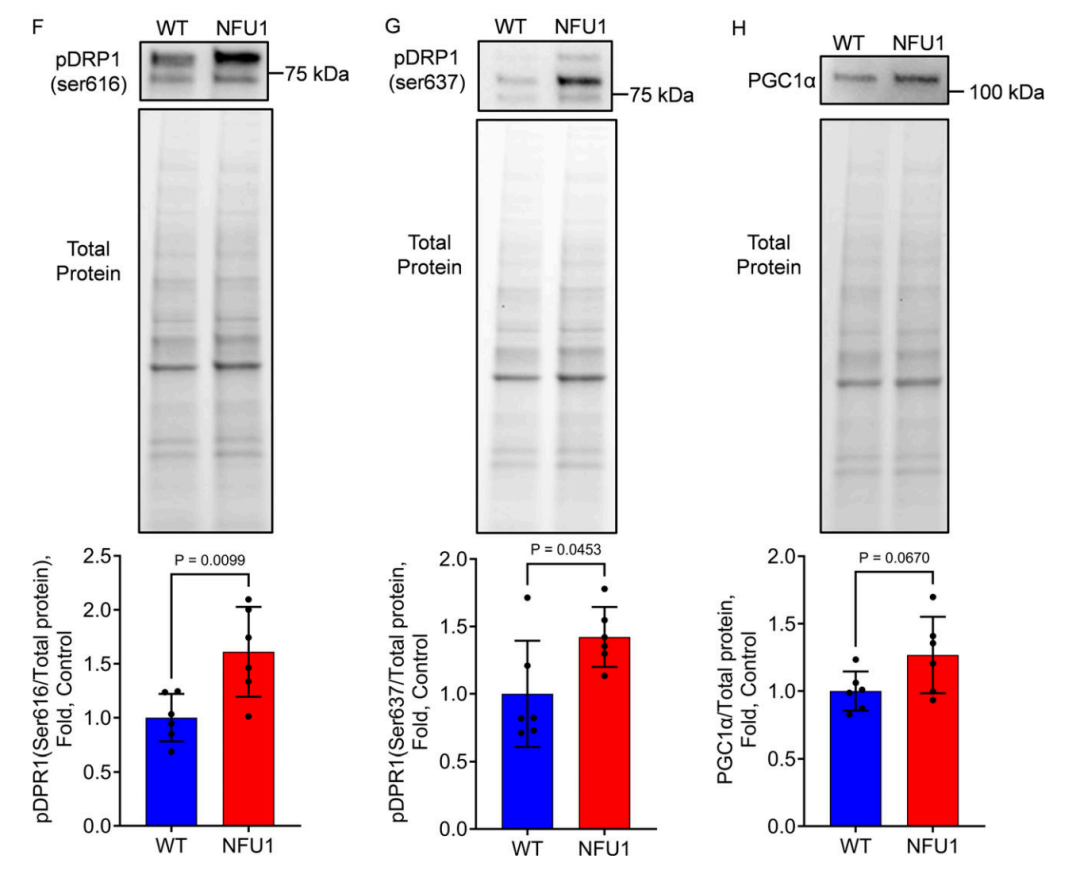
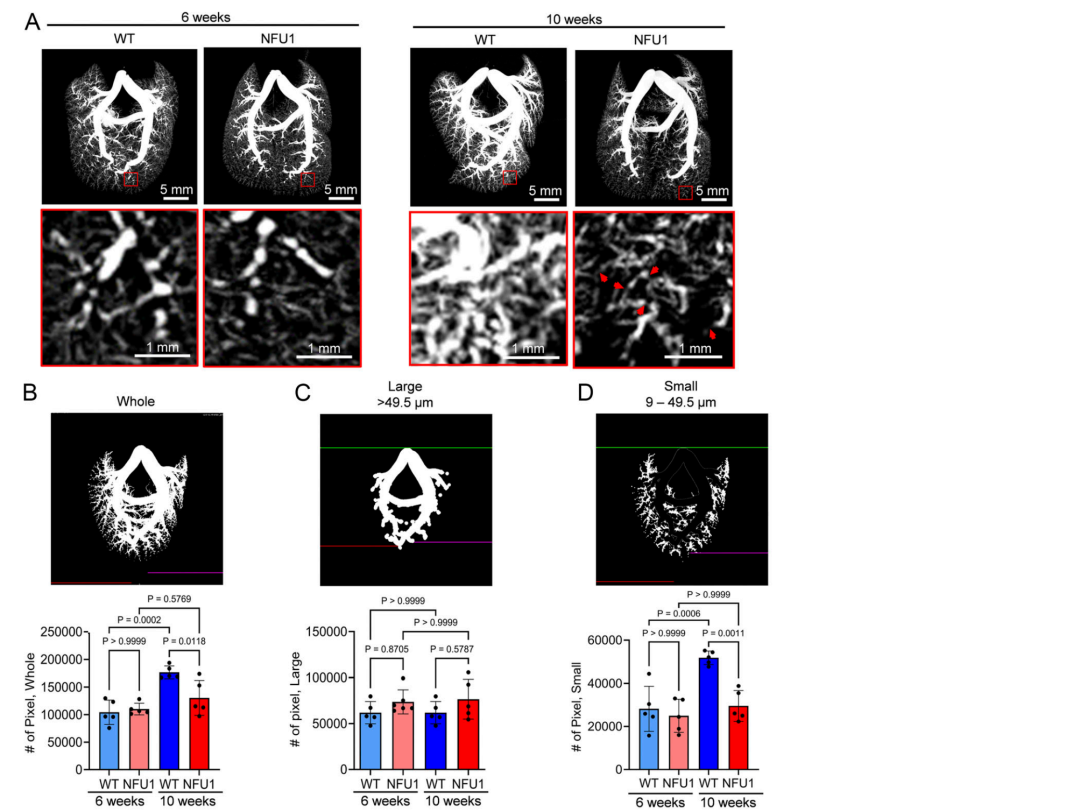
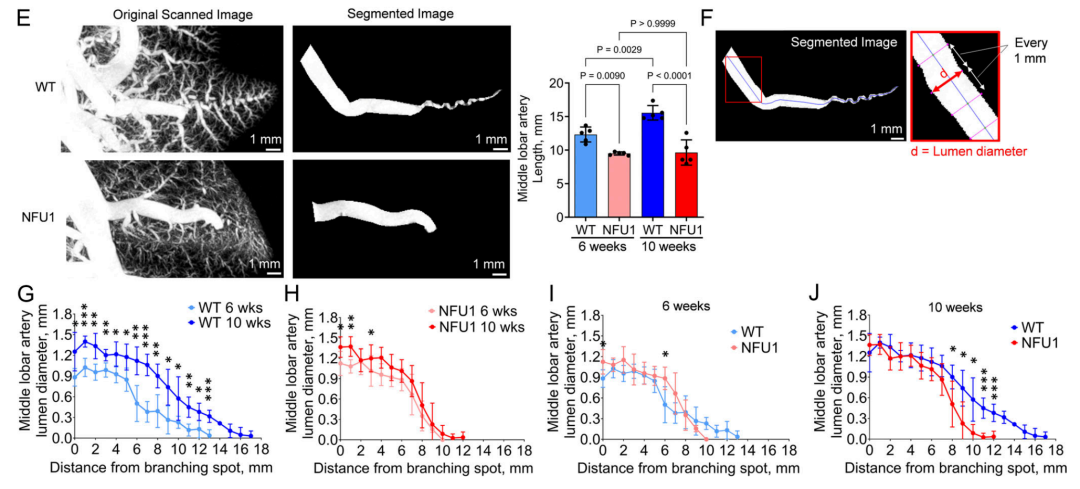
图3.NFU1G206C大鼠肺血管树形态缺陷。
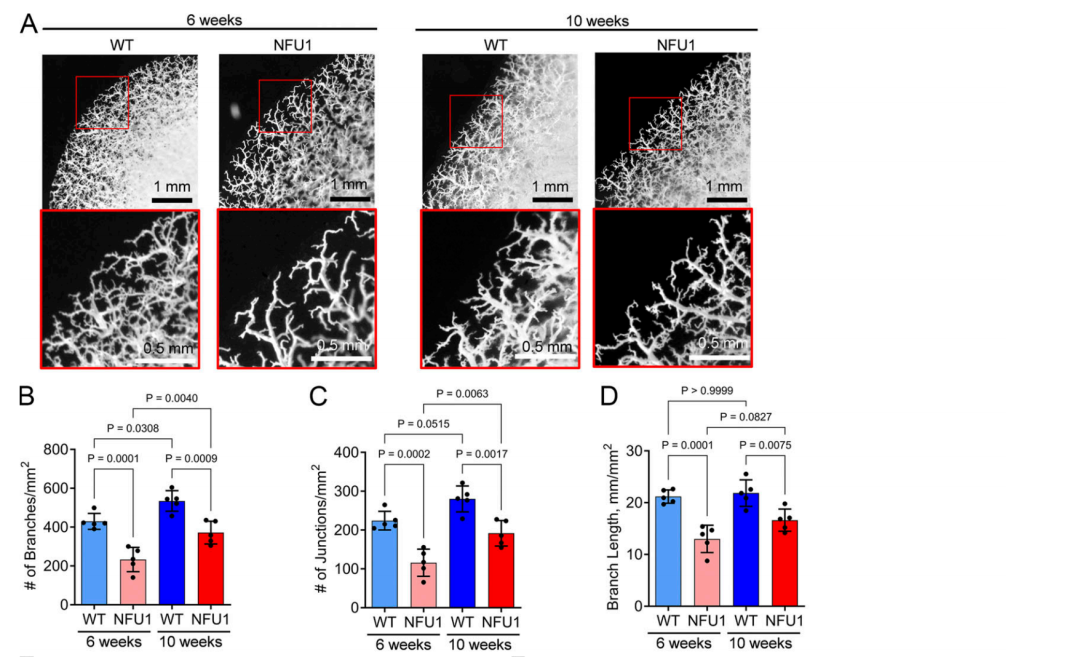
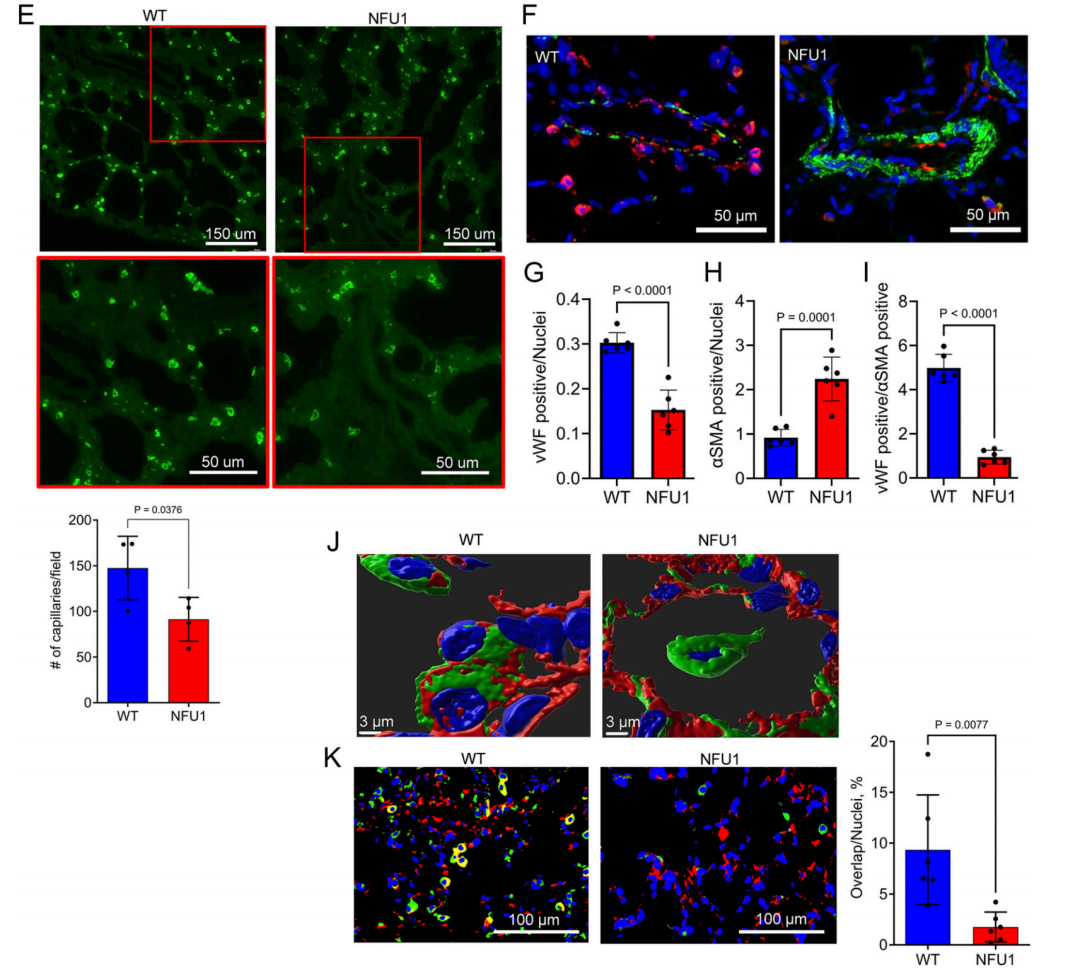
图4.NFU1G206C 基因型会损害肺微血管密度和体内平衡。
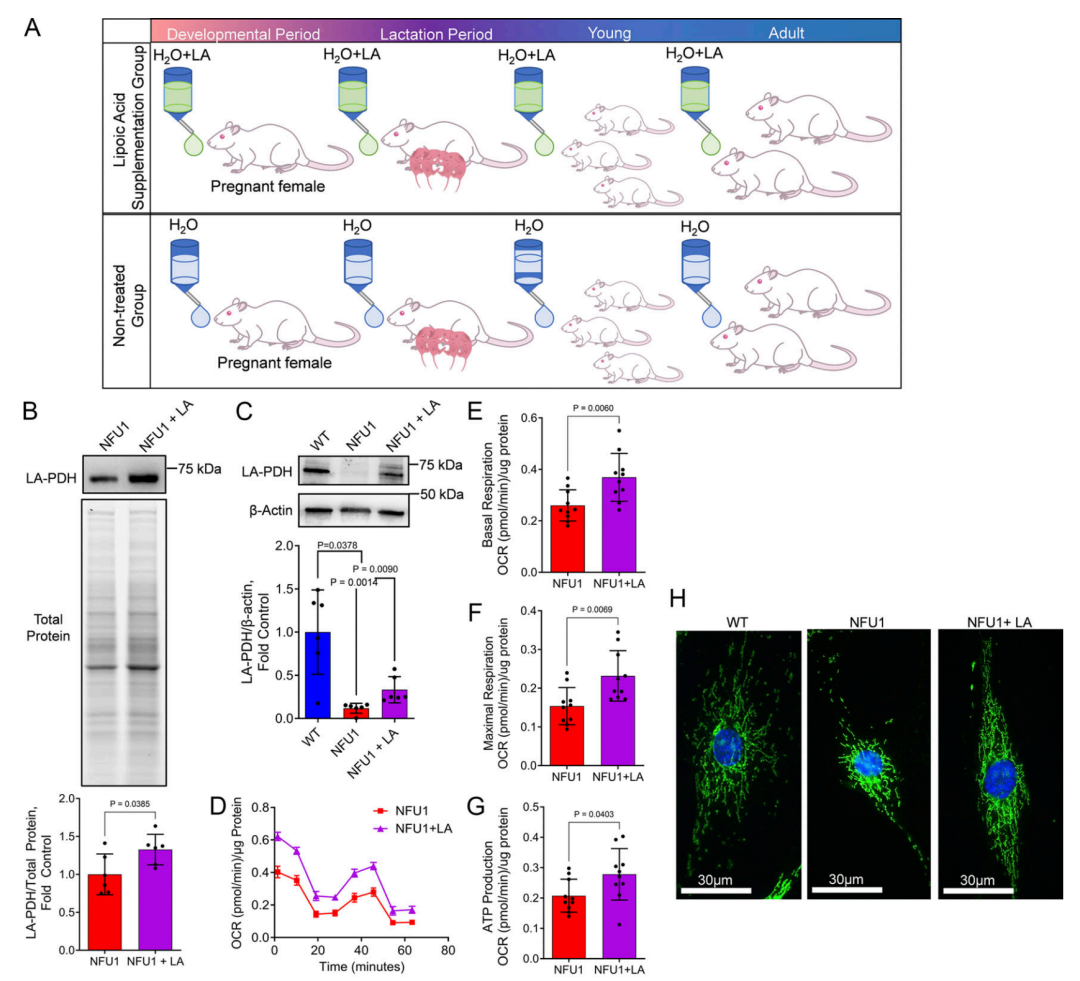
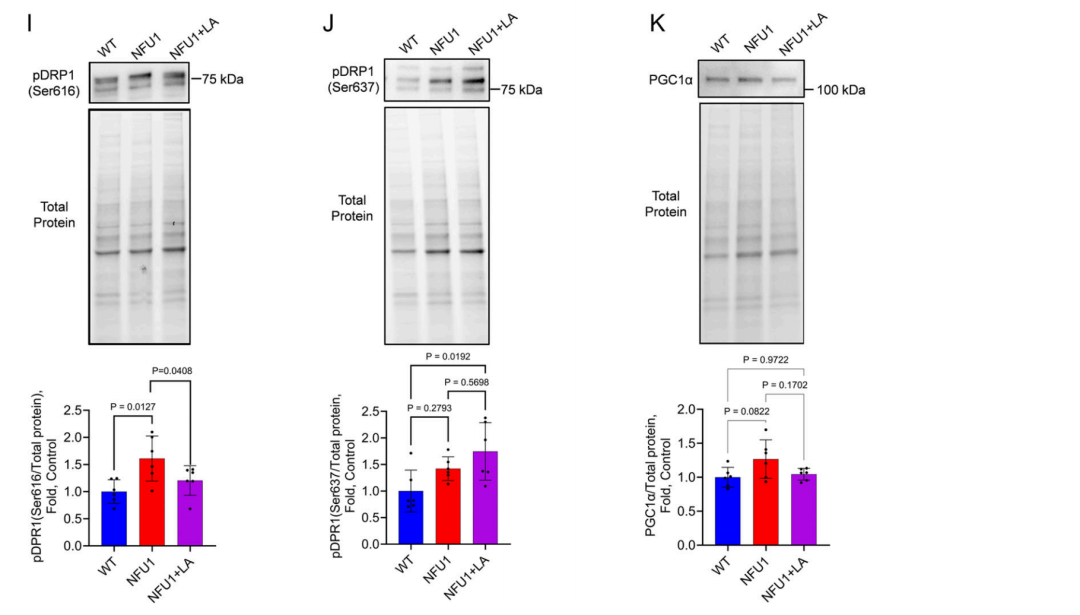
图 5. 长期补充 LA 可恢复 NFU1G206C PEC 中的线粒体功能。
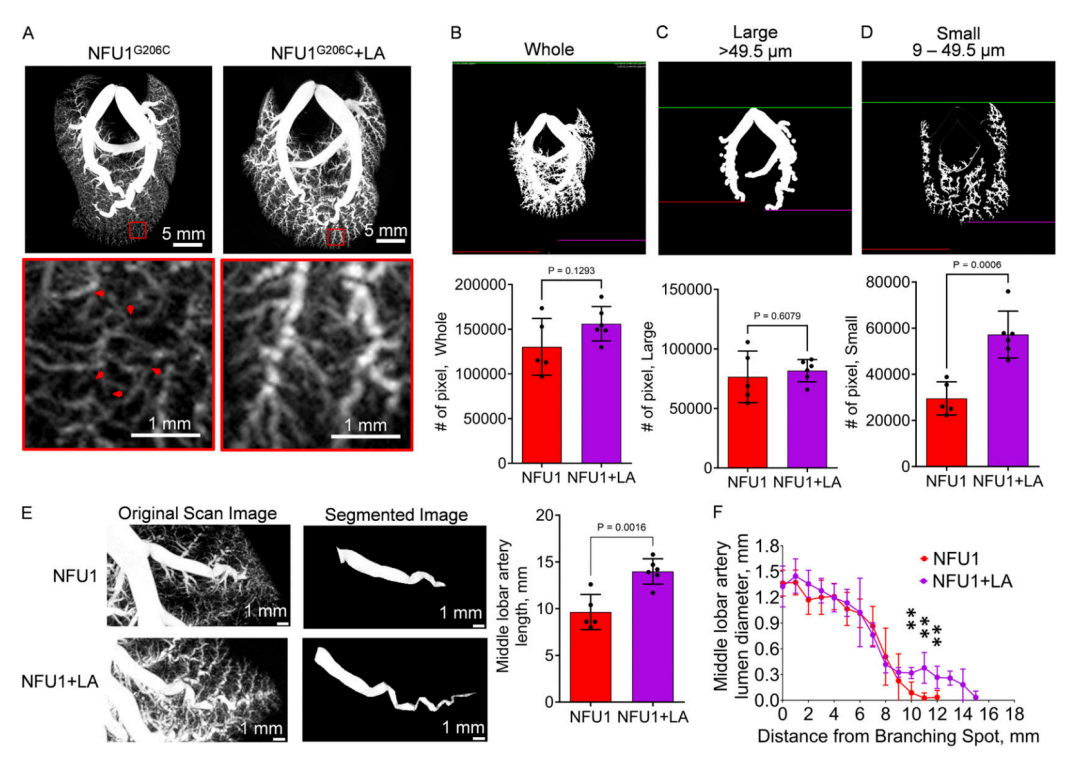
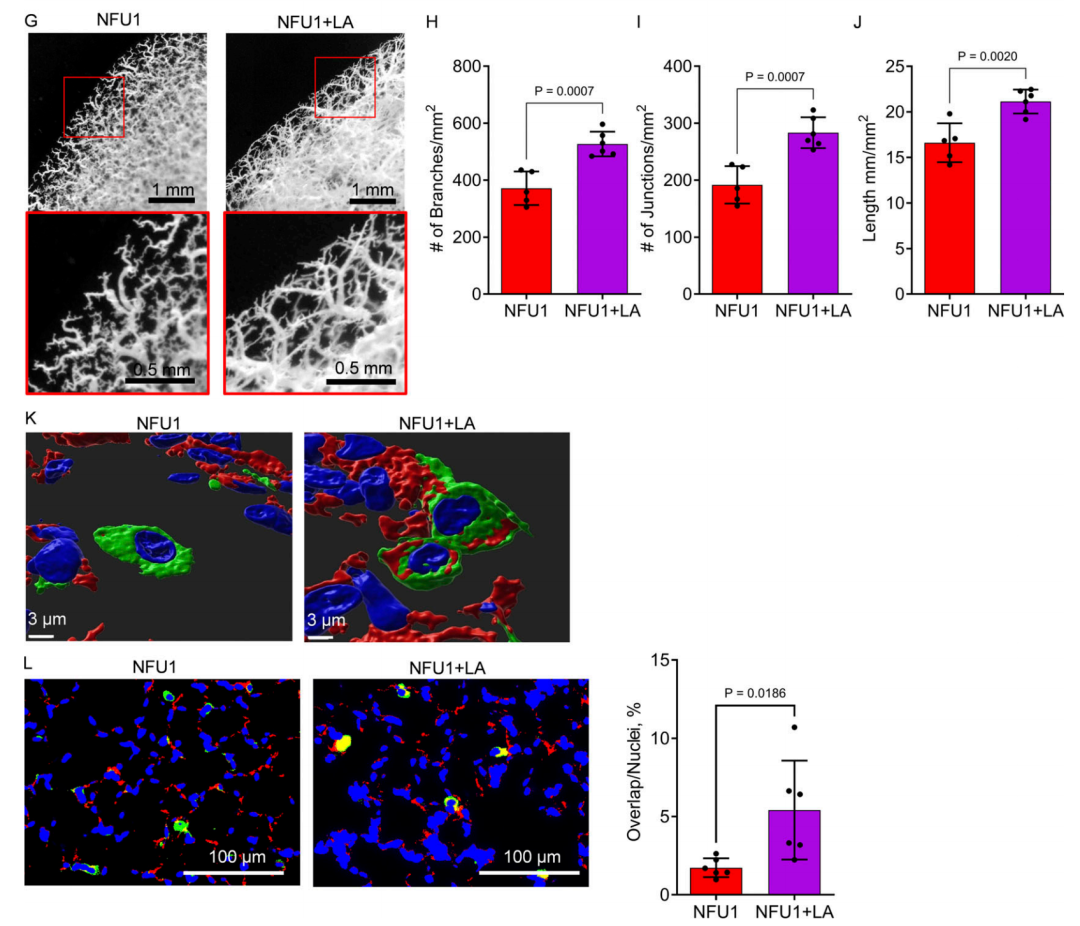
图 6. 提高 LA 生物利用度足以预防 NFU1G206C 大鼠的血管生成缺陷。
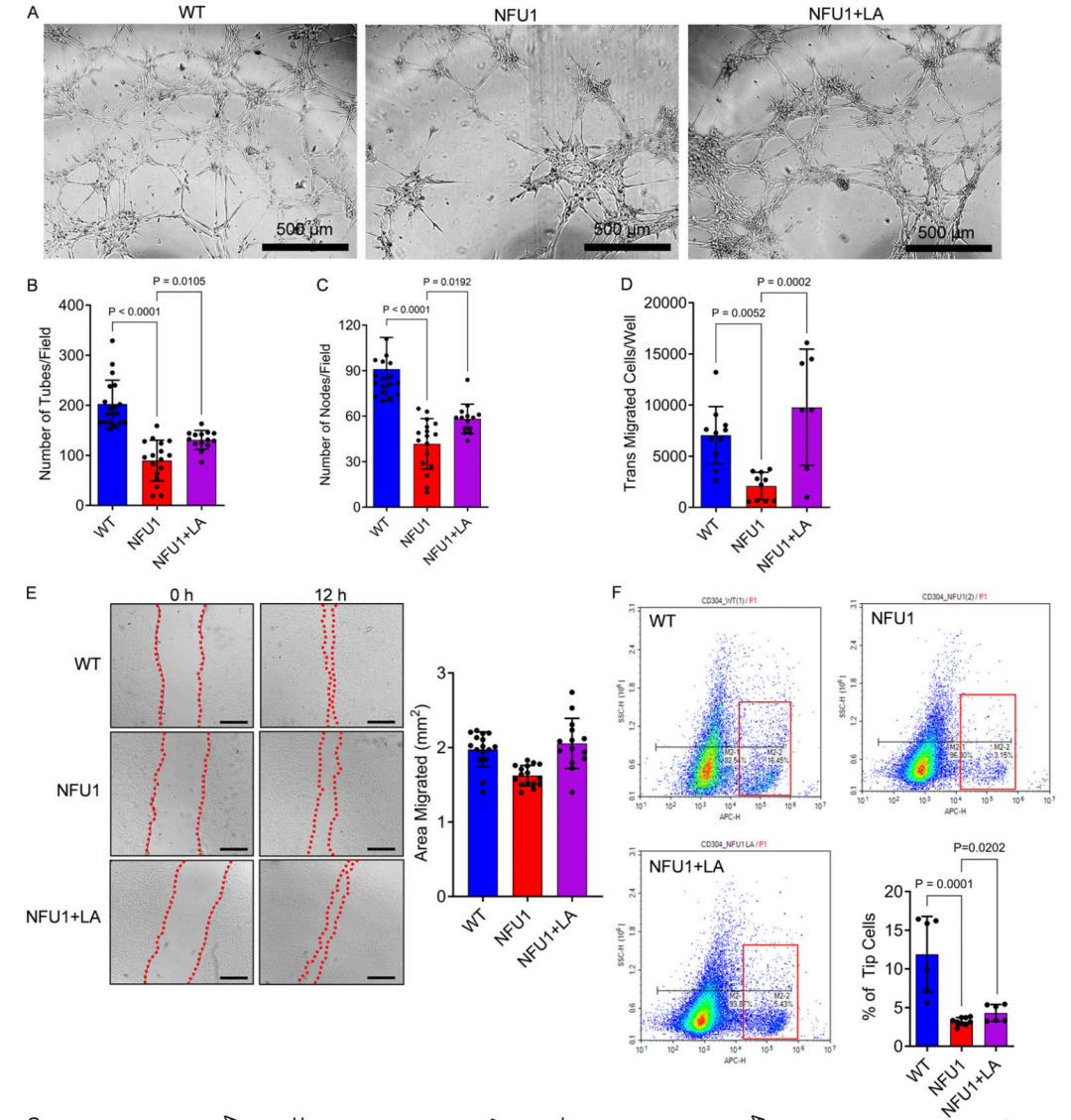
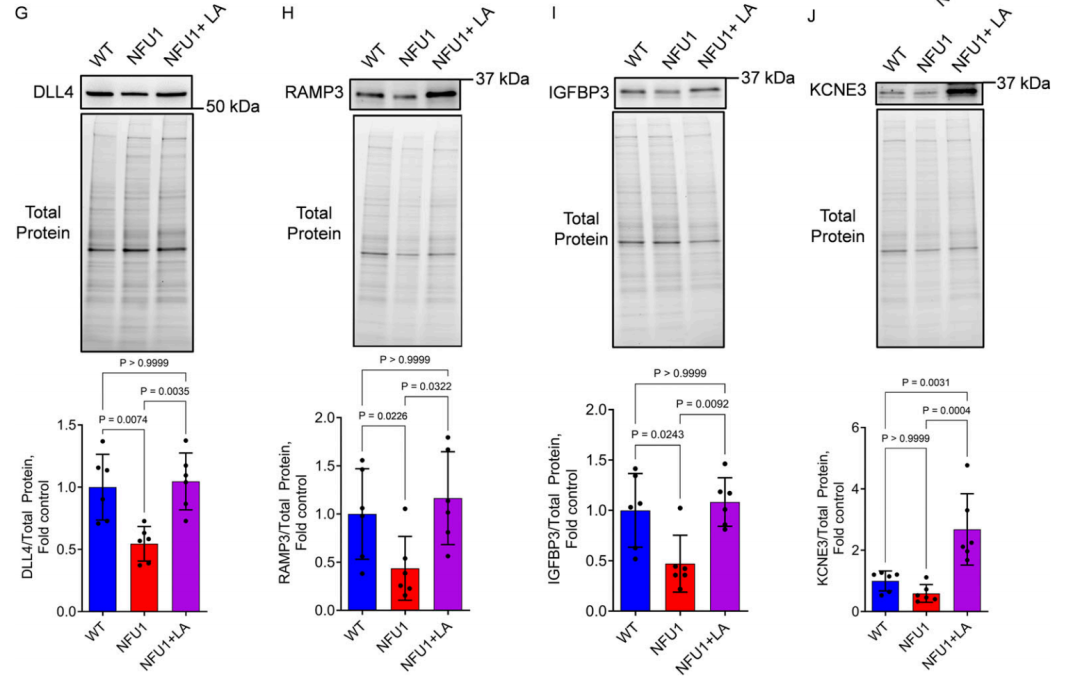
图 7.LA 恢复NFU1G206C的PEC血管生成能力。
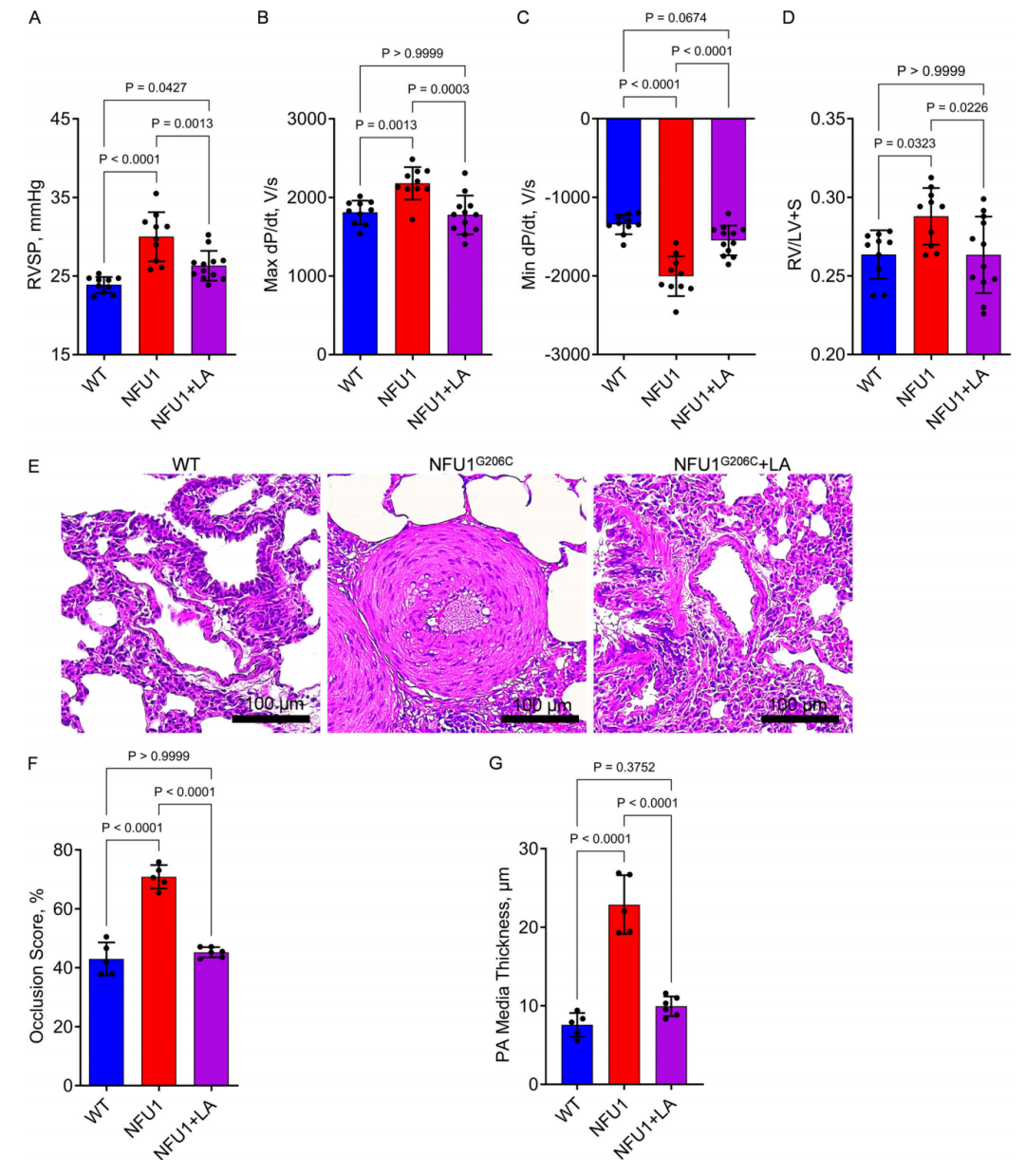
图 8. LA 补充剂可挽救NFU1G206C大鼠的PAH表型。
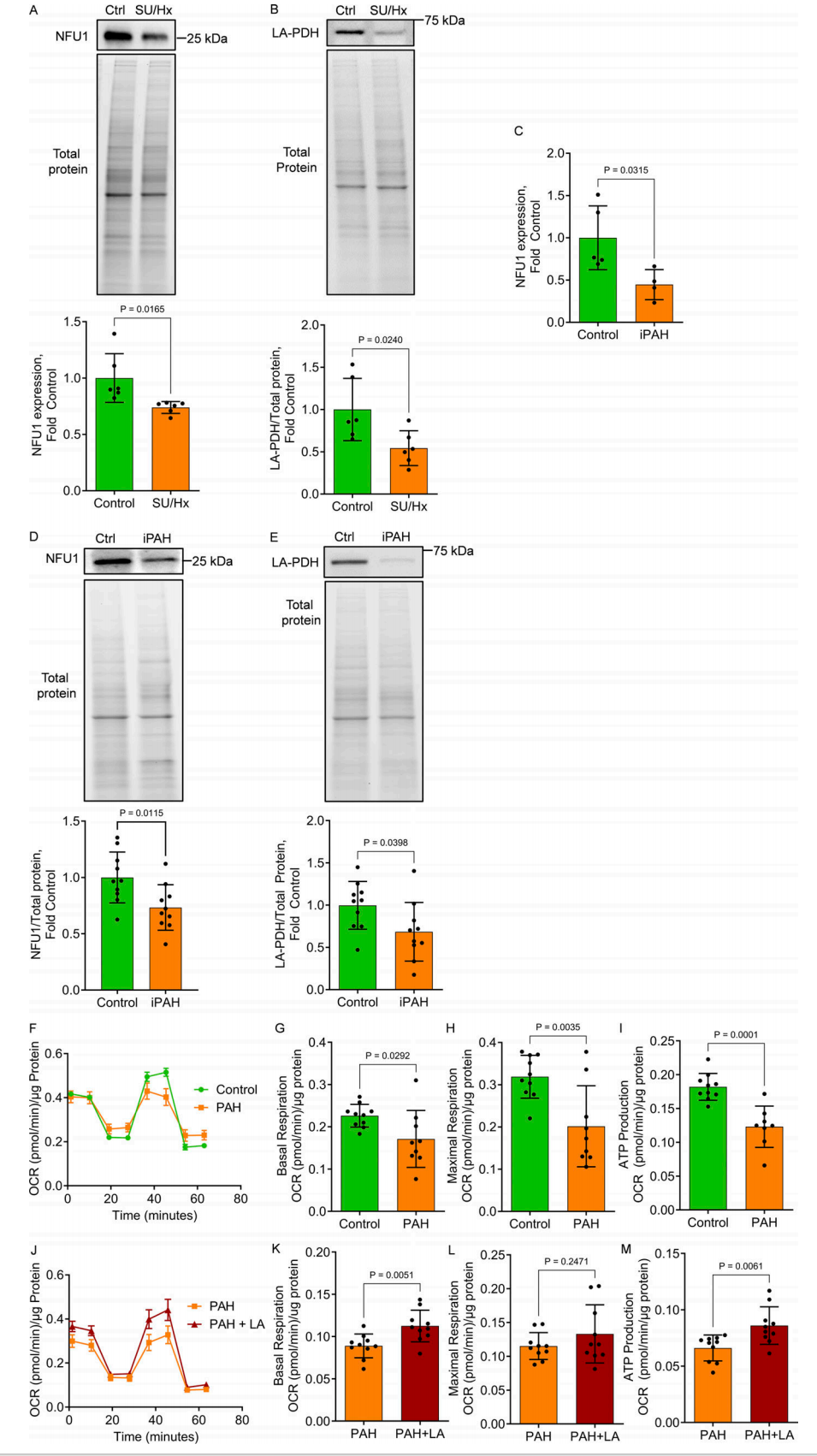
图 9. Su/Hx 大鼠模型和 iPAH 患者的 NFU1 缺乏症以及 LA 补充剂对缓解患者 PAEC 中的 MD 的保护潜力。
研究结论:
作者:刘少飞
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







线粒体的耗能
44
#肺动脉高压# #线粒体#
50