Nature:这种在90%的人体内潜伏的病毒,引起染色体断裂促进癌症
2023-04-21 王聪 “生物世界”公众号
这项研究首次描述了爱泼斯坦-巴尔病毒(EBV)是如何利用人类基因组的脆弱位点导致染色体断裂、引发癌症,还同时降低人体抑制癌症能力的。
爱泼斯坦-巴尔病毒(EBV)是世界上最常见的病毒之一,EBV很容易通过体液传播(主要是唾液),例如接吻、共用饮料或餐具。据统计,全世界范围内有90%-95%的人被感染过,通常是在儿童时期就已经被感染。
EBV感染会引起传染性单核细胞增多症或类似疾病,但这通常没有症状表现。大多数EBV感染症状轻微且会消失,但这些病毒却会在体内持续存在并潜伏,又会是会也会被重新激活。近年来,一些研究显示,长期潜伏的EBV病毒与一些慢性炎症和多种癌症有关,还有研究发现,EBV可能是多发性硬化症(MS)的致病因子。
2023年4月12日,加州大学圣地亚哥分校的 Don Cleveland 教授团队在 Nature 发表了题为:Chromosomal fragile site breakage by EBV-encoded EBNA1 at clustered repeats 的研究论文。
这项研究首次描述了爱泼斯坦-巴尔病毒(EBV)是如何利用人类基因组的脆弱位点导致染色体断裂、引发癌症,还同时降低人体抑制癌症能力的。

在每个人的基因组中都有着脆弱位点,这些特定的染色体区域在DNA复制时更容易产生突变、断裂或缺失。这些变化都可能与失调和疾病有关,可能导致遗传疾病,也可能导致癌症。

Don Cleveland 教授
论文通讯作者 Don Cleveland 教授表示,这项研究揭示了EBV是如何诱导人类第11号染色体断裂并引发一系列基因组不稳定性的,这可能激活导致白血病的致癌基因,并使主要的抑癌基因失活。这也首次证明了如何选择性地诱导脆弱DNA位点的断裂。
在这项最新研究中,研究团队将重点放在EBNA1蛋白上,这是一种持续存在于感染了EBV的人体细胞中的病毒蛋白。之前的研究表明,EBNA1会在EBV基因组复制起始处与特定基因组序列结合。这项研究发现,EBNA1还在人类11号染色体的一个脆弱位点结合了一簇EBV样序列,在那里,蛋白质丰度的增加会引发染色体断裂。
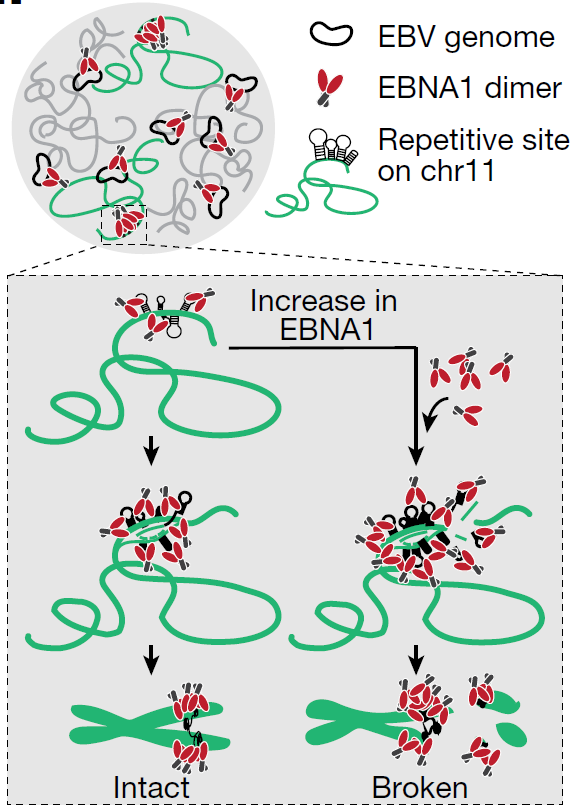
之前有研究显示,EBNA1能够抑制p53基因,而p53素有“基因组守护者”之称,在控制细胞分裂和细胞死亡中起着关键作用。在正常情况下,p53能抑制肿瘤的发生发展,而突变的p53则与癌细胞生长有关。
研究团队还检查了来自全基因组泛癌症分析项目的38种癌症类型的2439例癌症的全基因组测序数据,他们发现,可检测到EBV感染的肿瘤中显示出更高水平的11号染色体异常,尤其是头颈癌病例。

Julia Su Zhou Li
论文第一作者、博士后 Julia Su Zhou Li 表示,对于一种无处不在、对大多数人无害的病毒,识别易患潜伏感染相关疾病的高危人群仍是一项正在进行的努力。这项研究表明,对EBNA1诱导的11号染色体断裂的易感性取决于对潜伏感染中产生的EBNA1蛋白水平的控制,以及每个个体中11号染色体上EBV样序列数量的遗传变异。展望未来,这一发现为筛选EBV感染相关疾病发展的危险因素铺平了道路。此外,阻断EBNA1与11号染色体上EBV样序列的结合可以用来预防EBV相关疾病的发展。
原始出处:
Li, J.S.Z., Abbasi, A., Kim, D.H. et al. Chromosomal fragile site breakage by EBV-encoded EBNA1 at clustered repeats. Nature 616, 504–509 (2023). https://doi.org/10.1038/s41586-023-05923-x.
作者:王聪
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








感谢分享
51