【Nature子刊】新型免疫疗法治疗多发性骨髓瘤的耐药机制及克服策略
2024-07-17 聊聊血液 聊聊血液
对于开发下一代CAR-T细胞和BTE疗法,以及优化治疗排序和计划联合治疗来说,研究驱动肿瘤反应性和/或对新型免疫治疗产生耐药性的潜在生物学机制至关重要。
多发性骨髓瘤(MM)中新型免疫疗法迅猛发展,包括抗体药物偶联物(ADC)、双特异性T细胞衔接器(BTE)和嵌合抗原受体(CAR) T细胞。BCMA、GPRC5D和FcRL5(也称为FcRH5)等是浆细胞表达的细胞表面跨膜蛋白,均为MM的重要免疫治疗靶点,在重度经治的复发和/或难治患者中显示出良好疗效。然而,原发性耐药和缓解持久性有限的问题对靶向MM相关抗原的免疫治疗的有效性提出重大挑战。
对于开发下一代CAR-T细胞和BTE疗法,以及优化治疗排序和计划联合治疗来说,研究驱动肿瘤反应性和/或对新型免疫治疗产生耐药性的潜在生物学机制至关重要。靶向T细胞重定向免疫治疗相关的逃逸机制如下图所示,下文进行详述,还包括解决当前挑战和提高新型免疫治疗疗效的潜在策略。
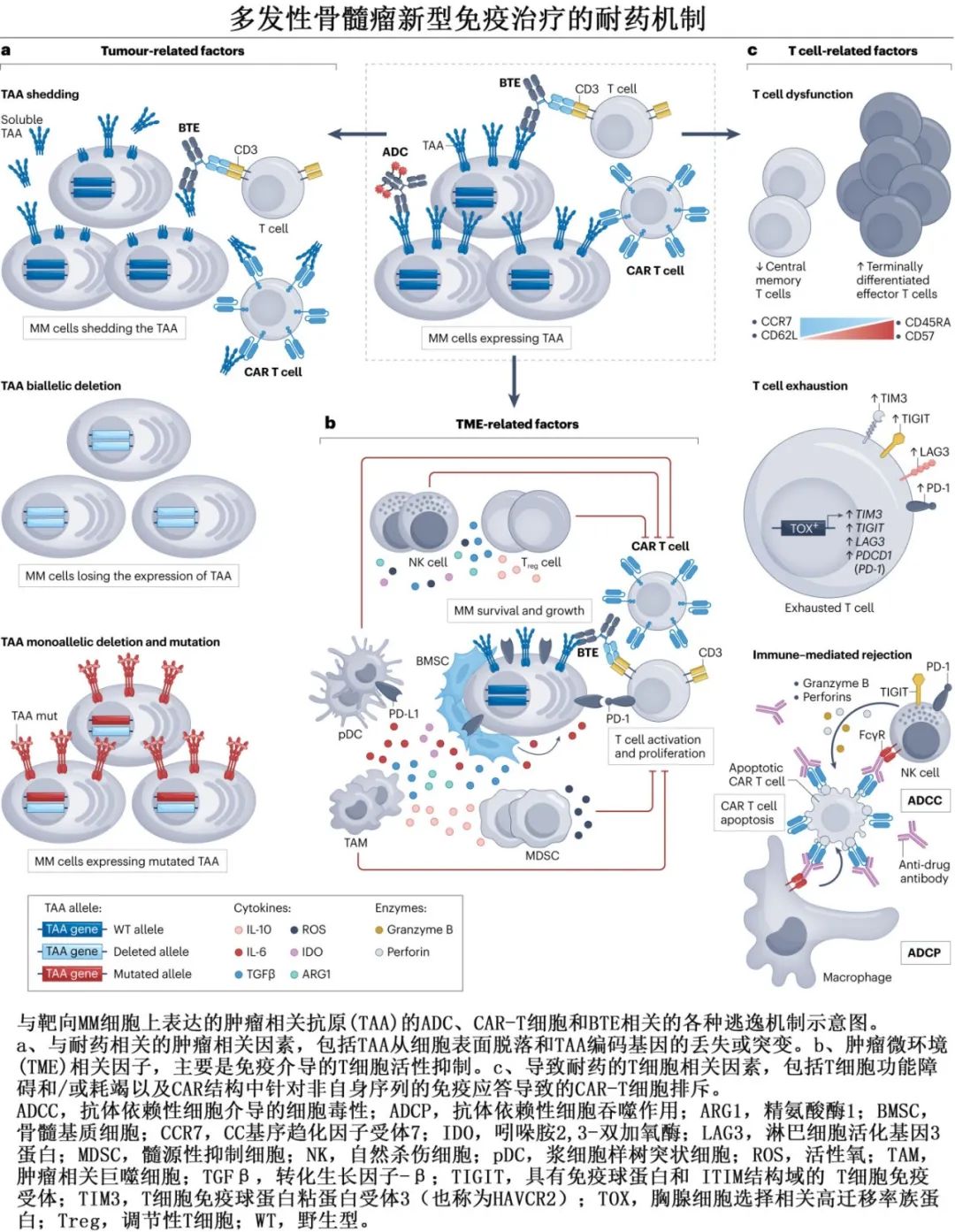
多发性骨髓瘤新型免疫治疗的耐药机制
T细胞相关的耐药原因
CAR-T细胞和BTE在MM患者中的疗效与T细胞的健康度密切相关。具体到CAR-T细胞的疗效,CAR-T细胞的体内扩增程度和持久性与临床结局。在制备前的白细胞单采产品中,CD4/CD8比值高和CD27+CD45RO−CD8+ T细胞比例高等因素与RRMM患者体内CAR-T细胞扩增增强有关。因此大量研究致力于优化CAR-T细胞产品,以保持记忆样和干细胞样细胞表型。具体策略包括在PI3K抑制剂存在的情况下培养凝聚的T细胞,如bb21217 BCMA CAR-T细胞,或利用T- charge等平台,使CAR-T细胞在48小时内快速体外生产,以最大限度地提高其输注后体内扩增的剩余能力。多种旨在增强CAR-T细胞功能和持久性同时限制细胞耗竭的方法也在临床前模型中进行评估,相关策略包括通过破坏组蛋白甲基转移酶(如SUV39H1)来平衡CAR-T细胞的功能和持久性,以及通过CRISPR-Cas9基因编辑将CAR序列引入内源性T细胞受体(TCR) α常数(TRAC)位点来校准CAR-T细胞激活,以减少tonic信号传导和延迟T细胞耗竭。此外,优化T细胞采集的时间,特别是在新诊断时诱导治疗后收集细胞,而非在疾病复发时收集细胞,可能会丰富白细胞单采产物中的记忆表型。有研究正在评估CAR-T治疗新诊断MM患者,此外研究表明,cilta-cel在接受一线治疗后的疗效与之前接受一至三条治疗后的疗效相当。因此,在早期治疗中使用CAR-T细胞是否能产生更长时间的无病缓解仍有待验证。
清淋后宿主骨髓T细胞库是决定患者预后的另一个因素。CAR-T细胞输注后骨髓T细胞组成发生改变,可用于区分持久缓解(>6个月)和短暂缓解(<6个月)的患者。特别是,在输注后的第28天,短暂缓解者具有更丰富的终末分化T细胞(可表达高水平的标志物,如颗粒酶B和TBX21/TBET),以及基线时的超扩增终末分化T细胞。与之相反,较少耗尽的记忆型T细胞以及表达骨髓保留基因的T细胞的富集与临床缓解和更长的PFS相关。有趣的是,非CAR-T细胞的克隆型扩增起源于CAR-T细胞输注前在基线激活的T细胞,表明在肿瘤部位扩增的MM细胞反应性T细胞进一步增强对CAR-T细胞治疗的反应。检查非CAR-T细胞组成中克隆型扩增的程度,并确定这些T细胞是否确实被MM抗原特异性激活,将有助于深入了解预先存在的TCR库对CAR-T细胞治疗反应的影响。
与之类似,先前存在的T细胞的功能状态已成为MM患者对BTE反应的关键决定因素。对BTE无应答的患者通常具有免疫耗竭的特征,其特征为治疗前大量终末耗竭T细胞(可表达包括PD-1, TIM-3和CD38在内的标志物)和少量的效应CD8+ T细胞。有反应者始终具有快速和持续的克隆型扩张,通常早在BTE治疗的第1周期后开始,并持续整个治疗过程;而在无应答者中未观察到这种克隆型扩张。T细胞在肿瘤部位的克隆扩增(类似于CAR-T细胞治疗的反应)突出肿瘤抗原特异性T细胞的潜力,这些T细胞可以被动员和激活,以及表位扩散,以响应CAR-T细胞或BTE治疗,从而改善治疗反应。但驱动这种克隆型扩张的确切机制尚不清楚,到底纯粹是克隆型增殖爆发及随后效应T细胞丰度的增加驱动反应,还是扩增的T细胞克隆的肿瘤抗原特异性是深刻和持久反应的关键因素?目前尚不清楚。如果扩增的T细胞克隆型是肿瘤特异性,BTE则可能会额外促进其抗肿瘤记忆功能的利用,这是适应性免疫的特征标志,从而引发持久的治疗反应。
CAR-T细胞的体内持久性也会受到免疫介导的排斥反应的限制。scFv序列(特别是非人类起源的序列)可触发体液或细胞抗CAR免疫反应,并在患者体内产生抗CAR抗体。对于异基因CAR-T细胞产物(如ALLO-715),敲除TRAC和CD52及给予清淋和抗CD52抗体治疗可缓解这一现象。尽管免疫介导的CAR-T细胞排斥在MM中的机制尚未完全确定,但了解CAR免疫原性与治疗失败之间的关系可能具有重要临床意义。
肿瘤相关因子促进抗原逃逸
靶抗原的丢失或突变是MM患者对BCMA或GPRC5D靶向免疫疗法继发性、获得性耐药的关键机制。CAR-T细胞或BTE施加的治疗压力可诱导肿瘤免疫编辑,促进抗原阴性或抗原突变克隆的选择性扩增,最终导致临床复发。但据报道,BCMA CAR-T细胞治疗后BCMA阴性复发的发生率约为4%,而接受BCMA BTE治疗的患者靶抗原丢失率高达43%。这一差异可能反映出相对于单次CAR-T细胞输注,在长期和选择性的反复BTE给药压力下发生的不同的适应性肿瘤演化。TNFRSF17(编码BCMA的基因)的双等位基因缺失是CAR-T细胞受体中BCMA丢失的主要机制,但在接受BTE的患者中,BCMA抗原逃逸不仅可以通过双等位基因TNFRSF17缺失介导,还可以通过BCMA细胞外结构域的突变介导,从而导致靶表位的破坏。
GPRC5D靶向治疗后GPRC5D亦可发生改变。研究证实,靶向T细胞重定向治疗后,GPRC5D丢失的发生可能比BCMA丢失更普遍。这一趋势可能反映出一个问题,那就是GPRC5D在MM细胞中缺乏必要的功能,而BCMA在为恶性浆细胞提供促生存信号方面起关键作用。
关于携带这些抗原逃逸变体的肿瘤的出现,在4-15%的免疫治疗初治 MM 患者中可检测到携带单等位基因 TNFRSF17 或 GPRC5D 缺失的既存 MM 克隆。一名患者在BCMA靶向免疫治疗之前发现了少量TNFRSF17双等位基因缺失的亚克隆(占所有CD138+浆细胞的0.8%),该患者在92.4%的浆细胞中也存在16号染色体克隆单体(包含TNFRSF17位点),并导致治疗期间抗原漂移。从而反映出癌细胞在选择性治疗压力下的可塑性。
慢性T细胞与BTE的结合促进无抗原(antigen-null)克隆的出现,从而强调了优化给药计划的必要性,包括时间限制性治疗或可能的“治疗假期”,或可防止抗原逃逸亚克隆成为主导。此外,这一发现对CAR-T细胞和BTE治疗的最佳排序具有重要意义。来自接受序贯免疫治疗的患者的研究数据表明,与未接受免疫治疗的患者相比,先前暴露于BCMA靶向治疗(ADC和/或BTE)的患者对BCMA CAR-T细胞的反应较差。因此,如果药物可及性不是问题,并且患者没有快速进展的疾病,在BTE治疗之前使用CAR-T细胞是优选方案,特别是可以在BTE治疗之前收集和保存患者T细胞,以防止BTE治疗后T细胞耗竭。这些数据还表明,在后线治疗重新靶向BCMA之前,从BCMA靶向治疗转向非BCMA靶向治疗(如GPRC5D或FcRL5靶向CAR-T细胞或BTE)可能是更好的防止抗原逃逸的策略。但需要前瞻性研究来证实这种方案的实用性。
除了涉及TNFRSF17位点的基因组改变外,MM细胞表面的BCMA表达也受γ-分泌酶的蛋白酶活性调控,γ-分泌酶裂解并释放BCMA的细胞外结构域。这种外结构域的脱落不仅可降低靶细胞上BCMA的表面密度,从而削弱BCMACAR-T细胞介导或BCMA BTE诱导的细胞毒性,还可产生可溶性BCMA(sBCMA),sBCMA可作为血清中这些药物的诱饵配体,并且确实可减弱BCMA BTE的治疗作用和临床疗效。γ-分泌酶抑制剂在恢复细胞表面表达BCMA和降低sBCMA水平方面有效,且γ-分泌酶抑制剂联合BCMA CAR-T细胞或BTE的策略正在进行临床试验。
此外,BCMA或GPRC5D抗原逃逸的问题可以通过双重或序贯靶向多个抗原来解决,以防止出现无抗原克隆。该策略正在talquetamab联合teclistamab的研究中评估,初步疗效良好。
设计同时靶向两种不同抗原的CAR-T细胞疗法,如BCMA联合GPRC5D76、FcRL5、CD24、SLAM家族成员7 (SLAMF7,也称为CS1)或跨膜激活剂和CAML相互作用剂(TACI,也称为TNFRSF13B)也在研究中,部分已进入临床试验。至于FcRL5 CAR-T细胞和BTE,有望很快揭示靶向FcRL5疗法中抗原逃逸的患病率和机制和/或与疗效相关的免疫介导因子。
最后,SLAMF7也是MM的潜在免疫治疗靶点,因为它在恶性浆细胞上大量表达,并在发病机制中发挥作用。但SLAMF7的表达并不完全局限于MM细胞,也发生在T细胞、B细胞和NK细胞上,因此针对这种抗原的T细胞重定向疗法会导致自相残杀(fratricide)作为on-target off-tumour毒性。尽管如此,SLAMF7 CAR-T细胞已经进入临床试验阶段,某些产品还包括一个开关自杀基因作为安全特征。此外,第一个通用的“现成的”异基因SLAMF7特异性CAR-T细胞产品(UCARTCS1)已进入临床开发,用于重度经治MM。在UCARTCS1中,TRAC和SLAMF7基因都被灭活,以限制移植物抗宿主病和T细胞自相残杀,但UCARTCS1的开发已经停止(申办方决策,而非安全问题)。
骨髓微环境的作用
CAR-T细胞和BTE治疗MM患者的有效性取决于T细胞能否成功重定向到恶性骨髓微环境中的MM细胞,在骨髓微环境中MM细胞会遇到各种免疫抑制因子。MM的骨髓微环境由胞外基质元素和多种细胞类型组成,包括基质细胞、成骨细胞、破骨细胞和各种免疫细胞,如T细胞、NK细胞、单核细胞、髓源性抑制细胞(MDSC)和肿瘤相关巨噬细胞(TAM),它们与细胞因子和生长因子一起共同促进肿瘤生长和免疫逃逸。此外,以大量终末分化T细胞、调节性T (Treg)细胞和促炎T辅助17细胞为特征的免疫失调和免疫衰老是MM的标志。骨髓缺氧环境加上代谢应激和慢性抗原刺激可进一步使T细胞功能低下,导致T细胞效应功能受损。CAR-T细胞和BTE疗法依赖于T细胞的活化,从而在这种免疫抑制环境中执行其效应功能。
体外研究表明,患者来源的骨髓基质细胞与MM细胞系共培养可以减弱talquetamab诱导的、T细胞介导的细胞毒性,至少部分原因是通过直接细胞间相互作用降低MM细胞上GPRC5D的表达。此外,通过测序(CITE-seq)和单细胞转录组学对转录组和表位进行单细胞指数的研究,可深入了解了骨髓中不同的髓细胞和DC细胞群体在BCMA CAR-T细胞治疗的患者中作为治疗反应决定因素的作用。有趣的是,富集与 MDSC相关的单核-巨噬细胞标志物的细胞群与较短的 PFS 相关,而表达与传统1型 DC 相关标记物(如CLEC9A)的细胞与较长的 PFS 相关。这些发现强调了内源性抗原呈递细胞在增强CAR-T细胞反应中的潜在作用,并值得在其他研究中验证。巨噬细胞(特别是TAM)也存在于MM骨髓微环境中,并且是IL-6和活性氧(包括一氧化氮)的主要来源,它们有助于疾病进展和免疫抑制。值得注意的是,基线时高水平的TAM浸润与CD19 CAR-T细胞治疗的B细胞非霍奇金淋巴瘤患者的不良预后相关。因此可以推测, MM骨髓环境中存在TAM与大量MDSC可以损害CAR-T细胞的扩增并促进耐药。还需要进一步的研究来探索TAM靶向策略的治疗潜力,以提高T细胞介导的MM活性。
CAR-T细胞输注前的清淋化疗也对骨髓微环境有影响,并可能影响治疗反应。具体影响包括Treg细胞的消耗和诱导血管内皮细胞的损伤,可以使环境更适合CAR-T细胞。去除稳态细胞因子(如IL-7和IL-15)的细胞汇(sinks)也可以增强过继性转移肿瘤特异性T细胞的功效,并抑制宿主免疫系统,从根本上降低CAR-T细胞的免疫原性。然而,清淋的负面影响包括延长细胞减少导致更大的感染风险以及潜在的继发性病态造血(myelodysplasia)。虽然关于T细胞疗法的最佳清淋清除方案的证据仍然很少,但氟达拉滨和环磷酰胺(Flu/Cy)最常用。然而,在接受BCMA CAR-T细胞治疗的患者中,苯达莫司汀清淋具有与Flu/Cy相似的安全性和有效性。需要进一步的研究来优化清淋方案,以尽量减少其对骨髓环境的影响并改善治疗结局。
肠道微生物群也可以影响CAR-T细胞治疗的临床反应和CRS,但还需要进一步的研究来更好地了解宿主-微生物相互作用的复杂性以及微生物群组成的差异如何影响治疗反应。
尽管骨髓微环境在MM中起着关键作用,但仅有有限的研究专门针对其对CAR-T细胞和BTE反应的影响,并且每种细胞类型或细胞因子的具体作用尚未完全阐明。然而,部分临床试验正在评估靶向免疫疗法结合免疫刺激剂,旨在产生更有利的抗肿瘤反应。这些策略包括通过诱导疗法在T细胞治疗之前减轻肿瘤负担,或使用免疫调节剂(如IMiD或小脑E3连接酶调节剂[celmod])、免疫检查点抑制剂(例如抗pd -1抗体)和抗CD38抗体来操纵肿瘤免疫微环境。
MM中免疫疗法的最佳排序
随着多种以BCMA和GPRC5D为靶点的治疗方法的快速发展和临床可用,其最佳排序已成为治疗RRMM的关键问题。尽管数据仍然有限,但来自临床试验和现实世界研究的现有证据表明,BCMA CAR-T细胞治疗前如果曾暴露于BCMA BTE则PFS较短。因此,在BCMA BTE治疗后使用BCMA CAR-T细胞治疗进展性MM可能并非最佳选择。与之相反,当CAR-T细胞作为第一个BCMA靶向治疗时,如果抗原逃逸不是产生耐药性的原因,那么BCMA BTE可能有效。
另一个遗留的问题在于BTE的序贯治疗。较新数据表明,BCMA BTE治疗后的疾病复发通常是由于BCMA细胞外结构域的突变,这些突变可影响某些BTE结合该蛋白的能力,但不其他BTE结合该蛋白。这一发现引发了一个问题,即靶向完全不同抗原(如GPRC5D)的BTE是否应该在靶向BCMA的BTE之前使用,或者是否在BCMA靶向治疗后将这种不同的靶点保留用于治疗进展性疾病。基于相关研究,如果T细胞耗竭并非耐药的主要原因,则挽救治疗可以包括后续BTE,特别是靶向不同抗原。此外,临床前数据表明,连续BTE暴露诱导的T细胞耗竭可以通过无治疗间期(treatment-free intervals)得到改善。因此,应考虑和评估固定时间BTE治疗和治疗周期之间给予休息时间,以防止T细胞耗竭、抗原逃逸和改善临床结局。鉴于不同的非重叠机制介导对序贯 BTE 和 CAR T 细胞治疗的耐药,需要对抗原逃逸进行动态监测并对 T 细胞健康度进行功能评价,以优化 MM 患者免疫治疗的排序。
参考文献
Neri, P., Leblay, N., Lee, H. et al. Just scratching the surface: novel treatment approaches for multiple myeloma targeting cell membrane proteins. Nat Rev Clin Oncol (2024). https://doi.org/10.1038/s41571-024-00913-y
作者:聊聊血液
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






#多发性骨髓瘤# #耐药机制# #新型免疫疗法#
63