“绘”解读真报告丨染色体异常+FLCN胚系突变,神经母细胞瘤基因检测究竟有哪些意义?
2024-07-31 苏州绘真医学 苏州绘真医学
这里,我们结合近期的一例检测案例,来更好地理解神经母细胞瘤需要检测的内容,以及检测带来的临床意义。
神经母细胞瘤(neuroblastoma,NB)起源于原始交感神经节细胞,是一种几乎仅发生于儿童的常见颅外实体瘤。约50%的神经母细胞瘤发生在2岁以内的婴幼儿,在我国的发病率约为10.1/100万(0-14岁儿童),每年新发患者人数约为3000例[1]。
目前,基因检测指导NB患者精准诊疗主要体现在3个方面,即辅助危险度分层、靶向治疗以及遗传风险评估。这里,我们结合近期的一例检测案例,来更好地理解神经母细胞瘤需要检测的内容,以及检测带来的临床意义。
案 例
患者信息:男、3岁
病理诊断:差分化神经母细胞瘤伴颈部淋巴结转移
送检样本:石蜡切片、血液
检测项目:1. 实体瘤201基因检测基础版;2.神经母细胞瘤染色体拷贝数变异检测

图1 患者病理报告
在对切片标本进行完备的质控,检测和分析流程后,通过神经母细胞瘤染色体拷贝数变异检测项目,检出染色体2p、17q扩增和染色体3p、11q缺失;通过201基因检测,检出FLCN p.H429Pfs*27变异,变异丰度为44.17%。医学部结合变异丰度评估该突变为可能为胚系突变,后进一步行外周血sanger测序,最终验证为:胚系杂合突变。
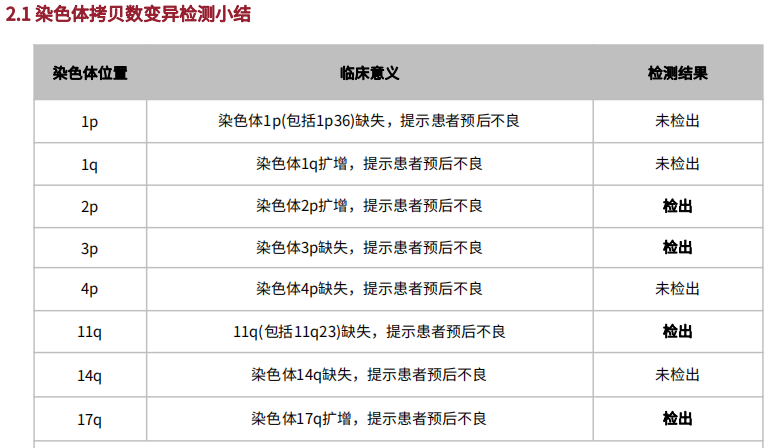

图2 患者检出染色体2p、17q扩增和3p、11q缺失和FLCN突变
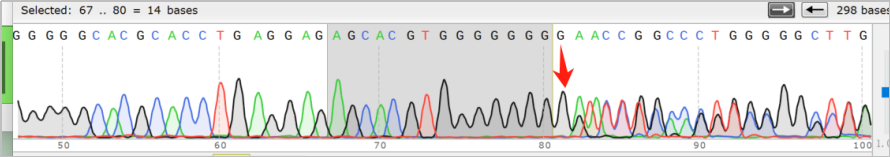

图3 患者FLCN p.H429Pfs*27验证为胚系突变
检出染色体拷贝数变异,辅助预后评估
据报道,神经母细胞瘤患者组织学和分子突变具有显著的异质性,预后差异大,中低危患者5年生存率达85%-90%,而高危患者仅为40%-50%。因此,准确的危险度分层,对患者的预后评估和分组治疗至关重要。
《中国肿瘤整合诊治指南——神经母细胞瘤》明确指出[2],节段性染色体畸变,例如MYCN扩增和染色体物质的区域性缺失或获得,都与不良预后有关。高危NB患者体系变异特点主要概括为:常发生1p、1q、3p、11q、14q、17p等节段性染色体畸变;MYCN基因扩增 (占 16%-25%);低频率的外显子突变,如ALK为最常见突变,占10%,选做ALK、TERT、RAS/MAPK等基因。而本案例中,患者最终检出11q缺失、3p缺失、2p扩增、17q扩增等节段性染色体畸变,结合指南和临床研究为患者做出预后指导。
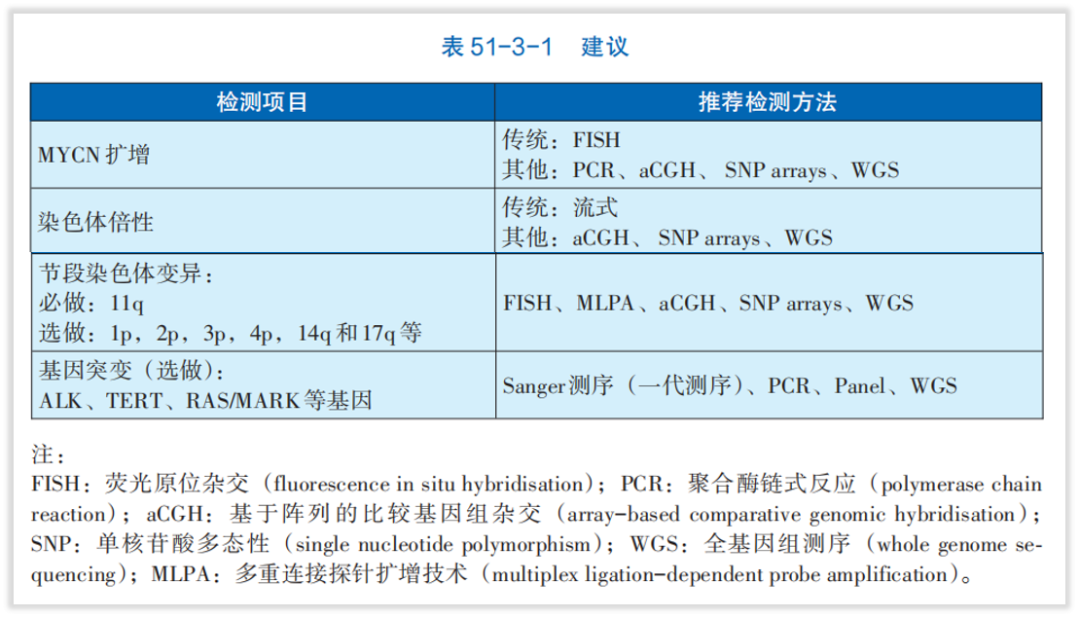
图4 来自《中国肿瘤整合诊治指南——神经母细胞瘤》的建议
有研究在357例儿童神经母细胞瘤中检出60例(17%)染色体11q缺失,通过对比11q缺失患者和未缺失患者的生存预后来看,在总生存期(OS)上,11q缺失患者显著低于11q正常的患者(5年OS: 60% vs 76%;8年OS:52% vs 72%;p=0.014);在无事件生存率(EFS)上,11q缺失患者也显著低于11q正常的患者(5年EFS:35% vs 75%;8年EFS:32% vs 73%;p<0.001)。在复发率上,11q正常的患者复发率为16%,而在11q缺失的患者中,这一比例升至63%(36/57)[3]。另有研究证实,染色体3p缺失往往与11q缺失共存,均提示患者预后不良[4]。
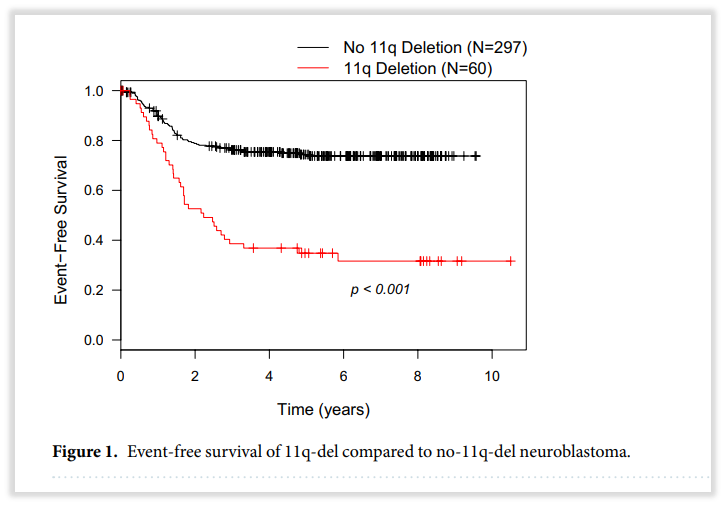
图5 携带染色体11q缺失的NB患者生存预后更差
一项研究在16%的神经母细胞瘤患者中检出染色体2p扩增,20%的患者中检出MYCN扩增,这两种变异的患者在总生存期和无事件生存率(EFS)率比较相似,均提示预后不良,可能需要更密切的治疗,尤其是在高风险疾病的患者中[5]。

图6 携带染色体2p扩增的NB患者生存预后更差
研究表明,超过50%的患者携带染色体17q扩增,由于有IGF2BP1、NME1、PPM1D等多个致癌基因位于17q21-ter基因座,所以,17q扩增也已经被证实与神经母细胞瘤的预后不良,与晚期NB患者的生存率差有关[6-8]。
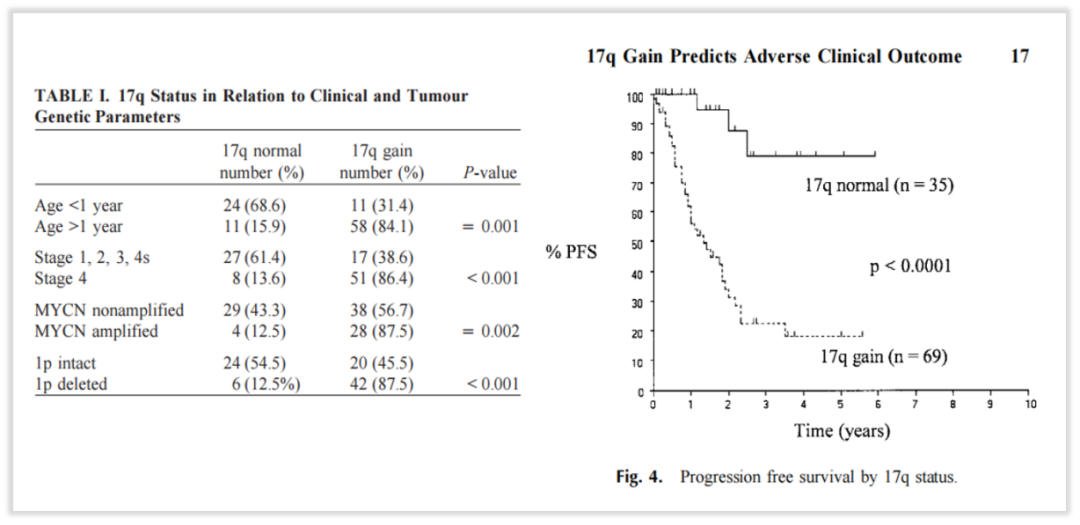
图7 携带染色体17q扩增的NB患者生存预后更差
在本案例中,患者染色体层面检出上述染色体2p、17q扩增和染色体3p、11q缺失,依据上述指南和文献证据,从分子层面推测该患者神经母细胞瘤的恶性程度可能更高,预后可能较差,这也与病理诊断“差分化神经母细胞瘤伴颈部淋巴结转移”的诊断结果相呼应,提示后续治疗更需要积极密切的治疗方案及临床管理。
检出FLCN胚系突变,辅助遗传性评估和靶向治疗探索
患者本次检出的FLCN基因胚系突变,是常染色体显性遗传病伯特-霍格-杜布综合征(BHD)唯一确定的致病基因。因此,患者通过基因检测确认为BHD患者,其临床特征为肺部弥漫性囊状病变、或伴自发性气胸、皮肤纤维毛囊瘤或毛盘瘤和多种类型的肾脏肿瘤。其次,还有结肠癌、支气管肺癌等恶性肿瘤[9]。
目前,FLCN胚系突变导致神经母细胞瘤的案例尚属罕见,既然患者检出FLCN胚系突变,仍提示其家系成员同样为BHD的可能性,并需要同步注意相关肿瘤的预防和及早干预,为家系成员提供了遗传指导!例如共识推荐:BHD综合征患者家系成员应接受健康教育,推荐成年进行症状前FLCN基因检测,及时排除 BHD 综合征【推荐意见14】。BHD综合征患者应行胸部CT评估肺部囊状病变,常规评估肾脏有无肿瘤病灶等【推荐意见 2】。BHD综合征患肾癌风险显著增高,推荐终生定期筛查【推荐意见12】。
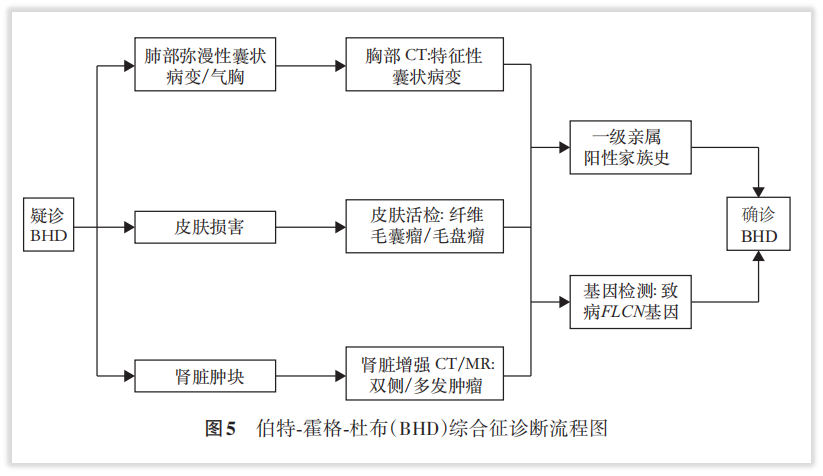
图8 摘自《伯特-霍格-杜布综合征诊治和管理中国专家共识》
在靶向治疗上,FLCN胚系突变也能为神经母细胞瘤患者提供靶向治疗探索,在一项体外试验中,针对FLCN基因失活的小鼠模型研究,发现相比对照,EGFR靶向抑制剂阿法替尼能够显著放慢肿瘤生长速度,控制肿瘤的生长。这项体外研究证据等级有限,可能为临床医生带来靶向治疗的探索[10]。我司报告也循证参考该文献,D级别推荐靶向药物阿法替尼。
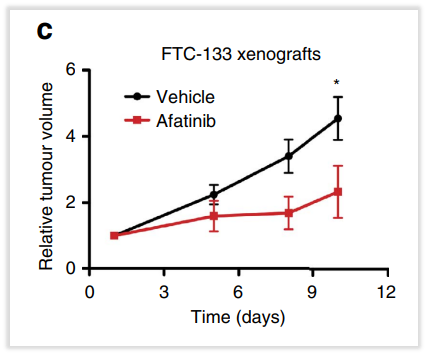
图9 FLCN变异用阿法替尼的体外临床试验
最后,我们总结这篇神经母细胞瘤患者的检测案例。很显然,本次基因检测着实为患者带来了预后、治疗和遗传上的多角度评估,见证了神经母细胞瘤患者基因检测的价值和必要性。值得说明的是,在染色体层面和基因突变层面的检测之余,国际神经母细胞瘤危险度分级协作组(International Neuroblastoma Risk Group,INRG)也强调,仍需结合患者诊断时的年龄、INRG肿瘤分期、组织学分类、肿瘤的分化程度等风险因素综合评估患者疾病情况,以更好地制定后续临床管理方案[11]!
如何选择神经母细胞瘤的基因检测项目?
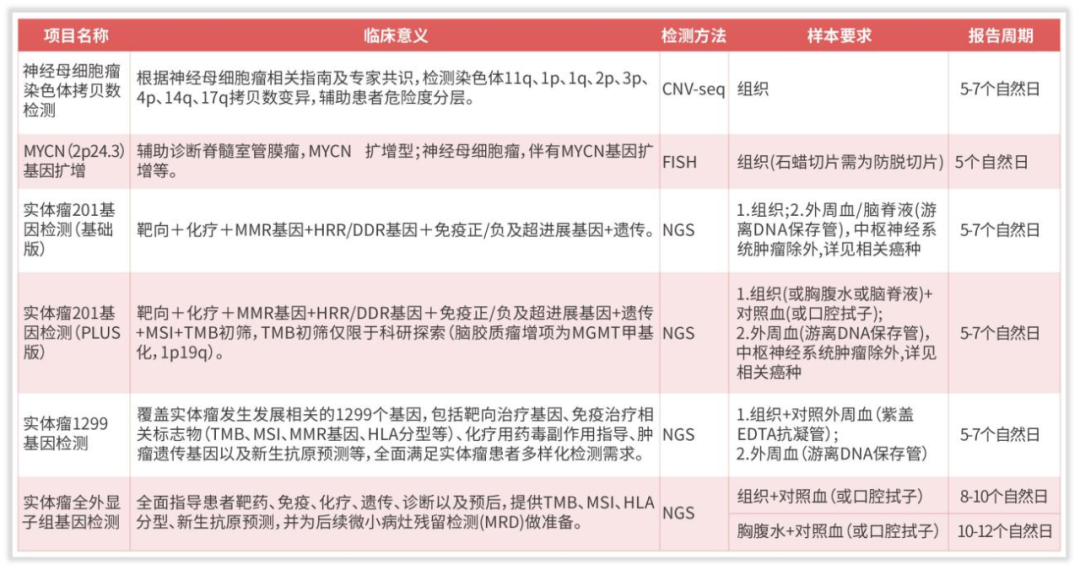
图10 神经母细胞瘤相关项目列表
目前,我司贴合神经母细胞瘤指南要求,提供神经母细胞瘤染色体拷贝数检测,能够根据神经母细胞瘤相关指南及专家共识,检测染色体11q、1p、1q、2p、3p、4p、14q、17q等拷贝数变异,辅助患者危险度分层,评估患者预后情况。在该项目选择之余,指南强调了基因变异层面的检测,另提供MYCN扩增检测,采用金标准FISH方法学检测,辅助患者预后危险度,16%-25%的NB存在MYCN基因扩增。提供201基因检测,包含指南推荐的MYCN、ALK、TERT、RAS/MAPK等基因,在靶向治疗,预后评估和遗传风险提供指导。另外,如图11,《中国肿瘤整合诊治指南(CACA)-神经母细胞瘤》对NB的胚系突变和体系突变做出了具体介绍,我司实体瘤1299基因检测和实体瘤全外显子组基因检测则包括了提及的ALK突变、PHOX2B突变,ATRX、 PTPN11、ARID1A、ARID1B、TERT、以及较为全面的RAS-MAPK信号通路基因突变,能够更多地指导患者治疗方案、遗传和预后评估。也满足指南所要求的,复发NB体系变异特点为体系突变频率增加,这使应用二代深度测序更有意义,复发病例变异类型主要为RAS-MAPK信号通路活跃。
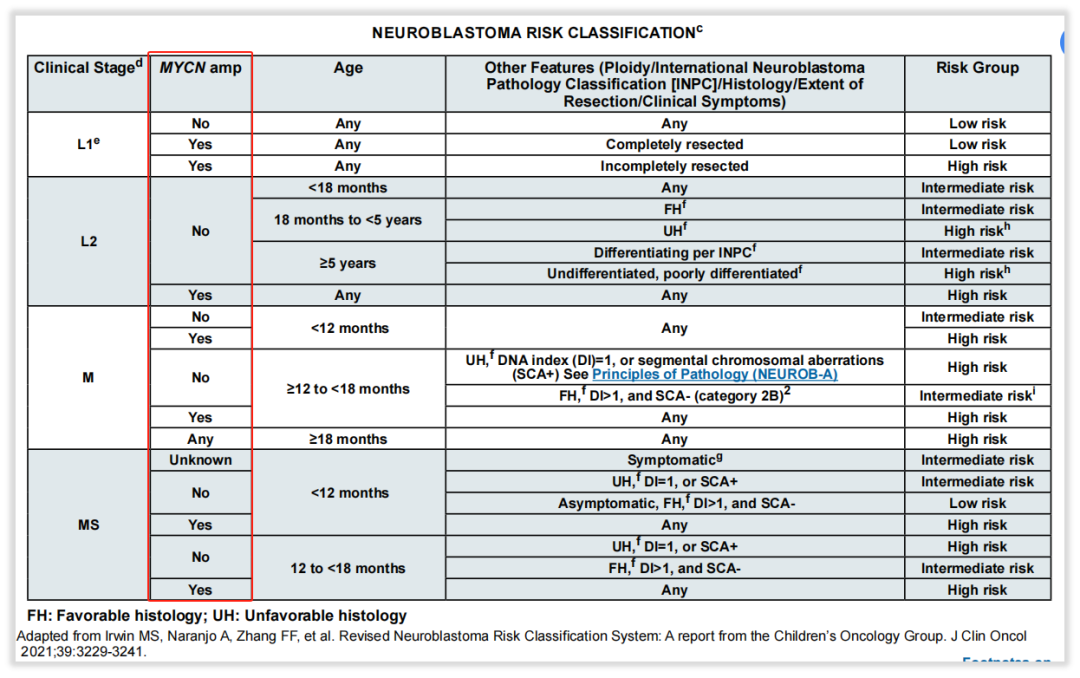
图11 NCCN指南神经母细胞瘤MYCN基因检测

图12 摘自《中国肿瘤整合诊治指南(CACA)-神经母细胞瘤》
参考文献:
[1]左彤彤,周卫萍,郑洁虹.神经母细胞瘤的分子生物学特性和靶向药物临床研究进展[J].中国肿瘤临床,2021,48(08):426-431.
[2]中国抗癌协会.《中国肿瘤整合诊治指南(CACA)》[J].癌症康复, 2022(3):1.
[3]Juan Ribelles A, Barberá S, Yáñez Y, Gargallo P, Segura V, Juan B, Noguera R, Piqueras M, Fornés-Ferrer V, de Mora JF, Cañete A, Castel V. Clinical Features of Neuroblastoma With 11q Deletion: An Increase in Relapse Probabilities In Localized And 4S Stages. Sci Rep. 2019 Sep 24;9(1):13806. doi: 10.1038/s41598-019-50327-5. Erratum in: Sci Rep. 2020 Jan 31;10(1):1914. doi: 10.1038/s41598-020-58428-2. PMID: 31551474; PMCID: PMC6760233.
[4]Breen CJ, O'Meara A, McDermott M, Mullarkey M, Stallings RL. Coordinate deletion of chromosome 3p and 11q in neuroblastoma detected by comparative genomic hybridization. Cancer Genet Cytogenet. 2000 Jul 1;120(1):44-9. doi: 10.1016/s0165-4608(99)00252-6. PMID: 10913676.
[5]Szewczyk K, Wieczorek A, Młynarski W, Janczar S, Woszczyk M, Gamrot Z, Chaber R, Wysocki M, Pogorzała M, Bik-Multanowski M, Balwierz W. Unfavorable Outcome of Neuroblastoma in Patients With 2p Gain. Front Oncol. 2019 Oct 9;9:1018. doi: 10.3389/fonc.2019.01018. PMID: 31649880; PMCID: PMC6794702.
[6]Mlakar V, Dupanloup I, Gonzales F, Papangelopoulou D, Ansari M, Gumy-Pause F. 17q Gain in Neuroblastoma: A Review of Clinical and Biological Implications. Cancers (Basel). 2024 Jan 12;16(2):338. doi: 10.3390/cancers16020338. PMID: 38254827; PMCID: PMC10814316.
[7]Bown N, Lastowska M, Cotterill S, O'Neill S, Ellershaw C, Roberts P, Lewis I, Pearson AD; U.K. Cancer Cytogenetics Group and the U.K. Children's Cancer Study Group. 17q gain in neuroblastoma predicts adverse clinical outcome. U.K. Cancer Cytogenetics Group and the U.K. Children's Cancer Study Group. Med Pediatr Oncol. 2001 Jan;36(1):14-9. doi: 10.1002/1096-911X(20010101)36:1<14:AID-MPO1005>3.0.CO;2-G. PMID: 11464868.
[8]Mlakar, V.; Dupanloup, I.; Gonzales, F.; Papangelopoulou, D.; Ansari, M.; Gumy-Pause, F. 17q Gain in Neuroblastoma: A Review of Clinical and Biological Implications. Cancers 2024, 16, 338. https://doi.org/10.3390/cancers16020338
[9]伯特-霍格-杜布综合征诊治和管理中国共识(2023)专家组,中国罕见病联盟呼吸病学分会,中华医学会呼吸病学分会,等. 伯特-霍格-杜布综合征诊治和管理中国专家共识[J]. 中华结核和呼吸杂志, 2023, 46(9): 897-908. DOI: 10.3760/cma.j.cn112147-20230705-00362.
[10]Laviolette LA, Mermoud J, Calvo IA, et al. Negative regulation of EGFR signalling by the human folliculin tumour suppressor protein. Nature Communications. 2017 Jun;8:15866. DOI: 10.1038/ncomms15866. PMID: 28656962; PMCID: PMC5493755.
[11]Cohn SL, Pearson AD, London WB, Monclair T, Ambros PF, Brodeur GM, Faldum A, Hero B, Iehara T, Machin D, Mosseri V, Simon T, Garaventa A, Castel V, Matthay KK; INRG Task Force. The International Neuroblastoma Risk Group (INRG) classification system: an INRG Task Force report. J Clin Oncol. 2009 Jan 10;27(2):289-97. doi: 10.1200/JCO.2008.16.6785. Epub 2008 Dec 1. PMID: 19047291; PMCID: PMC2650388.

作者:苏州绘真医学
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#基因检测# #神经母细胞瘤# #FLCN胚系突变#
63