【AJRCCM】右心室结构和功能的性别特异性遗传决定因素
2024-10-14 肺动脉高压研究进展 肺动脉高压研究进展
本研究发现右心室结构和功能存在性别差异,确定性别特异性遗传位点,如 BMPR1A 与女性右心室功能相关,为探讨生物学途径提供方向。

研究背景:
右心和左心结构源自不同的胚胎细胞群,并在不同的生理条件下发挥作用。右心室(RV)与系统静脉回流和肺血管床耦合,承受相对较低的前负荷和后负荷条件。在心血管生理学和疾病中,性别差异十分常见。研究发现,在患心脏病较少的人群中,女性的右心室容积通常较小,而射血分数则高于男性。在主要影响右心室的疾病(如肺动脉高压,PAH)中,右心室衰竭仍是主要的死亡原因,性别差异在右心室功能和适应性方面可能解释了女性患者的生存优势。
揭示右心室结构和功能的性别差异背后的分子机制,可能为提高右心室功能和改善在长期负荷增加情况下的适应性提供新的策略。临床前和临床数据已经将性激素与右心室功能差异联系起来,而右心室组织转录谱的分析也发现了与男女右心室衰竭相关的不同通路。然而,鉴别这些分子机制仍然具有挑战性,部分原因是由于直接研究人类右心室的可及性有限,以及样本量较小。
机器学习的进展使得能够以可扩展的方式从图像中提取复杂的表型。这使得对右心室表型的大规模生物库研究成为可能,并揭示了其显著的遗传性。我们假设,考虑到中等至高水平的遗传性,观察到的右心室表型的性别差异可能部分与遗传因素有关。在本研究中,我们通过观察证据确认了右心室结构和功能的性别差异。无论左心功能和肺功能如何,这些发现都保持一致。通过按性别分层的遗传关联测试,我们发现了BMPR1A(骨形态发生蛋白受体1A)和DMRT2(doublesex和mab-3相关转录因子2)附近的性别特异性遗传位点,这些位点与右心室表型的关联仅在女性中发现。我们基于右心室组织的表观遗传数据优先考虑了BMPR1A位点,并在PAH女性患者中验证了其对心脏功能的影响。
尽管已经观察到右心结构表型存在性别差异,但其分子驱动因素仍不清楚。我们利用常见的遗传变异,探讨右心室(RV)结构和功能的性别差异背后的生物学机制。
研究方法:
右心室表型来自英国生物银行中18,156名女性和16,171名男性的心脏磁共振成像数据,基于深度学习方法,涵盖了舒张末期、收缩末期、搏出量以及射血分数。我们进行了观察性分析和按性别分层的全基因组关联研究。针对479名特发性或遗传性肺动脉高压(PAH)女性患者,评估了候选的女性特异性基因位点,这些患者参与了英国国家健康研究所生物资源罕见病研究。
研究结果:
在调整左心室功能和肺功能的模型中,性别与右心室容积和射血分数的差异有关。六个全基因组显著位点(13%)显示出女性与男性之间等位基因效应的异质性。其中包括两个仅存在于女性的性别特异性候选位点,即BMPR1A与右心室射血分数相关的位点,以及DMRT2附近与右心室收缩末期容积相关的位点。表观遗传数据表明,BMPR1A位点的变异可能会改变右心室组织中的转录调控。在患有PAH的女性患者中,BMPR1A启动子区域的一个变异与心脏指数显著相关(效应值为0.16 l/min/m²),尽管不同基因型组之间的右心室后负荷相似。
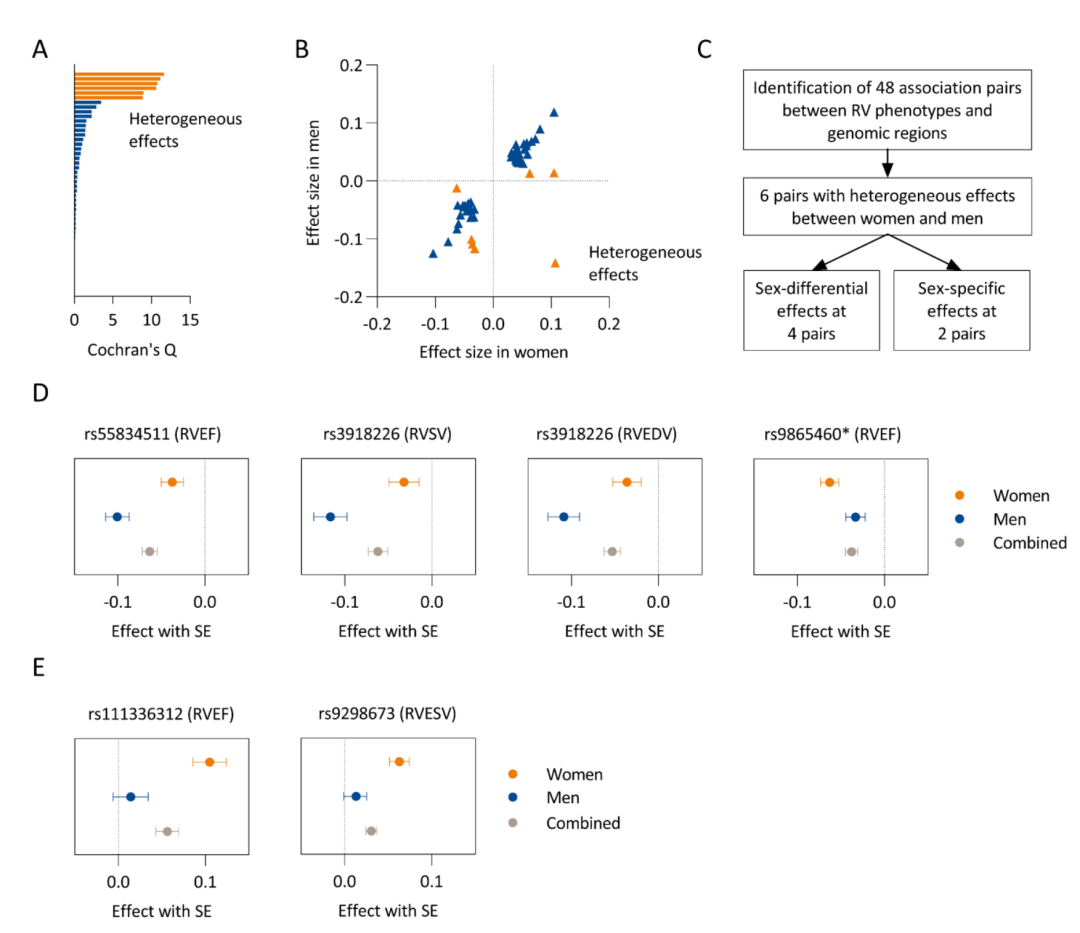
图 1:女性和男性之间等位基因效应的异质性。在图A和图B中,突出显示了六对关联对,它们在女性和男性之间表现出显著的异质性。这六对关联效应被分为四种性别差异效应,其中组合效应主要由其中一种性别驱动,以及两种仅存在于一种性别的性别特异性效应(图C)。性别差异的等位基因效应在图D中展示,性别特异性效应在图E中展示。星号表示由于女性和男性之间信号差异,在男性中使用了rs3851363(与女性中的主导变异r²=0.36)。
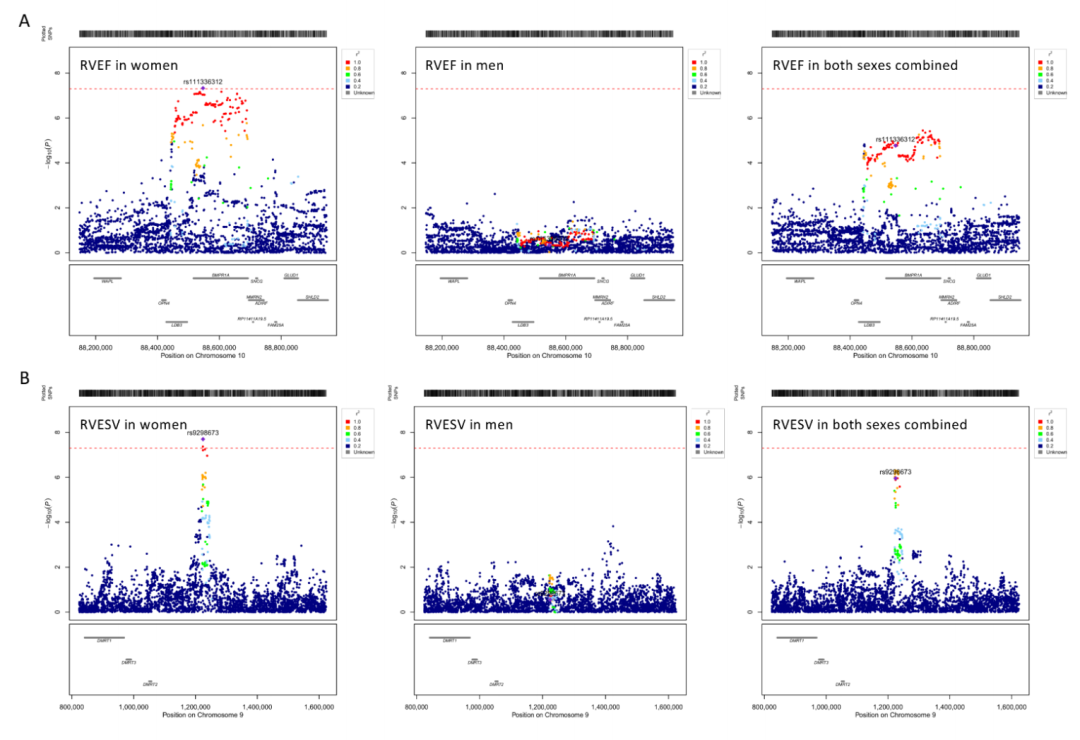
图 2:性别特异性基因座的区域关联。区域图展示了变异在基因组中的位置(x轴)及其关联强度(-log10(p值),y轴)。与主导变异的关联度(r²)通过颜色表示。在图A中,显示了染色体10上与右心室射血分数(RVEF)相关的位点。在图B中,展示了染色体9上与右心室收缩末期容积(RVESV)相关的位点。
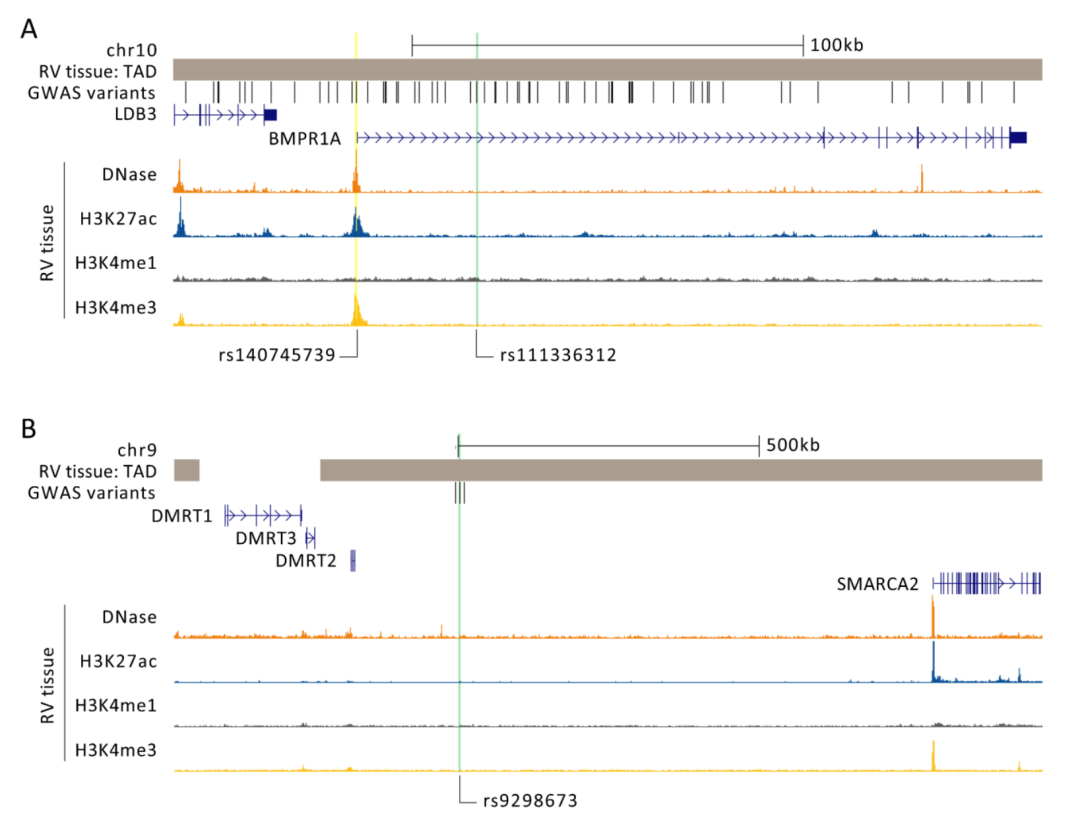
图 3:成年女性右心室(RV)组织中的表观遗传标记。拓扑关联结构域(TAD)指的是基于三维染色质结构(Hi-C图)相互靠近的基因组区域。图中展示了与主导变异具有高连锁不平衡(LD)(r²>0.9)的GWAS变异,主导变异用绿色突出显示。DNase I超敏感位点标记了易于转录因子访问的染色质区域。表观基因组修饰显示了可能包含活跃调控区域和启动子的区域。H3K4Me1通常存在于增强子中,H3K4Me3通常标记启动子,H3K27ac则常常标记活跃的调控区域。在图A中,展示了位于染色体10上与女性特异性RVEF相关的位点。此处,rs140745739变异(用黄色标出)与主导变异(r²=0.97)具有高度连锁不平衡,并位于BMPR1A的活跃启动子区域内。在图B中,展示了位于染色体9上与女性特异性RVESV相关的位点。DMRT2是最近的基因,并与GWAS变异共享一个TAD,但未发现相邻的活跃调控区域。
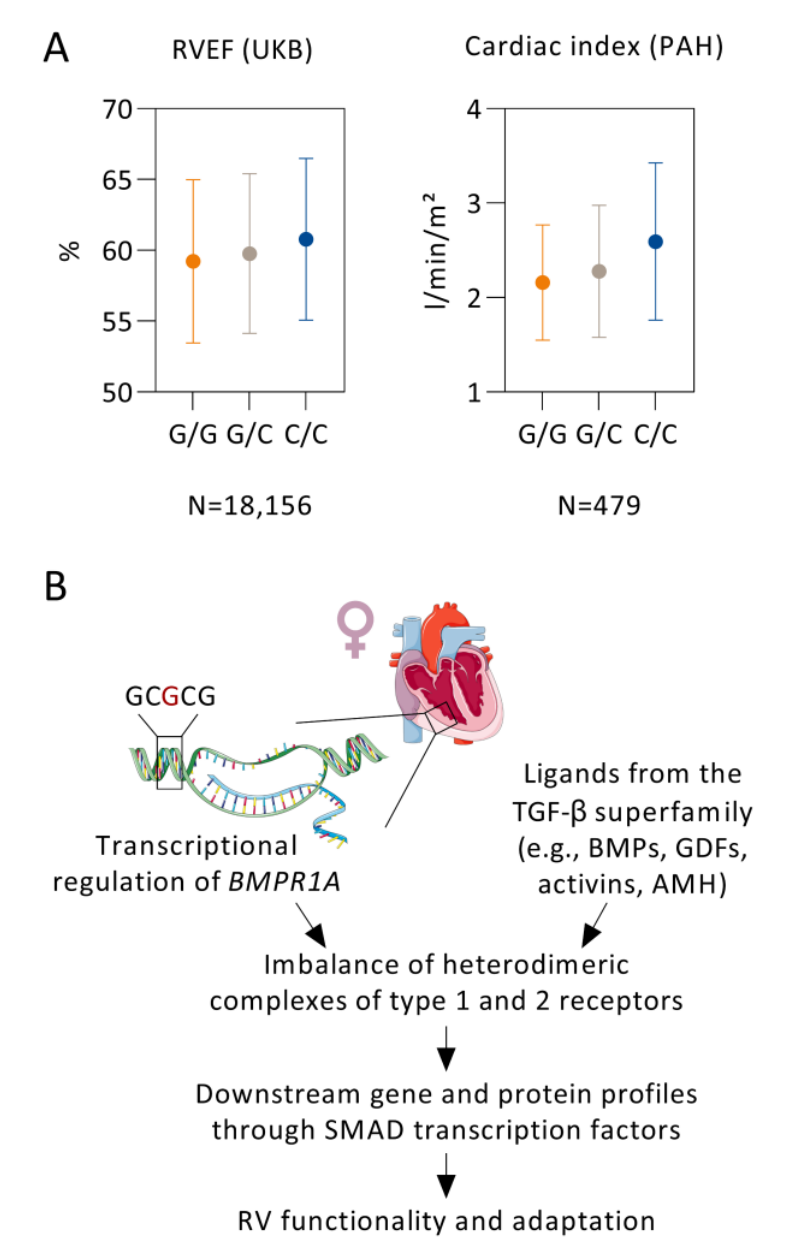
图 4:女性的BMPR1A基因座。在图A中,BMPR1A启动子变异(rs140745739,次要等位基因C)对英国生物银行(UKB)18,156名女性参与者的右心室射血分数(RVEF)以及479名特发性或遗传性肺动脉高压(PAH)女性患者的心脏指数的基因型效应进行了比对。数据以均值和标准差的形式呈现。在图B中,示意图描述了BMPR1A在女性右心室生物学中潜在的机制。
研究结论:
该研究阐述了与右心室结构和功能相关的性别特异性遗传位点。BMPR1A作为女性特异性右心室功能遗传决定的合理候选基因,在右心室长期后负荷增加的女性PAH患者中表现出与心脏功能相关的联系。进一步的研究需要探讨这些潜在的生物学途径。
参考文献:
Harbaum L, Hennigs JK, Pott J, Ostermann J, Sinning CR, Sau A, Sieliwonczyk E, Ng FS, Rhodes CJ, Tello K, Klose H, Gräf S, Wilkins MR. Sex-specific Genetic Determinants of Right Ventricular Structure and Function. Am J Respir Crit Care Med. 2024 Oct 7. doi: 10.1164/rccm.202404-0721OC. Epub ahead of print. PMID: 39374572.
作者:肺动脉高压研究进展
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#肺动脉高压# #性别差异# #右心室#
43